Tailieumoi.vn xin giới thiệu bộ đề thi giữa kì 1 môn Hóa học lớp 10 sách Chân trời sáng tạo năm 2025 – 2026. Tài liệu gồm 4 đề thi có ma trận chuẩn bám sát chương trình học và đáp án chi tiết, được biên soạn bởi đội ngũ giáo viên THPT dày dặn kinh nghiệm sẽ giúp các em ôn tập kiến thức và rèn luyện kĩ năng nhằm đạt điểm cao trong bài thi Giữa học kì 1 Hóa học 10. Mời các bạn cùng đón xem:
Chỉ từ 70k mua trọn bộ Đề thi giữa học kì 1 Hóa học 10 Chân trời sáng tạo bản word có lời giải chi tiết:
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Đề thi giữa kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 1
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1 - Chân trời sáng tạo
Năm học ......................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 1)
Câu 1: Cho các kết luận sau:
(a) Trong nguyên tử không có neutron
(b) Đồng vị là những nguyên tử có cùng số neutron và khác số khối
(c) Từ cấu hình electron nguyên tử có thể xác định được vị trí (chu kì, nhóm) của nguyên tố đó trong bảng tuần hoàn các nguyên tố hóa học
(d) Nitrogen ở nhóm VA, công thức với hợp chất khí hydrogen của nitrogen là HNO3
Số kết luận đúng là:
Câu 2: Theo chiều tăng của điện tích hạt nhân, độ âm điện của các nguyên tố trong cùng một chu kì:
A. Không thay đổi B. Tăng dần
C. Giảm dần D. Không có quy luật
Câu 3: Các nguyên tố thuộc cùng nhóm IIIA thì nguyên tử của chúng đều có
A. 3 electron phân lớp ngoài cùng B. 3 lớp electron
C. 3 phân lớp electron D. 3 electron ở lóp ngoài cùng
Câu 4: Cho kí hiệu nguyên tử số hiệu nguyên tử Fluorine là:
Câu 5: Lớp vỏ nguyên tử có chứa các hạt:
A. Electron, proton B. proton
C. Neutron, proton D. electron
Câu 6: Neon (Z=10) tách ra từu không khí là hỗn hợp của hai đồng vị với % về số nguyên tử tương ứng là (91%) và (9%). Nguyên tử khối trung bình của Ne là
Câu 7: Theo quy luật biến đổi tính chất các đơn chất trong bảng tuần hoàn thì
A. phi kim mạnh nhất là Iodine.
B. kim loại mạnh nhất là Lithium.
C. phi kim mạnh nhất là Oxygen.
D. phi kim mạnh nhất là Fluorine.
Câu 8: Nguyên tố R có tổng số hạt mang điện và không mang điện là 34. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 10 hạt. Kí hiệu và vị trí của R trong bảng tuần hoàn là:
A. Ne, chu kì 2, nhóm VIIIA.
B. Na, chu kì 3, nhóm IA.
C. Mg, chu kì 3, nhóm IIA.
D. F, chu kì 2, nhó VIIA.
Câu 9: Nguyên tắc sắp xếp các nguyên tố vào bảng tuần hoàn:
(1) Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử ;
(2) Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một hàng ;
(3) Các nguyên tố có cùng số electron hóa trị được xếp vào một cột ;
(4) Số thứ tự của ô nguyên tố bằng số hiệu của nguyên tố đó
Số nguyên tắc đúng là:
A. 1.
B. 2.
C. 3.
D. 4.
Câu 10: Nguyên tử nguyên tố X có tổng electron ở phân lớp d bằng 6. Vị trí của X trong tuần hoàn các nguyên ố hóa học là
A. ô 24, chu kì 4 nhóm VIB.
B. ô 29, chu kì 4 nhóm IB.
C. ô 26, chu kì 4 nhóm VIIIB.
D. ô 19, chu kì 4 nhóm IA.
Câu 11: Cho 3,6 gam kim loại R thuộc nhóm IIA tác dụng với dung dịch HCl thu được 3, 36 lít H2 (đktc). Nguyên tố R là:
Câu 12: Đại lượng đặc trưng cho sự hút electron của nguyên tử các nguyên tố khi hình thành liên kết hóa học là:
A. Tính kim loại B. Tính phi kim
C. Điện tích hạt nhân D. Độ âm điện
Câu 13: Một nguyên tố R có Z = 16. Có bao nhiêu phát biểu đúng về R trong các phát biểu sau:
Câu 14 Cho các cấu hình electron sau:
(a) 1s22s1 (b) 1s22s22p63s23p64s1 (c) 1s22s22p63s23p1
(b) (d) 1s22s22p4 (e) 1s22s22p63s23p6 3d8 4s2 (g) 1s22s22p63s23p5
Có mấy cấu hình electron là của kim loại:
Câu 15: Liên kết trong phân tử KCl là liên kết:
A. Cho – nhận B. cộng hóa trị không phân cực
C. Cộng hóa trị phân cực D. ion
II. Tự luận: (5 điểm)
Câu 1: (1, 5 điểm) Cho 20,55 gam một kim loại R có hóa trị II tác dụng với nước vừa đủ thu được 3,36 lít khí H2 ở đktc và dung dịch A
a) Xác định tên kim loại R
b) Cho 40 ml dung dịch Al2(SO4)3 nồng độ 0,3M và dung dịch A thu được m gam kết tủa. Tính m?
Câu 2: (2,0 điểm) Tổng số hạt trong nguyên tử nguyên tố X là 48 hạt. Trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt
Câu 3 (1, 5 điểm) Biết rằng trong tự nhiên thành phần phần trăm số nguyên tử các đồng vị potassium là:
Hướng dẫn giải:
I. Trắc nghiệm
|
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
11 |
12 |
13 |
14 |
15 |
|
A |
B |
D |
A |
D |
A |
D |
B |
D |
C |
B |
D |
C |
D |
D |
Lời giải chi tiết
Câu 1:
(a) Đúng
(b) Sai vì đồng vị là những nguyên rử có cùng số proton và khác số khối
(c) Đúng
(d) Sai vì CT hợp chất khí có dạng NH3
-> Đáp án A
Câu 2
Độ âm điện của các nguyên tố trong cùng một chu kì tăng dần
-> Đáp án B
Câu 3:
Số thứ tự nhóm bằng số electron lớp ngoài cùng
-> đáp án D
Câu 4:
Đáp án A
Câu 5:
Lớp vỏ nguyên tử chứa hạt electron
-> Đáp án D
Câu 6:
Áp dụng công thức tính nguyên tử khối trung bình
-> Đáp án A
Câu 7:
Theo chiều tăng dần điện tích hạt nhân
- Trong 1 chu kì tính phi kim tăng dần
- Trong một nhóm tính phi kim giảm dần
Nguyên tố F đứng cuối chu kì 2 và đầu nhóm VIIA
-> F là phi kim mạnh nhất
Câu 8:
Gọi P, N, E lần lượt là số proton, neutron và electron của R
Tổng số hạt trong nguyên tử nguyên tố X là 34
→ P + N + E =34 (1)
số nơtron nhiều hơn số proton là 1
→ P + E – N = 10 (2)
Mà P = E (3)
Từ (1), (2) và (3), giải hệ phương trình => P = E = 11 và N = 12
-> R là Na
-> Cấu hình electron của R là 1s22s22p63s1
-> vị trí của R là: chu kì 3 nhóm IA
Câu 9:
Đáp án D
Câu 10:
X có tổng electron ở phân lớp d bằng 6
-> X có cấu hình electron: 1s22s22p63s23p63d64s2
-> Vị trí của X là: ô 26, chu kì 4 nhóm VIIIB
-> Đáp án C
Câu 11:
PTHH: R + 2HCl → RCl2 + H2
(mol)
Theo PTHH:
=> R là Mg
-> Đáp án B
Câu 12:
Đáp án D
Câu 13
R (Z = 16)
Cấu hình electron: 1s22s22p63s23p4
(1) Đúng
(2) Sai vì R có 6 electron ngoài cùng
(3) Đúng
(4) Sai vì có 6 electron ngoài cùng -> phi kim
-> Đáp án C
Câu 14
Nguyên tố kim loại có 1, 2, 3 electron ngoài cùng và các nguyên tố nhóm B
-> (a), (b), (c), (e) là kim loại
-> Đáp án D
Câu 15:
Đáp án D vì KCl tạo bởi nguyên tố kim loại và phi kim điển hình
II. Tự luận
Câu 1:
a) PTHH: R + 2HCl → RCl2 + H2
(mol)
Theo PTHH:
=> R là Barium (Ba)
b) PTHH
Ta có
-> hết, dư
-> (mol)
=> (g)
Câu 2:
a) Gọi P, N, E lần lượt là số proton, neutron và electron của R
Tổng số hạt trong nguyên tử nguyên tố X là 48
→ P + N + E =48 (1)
số nơtron nhiều hơn số proton là 1
→ P + E – N = 16 (2)
Mà P = E (3)
Từ (1), (2) và (3), giải hệ phương trình => P = E = 16 và N = 16
b) Cấu hình electron của X : 1s22s22p63s23p4
-> Vị trí của X : chu kì 3, nhóm VIA
X có 6 electron lớp ngoài cùng -> X là phi kim
c) Cấu hình electron của ion S2- : 1s22s22p63s23p6
d) Công thức oxit cao nhất: XO3
Công thức hydroxit cao nhất: X(OH)6
Câu 3 :
a) Áp dụng công thức tính nguyên tử khối trung bình
b) PTHH : 2K + 2H2O → 2KOH + H2
Theo PTHH : (mol)
=> (lít)
Ma trận đề kiểm tra giữa kì 1 Hóa học 10 Chân trời sáng tạo
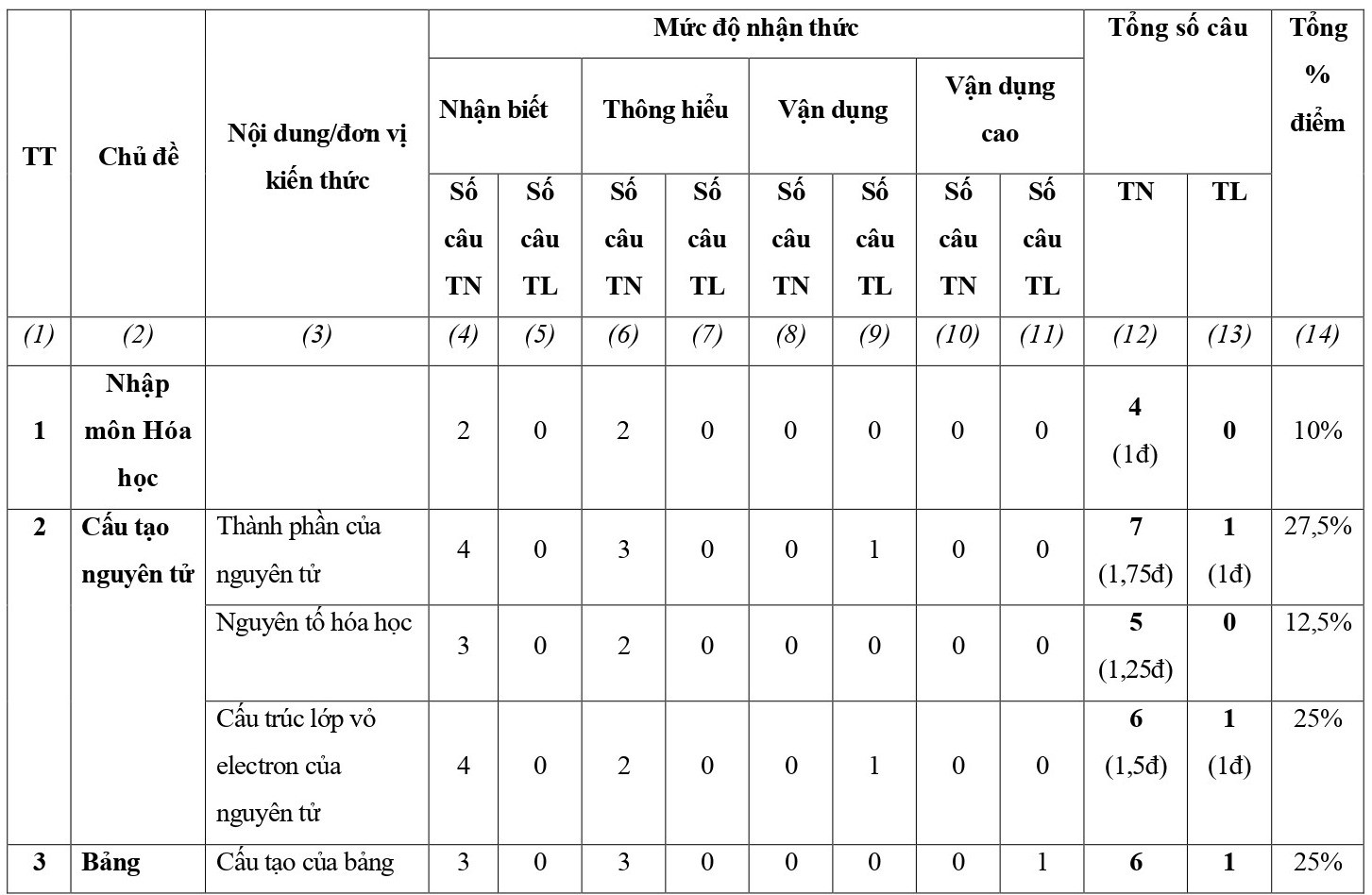
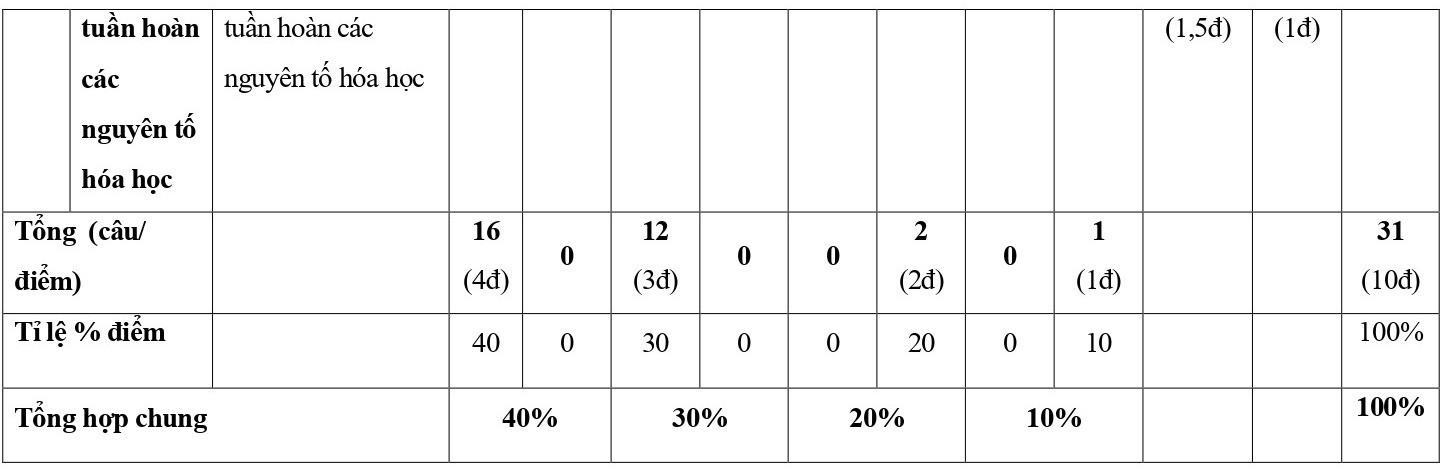
Lưu ý:
- Hình thức kiểm tra: Kết hợp giữa trắc nghiệm và tự luận (tỉ lệ 70% trắc nghiệm, 30% tự luận).
- Cấu trúc:
+ Mức độ đề: 40% Nhận biết; 30% Thông hiểu; 20% Vận dụng; 10% Vận dụng cao.
+ Phần trắc nghiệm: 28 câu, 7,0 điểm (gồm 16 câu ở mức độ nhận biết;12 câu ở mức độ thông hiểu), mỗi câu 0,25 điểm;
+ Phần tự luận: 3,0 điểm (Vận dụng: 02 câu, 2,0 điểm; Vận dụng cao: 1-2 câu, 1,0 điểm).
- Các câu hỏi ở mức độ nhận biết và thông hiểu là các câu hỏi trắc nghiệm khách quan 4 lựa chọn, trong đó có duy nhất 1 lựa chọn đúng; các câu hỏi ở mức độ vận dụng và vận dụng cao là các câu hỏi tự luận.
- Với các câu hỏi TNKQ ở mức độ nhận biết và mức độ thông hiểu, mỗi câu hỏi kiểm tra, đánh giá 01 yêu cầu cần đạt của chương trình.
- Không chọn câu ở mức độ vận dụng và câu ở mức độ vận dụng cao trong cùng một đơn vị kiến thức.
Đề thi giữa kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 2
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1 - Chân trời sáng tạo
Năm học ......................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 2)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc không đối tượng nghiên cứu của Hóa học?
A. Cấu tạo của chất và sự biến đổi của chất.
B. Sự vận chuyển của máu trong hệ tuần hoàn.
C. Sự chuyển hóa thức ăn trong hệ tiêu hóa.
D. Giải pháp nhằm giảm thiểu tác hại của mưa acid.
Câu 2: Một loại nến được làm bằng paraffin, khi đốt nến, xảy ra các quá trình sau:
(1) Paraffin nóng chảy;
(2) Paraffin lỏng chuyển thành hơi;
(3) Hơi paraffin cháy biến đổi thành khí CO2 và hơi nước.
Quá trình nào có sự biến đổi hoá học?
A. (1). B. (2). C. (3). D. (1), (2), (3).
Câu 3: Khi nghiên cứu thành phần hóa học và bước đầu ứng dụng tinh dầu tràm trà trong sản xuất nước súc miệng, các nhà nghiên cứu đã tiến hành: “Nghiên cứu thành phần hóa học, ứng dụng của tinh dầu tràm trà làm nước súc miệng qua các công trình khoa học trên các tạp chí đã được xuất bản”. Bước làm này ứng với bước nào trong phương pháp nghiên cứu hóa học?
A. Xác định vấn đề nghiên cứu.
B. Nêu giả thuyết khoa học.
C. Thực hiện nghiên cứu (lí thuyết, thực nghiệm, ứng dụng).
D. Viết báo cáo: thảo luận kết quả và kết luận vấn đề.
Câu 4: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và proton.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Câu 5: Trong nguyên tử, loại hạt có khối lượng và mang điện tích âm là
A. hạt nhân.
B. hạt proton.
C. hạt neutron.
D. hạt electron.
Câu 6: Phát biểu nào sau đây không đúng?
A. Điện tích của proton và electron có cùng độ lớn nhưng ngược dấu.
B. Có những nguyên tử không có neutron.
C. Có những nguyên tử không có proton.
D. Khối lượng của proton và neutron xấp xỉ bằng nhau và lớn hơn nhiều khối lượng của electron.
Câu 7: Nguyên tử fluorine (kí hiệu là: F) có 9 proton, 9 electron và 10 neutron. Điện tích hạt nhân nguyên tử F là
A. 9+. B. +9. C. +10. D. 10+.
Câu 8: Hạt nhân nguyên tử X có điện tích là +17,622.10-19 coulomb. Vậy nguyên tử X là
A. Na (Z = 11).
B. K (Z = 19).
C. Ca (Z = 20).
D. Cl (Z = 17).
Câu 9: Thành phần nào bị lệch hướng trong trường điện?
A. Neutron.
B. Electron.
C. Nguyên tử hydrogen.
D. Nguyên tử oxygen.
Câu 10: Nguyên tử X có 26 proton trong hạt nhân. Cho các phát biểu sau về X:
(1) X có 26 neutron trong hạt nhân.
(2) X có 26 electron ở vỏ nguyên tử.
(3) X có điện tích hạt nhân là + 26.
(4) Khối lượng nguyên tử X là 26 amu.
Trong các phát biểu trên, số phát biểu đúng là
A. 1. B. 2. C. 3. D. 4.
Câu 11: Số hiệu nguyên tử cho biết
A. số proton trong hạt nhân nguyên tử.
B. điện tích hạt nhân nguyên tử.
C. số electron trong nguyên tử.
D. cả A, B, C đều đúng.
Câu 12: Một nguyên tử X gồm 16 proton, 16 electron và 16 neutron. Nguyên tử X có kí hiệu là
A. .
B. .
C. .
D. .
Câu 13: Số hạt mang điện trong nguyên tử là
A. 3. B. 7. C. 6. D. 4.
Câu 14: Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có
A. cùng số proton nhưng khác nhau về số neutron.
B. cùng số neutron nhưng khác nhau về số proton.
C. cùng tổng số proton và neutron nhưng khác nhau về số electron.
D. cùng số electron nhưng khác nhau về tổng số proton và neutron.
Câu 15: Thông tin nào sau đây không đúng về ?
A. Số đơn vị điện tích hạt nhân là 82.
B. Số proton và neutron là 82.
C. Số neutron là 124.
D. Số khối là 206.
Câu 16: Nguyên tử khối trung bình của nguyên tố X là 35,48. Biết trong tự nhiên, X có hai đồng vị, trong đó đồng vị 35X chiếm 75,77% số nguyên tử. Số khối của đồng vị còn lại là
A. 36. B. 37.
C. 38. D. 39.
Câu 17: Orbital nguyên tử là
A. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron là nhỏ nhất.
B. khu vực không gian xung quanh nguyên tử mà tại đó xác suất có mặt electron là lớn nhất.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron khoảng 90%.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 18: Orbital s có dạng
A. hình elip.
B. hình cầu.
C. hình số tám nổi.
D. hình bầu dục.
Câu 19: Số electron tối đa trong phân lớp 3p là
A. 8. B. 6. C. 3. D. 2.
Câu 20: Cấu hình electron nguyên tử nitrogen (Z = 7) là
A. 1s22s22p3.
B. 1s22s32p4.
C. 1s22s22p4.
D. 1s12s12p5.
Câu 21: Cho cấu hình electron nguyên tử của các nguyên tố sau:
X: 1s22s22p63s2;
Y: 1s22s22p63s23p64s1;
Z: 1s22s22p63s23p3;
T: 1s22s22p63s23p63d84s2.
Các nguyên tử của nguyên tố kim loại là
A. X, Y, Z.
B. X, Y, T.
C. Y, Z, T.
D. X, Z, T.
Câu 22: Lớp M có số electron tối đa bằng
A. 3. B. 4. C. 9. D. 18.
Câu 23: Mendeleev đã xây dựng bảng tuần hoàn bằng cách sắp xếp các nguyên tố theo chiều tăng dần của
A. số khối.
B. số hiệu nguyên tử.
C. khối lượng nguyên tử.
D. bán kính nguyên tử.
Câu 24: Trong bảng hệ thống tuần hoàn, chu kì là dãy các nguyên tố mà
A. nguyên tử của chúng có cùng số electron lớp vỏ ngoài cùng.
B. cấu hình electron giống hệt nhau.
C. nguyên tử của chúng có cùng số lớp electron.
D. cấu hình electron lớp vỏ giống hệt nhau.
Câu 25: Trong bảng hệ thống tuần hoàn các nguyên tố hóa học hiện nay, số chu kì nhỏ và chu kì lớn là
A. 3 và 3.
B. 3 và 4.
C. 4 và 3.
D. 4 và 4.
Câu 26: Chu kì 3 của bảng hệ thống tuần hoàn có
A. 2 nguyên tố.
B. 8 nguyên tố.
C. 10 nguyên tố.
D. 18 nguyên tố.
Câu 27: Nguyên tố X có cấu hình electron 1s22s22p63s23p64s1 thuộc
A. ô 19, chu kì 4, nhóm IA.
B. ô 19, chu kì 4, nhóm IB.
C. ô 19, chu kì 3, nhóm IVA.
A. ô 19, chu kì 3, nhóm IA.
Câu 28: Trong bảng tuần hoàn, nguyên tố chlorine (kí hiệu: Cl) nằm ở chu kì 3, nhóm VIIA. Cấu hình electron của Cl là
A. 1s22s22p5.
B. 1s22s22p63s23p5.
C. 1s22s22p63s2.
D. 1s22s22p63s23p3.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt.
a) Xác định thành phần cấu tạo của nguyên tử X.
b) Viết cấu tạo nguyên tử X.
Câu 2 (1 điểm): Viết cấu hình electron dưới dạng ô lượng tử của các nguyên tử và . Hãy cho biết các nguyên tố này là kim loại, phi kim hay khí hiếm.
Câu 3 (1 điểm): Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì, có tổng số điện tích hạt nhân bằng 25. Biết ZX < ZY, xác định vị trí của X, Y trong bảng tuần hoàn, có giải thích ngắn gọn cách xác định.
Đáp án đề thi Hóa học lớp 10 Giữa học kì 1 Chân trời sáng tạo - (Đề số 2)
NĂM HỌC 2022 – 2023
MÔN: HÓA HỌC 10 (CHÂN TRỜI SÁNG TẠO)
Phần I: Trắc nghiệm
|
1-B |
2-C |
3-A |
4-B |
5-D |
6-C |
7-B |
8-A |
9-B |
10-B |
|
11-D |
12-C |
13-C |
14-A |
15-B |
16-B |
17-C |
18-B |
19-B |
20-A |
|
21-B |
22-D |
23-C |
24-C |
25-B |
26-B |
27-A |
28-B |
|
|
Câu 1:
Đáp án đúng là: B
Hóa học nghiên cứu về thành phần, cấu trúc, tính chất và sự biến đổi của chất cũng như ứng dụng của chúng.
Vậy sự vận chuyển của máu trong hệ tuần hoàn không thuộc đối tượng nghiên cứu của hóa học.
Câu 2:
Đáp án đúng là: C
Quá trình (3) có sự biến đổi hóa học do có sự tạo thành chất mới là CO2 và nước.
Câu 3:
Đáp án đúng là: A
Bước “nghiên cứu thành phần hóa học, ứng dụng của tinh dầu tràm trà làm nước súc miệng qua các công trình khoa học trên các tạp chí đã được xuất bản” ứng với bước xác định vấn đề nghiên cứu trong phương pháp nghiên cứu hóa học.
Câu 4:
Đáp án đúng là: B
Hạt nhân của hầu hết các nguyên tử được cấu tạo nên bởi các hạt proton và neutron.
Câu 5:
Đáp án đúng là: D
Trong nguyên tử tồn tại một loại hạt có khối lượng và mang điện tích âm là electron.
Câu 6:
Đáp án đúng là: C
Phát biểu C không đúng vì tất cả các nguyên tử đều có proton trong hạt nhân.
Câu 7:
Đáp án đúng là: B
Nguyên tử fluorine (kí hiệu là: F) có 9 proton nên điện tích hạt nhân nguyên tử fluorine là +9.
Câu 8:
Đáp án đúng là: A
Số proton có trong nguyên tử X là:
X có số hiệu nguyên tử = số proton = 11. Vậy X là Na.
Câu 9:
Đáp án đúng là: B
Electron mang điện tích âm nên bị lệch hướng trong trường điện.
Câu 10:
Đáp án đúng là: B
Các phát biểu (2), (3) đúng.
Phát biểu (1) sai vì chỉ dựa vào số proton chưa thể xác định được số neutron.
Phát biểu (4) sai vì khối lượng nguyên tử xấp xỉ số khối A = Z + N > 26 amu.
Câu 11:
Đáp án đúng là: D
Số hiệu nguyên tử (Z) = số proton = số electron = số đơn vị điện tích hạt nhân nguyên tử.
Câu 12:
Đáp án đúng là: C
Nguyên tử X có:
+ Số hiệu nguyên tử (Z) = số proton = 16.
+ Số khối (A) = số proton + số neutron = 16 + 16 = 32.
Kí hiệu nguyên tử là: .
Câu 13:
Đáp án đúng là: C
Li có:
+ Số hiệu nguyên tử (Z) = 3 = số proton = số electron.
+ Số hạt mang điện = số proton + số electron = 2Z = 6.
Câu 14:
Đáp án đúng là: A
Các đồng vị của cùng một nguyên tố hóa học là những nguyên tử có cùng số proton nhưng khác nhau về số neutron.
Câu 15:
Đáp án đúng là: B
Dựa vào kí hiệu nguyên tử xác định được, Pb có:
+ Số đơn vị điện tích hạt nhân = số proton = số electron = số hiệu nguyên tử (Z) = 82.
+ Số khối (A) = 206.
+ Số neutron = A – Z = 206 – 82 = 124.
Câu 16:
Đáp án đúng là: B
Gọi số khối của đồng vị thứ 2 là A, áp dụng công thức ta có:
Câu 17:
Đáp án đúng là: C
Khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt (xác suất tìm thấy) electron khoảng 90% gọi là orbital nguyên tử.
Câu 18:
Đáp án đúng là: B
Orbital s có dạng hình cầu.
Câu 19:
Đáp án đúng là: B
Số electron tối đa trong phân lớp 3p là 6.
Câu 20:
Đáp án đúng là: A
Cấu hình electron nguyên tử nitrogen (Z = 7): 1s22s22p3.
Câu 21:
Đáp án đúng là: B
+ X và T có 2 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
+ Y có 1 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố kim loại.
+ Z có 5 electron ở lớp ngoài cùng nên là nguyên tử của nguyên tố phi kim.
Câu 22:
Đáp án đúng là: D
Lớp M (n = 3) có số electron tối đa là 2.32 = 18.
Câu 23:
Đáp án đúng là: C
Mendeleev đã xây dựng bảng tuần hoàn bằng cách sắp xếp các nguyên tố theo chiều tăng dần của khối lượng nguyên tử.

Bảng tuần hoàn viết tay của Medeleev
Câu 24:
Đáp án đúng là: C
Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng, gọi là chu kì.
Câu 25:
Đáp án đúng là: B
Bảng tuần hoàn hiện nay gồm có 7 chu kì:
+ Các chu kì 1, 2 và 3 là các chu kì nhỏ;
+ Các chu kì 4, 5, 6 và 7 là các chu kì lớn.
Câu 26:
Đáp án đúng là: B
Chu kì 3 của bảng tuần hoàn có 8 nguyên tố.
Câu 27:
Đáp án đúng là: A
Dựa vào cấu hình electron xác định được nguyên tố X ở ô thứ 19 (do số hiệu nguyên tử = số electron = 19), chu kì 4 (do có 4 lớp electron), nhóm IA (do 1 electron hóa trị, nguyên tố s).
Câu 28:
Đáp án đúng là: B
Nguyên tử Cl nằm ở chu kì 3 nên có số lớp e = số thứ tự chu kì = 3.
Nguyên tử Cl thuộc nhóm VIIA nên có cấu hình electron lớp ngoài cùng là ns2np5 (có 7 electron lớp ngoài cùng).
Vậy cấu hình electron của Cl là 1s22s22p63s23p5.
Phần II: Tự luận
Câu 1:
a) Gọi P, N và E lần lượt là số proton, neutron và electron của X. Trong đó P = E.
Theo bài ra, ta có hệ phương trình:
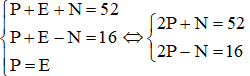
Vậy trong X có 17 proton; 17 electron và 18 neutron.
b) X có:
+ Số hiệu nguyên tử (Z) = số proton = 17.
+ Số khối (A) = số proton + số neutron = 17 + 18 = 35.
Vậy kí hiệu nguyên tử X là:
Câu 2:
+ :
Dựa vào kí hiệu nguyên tử xác định được số hiệu nguyên tử Mg là 12.
Cấu hình electron nguyên tử Mg: 1s22s22p63s2.
Cấu hình electron Mg theo ô orbital:
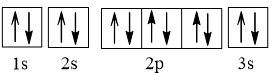
Mg là kim loại do có 2 electron ở lớp ngoài cùng.
+ :
Dựa vào kí hiệu nguyên tử xác định được số hiệu nguyên tử Ca là 20.
Cấu hình electron nguyên tử Ca: 1s22s22p63s23p64s2.
Cấu hình electron Ca theo ô orbital:
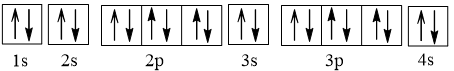
Ca là kim loại do có 2 electron ở lớp ngoài cùng.
Câu 3:
a) X và Y đứng kế tiếp nhau trong cùng một chu kì nên số đơn vị điện tích hạt nhân của chúng chỉ khác nhau 1 đơn vị.
Do ZX < ZY, ta có ZY = ZX + 1 (1)
Theo bài ra, tổng số điện tích hạt nhân của X và Y là 25 nên:
ZX + ZY = 25 (2)
Từ (1) và (2) giải hệ phương trình có ZX = 12 và ZY = 13.
+ Cấu hình electron của X là: 1s22s22p63s2.
Vậy X ở ô thứ 12 (do Z = 12); chu kì 3 (do có 3 lớp electron); nhóm IIA (do nguyên tố s, 2 electron hóa trị).
+ Cấu hình electron của Y là: 1s22s22p63s23p1.
Vậy Y ở ô thứ 13 (do Z = 13); chu kì 3 (do có 3 lớp electron); nhóm IIIA (do nguyên tố p, 3 electron hóa trị).
Đề thi giữa kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 3
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1 - Chân trời sáng tạo
Năm học ......................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 3)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của Hóa học?
A. Sự vận chuyển của máu trong hệ tuần hoàn.
B. Sự quang hợp của cây xanh.
C. Sự chuyển hóa thức ăn trong hệ tiêu hóa.
D. Sự truyền âm trong chân không.
Câu 2: Trong các hiện tượng sau đây hiện tượng nào là hiện tượng vật lí?
A. Lưu huỳnh (sulfur) cháy trong không khí, tạo ra chất khí mùi hắc.
B. Đốt cháy khí methane, thu được khí carbon dioxide và hơi nước.
C. Hòa tan đường vào nước, thu được dung dịch nước đường.
D. Nung đá vôi, thu được vôi sống và khí carbon dioxide.
Câu 3: Khi nghiên cứu thành phần hóa học và bước đầu ứng dụng tinh dầu tràm trà trong sản xuất nước súc miệng, các nhà nghiên cứu đã đặt ra giả thuyết: “Tinh dầu tràm trà có khả năng kháng khuẩn”. Bước đặt giả thuyết này ứng với bước nào trong phương pháp nghiên cứu hóa học?
A. Xác định vấn đề nghiên cứu.
B. Nêu giả thuyết khoa học.
C. Thực hiện nghiên cứu (lí thuyết, thực nghiệm, ứng dụng).
D. Viết báo cáo: thảo luận kết quả và kết luận vấn đề.
Câu 4: Phương pháp nghiên cứu vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng … được gọi là
A. phương pháp nghiên cứu lí thuyết.
B. phương pháp nghiên cứu thực nghiệm.
C. phương pháp nghiên cứu ứng dụng.
D. phương pháp nghiên cứu lí luận.
Câu 5: Hạt mang điện trong hạt nhân nguyên tử là
A. electron và proton.
B. neutron.
C. proton.
D. proton và neutron.
Câu 6: Nhận định nào sau đây không đúng?
A. Nguyên tử có kích thước vô cùng nhỏ và trung hòa về điện.
B. Lớp vỏ nguyên tử chứa electron mang điện tích âm.
C. Khối lượng nguyên tử hầu hết tập trung ở hạt nhân.
D. Tất cả các hạt nhân nguyên tử đều chứa proton và neutron.
Câu 7: Hạt nhân của nguyên tử X có điện tích là +30,438.10-19 coulomb. Vậy nguyên tử X là
A. Ar (Z = 18).
B. K (Z = 19).
C. Ca (Z = 20).
D. Cl (Z = 17).
Câu 8: Nguyên tử alminium (kí hiệu: Al) có số hạt mang điện tích dương là 13, số hạt không mang điện là 14. Số hạt electron trong Al là
A. 27. B. 26. C. 13. D. 14.
Câu 9: Nếu hạt nhân nguyên tử có Z hạt proton thì
A. Số đơn vị điện tích hạt nhân là Z+.
B. Điện tích hạt nhân là Z.
C. Số hạt neutron là Z.
D. Tổng số hạt mang điện trong nguyên tử là 2Z.
Câu 10: Nguyên tử trung hòa về điện vì
A. có tổng số hạt proton bằng tổng số hạt electron.
B. có tổng số hạt electron bằng tổng số hạt neutron.
C. tổng số hạt neutron bằng tổng số hạt proton.
D. được tạo nên bởi các hạt không mang điện.
Câu 11: Đặc điểm của hạt electron là
A. mang điện tích dương và có khối lượng.
B. mang điện tích âm và có khối lượng.
C. không mang điện và có khối lượng.
D. mang điện tích âm và không có khối lượng.
Câu 12: Nguyên tố hóa học là tập hợp các nguyên tử có cùng
A. điện tích hạt nhân.
B. số khối.
C. số electron.
D. neutron.
Câu 13: Nguyên tử có
A. 13 proton, 13 electron, 14 neutron.
B. 13 proton, 14 electron, 14 neutron.
C. 13 proton, 14 electron, 13 neutron.
D. 14 proton, 14 electron, 13 neutron.
Câu 14: Dãy nào sau đây gồm các nguyên tử thuộc cùng một nguyên tố hoá học?
B. .
C. .
D. .
Câu 15: Nhận định nào không đúng? Hai nguyên tử và
A. là đồng vị của nhau.
B. có cùng số electron.
C. có cùng số neutron.
D. có cùng số hiệu nguyên tử.
Câu 16: Trong tự nhiên, bromine có hai đồng vị bền là chiếm 50,69% số nguyên tử và chiếm 49,31% số nguyên tử. Nguyên tử khối trung bình của bromine là
A. 80,00.
B. 80,112.
C. 80,986.
D. 79,986.
Câu 17: Hình ảnh dưới đây là hình dạng của những loại orbital nguyên tử nào?
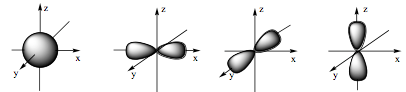
A. s, d.
B. d, f.
C. s, p.
D. p, f.
Câu 18: Số electron tối đa ở lớp thứ n (n ≤ 4) là
A. n. B. 2n. C. 2n2. D. n2.
Câu 19: Electron thuộc lớp nào sau đây liên kết chặt chẽ nhất với hạt nhân?
A. Lớp N.
B. Lớp L.
C. Lớp M.
D. Lớp K.
Câu 20: Nguyên tử nào sau đây có 3 electron ở lớp ngoài cùng?
A. N (Z = 7).
B. Na (Z = 11).
C. Al (Z = 13).
D. C (Z = 6).
Câu 21: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
A. ![]()
B. ![]()
C. ![]()
D. ![]()
Câu 22: Trong bảng tuần hoàn hiện nay, các nguyên tố được sắp xếp không theo nguyên tắc nào?
A. Theo chiều tăng của điện tích hạt nhân.
B. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một hàng.
C. Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp thành một cột.
D. Theo chiều tăng khối lượng nguyên tử.
Câu 23: Một nguyên tố hóa học X ở chu kì 3, nhóm IVA. Cấu hình electron của nguyên tử X là
A. 1s22s22p63s23p2.
B. 1s22s22p63s23p4.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p5.
Câu 24: Hầu hết các chu kì trong bảng tuần hoàn các nguyên tố hóa học đều bắt đầu bằng
A. kim loại kiềm thổ.
B. kim loại kiềm.
C. halogen.
D. khí hiếm.
Câu 25: Bảng tuần hoàn hiện nay có số cột là
A. 8. B. 16. B. 9. D. 18.
Câu 26: Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng
A. số electron hóa trị.
B. số hiệu nguyên tử.
C. số lớp electron.
D. số khối.
Câu 27: Cho biết cấu hình electron nguyên tử của các nguyên tố X: 1s22s22p63s2; Y: 1s22s22p63s23p64s1; Z: 1s22s22p63s23p5. Nguyên tố nào là kim loại?
A. X.
B. Z.
C. X và Y.
D. Y.
Câu 28: Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 9. Vậy X thuộc loại nguyên tố nào sau đây?
A. s. B. d. C. f. D. p.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Iron (hay sắt, kí hiệu Fe) là kim loại được sử dụng phổ biến trong các ngành xây dựng hoặc sản xuất đồ gia dụng. Hạt nhân của nguyên tử iron có điện tích bằng +26 và số khối bằng 56.
a) Tính số proton, số neutron và số electron có trong nguyên tử iron.
b) Viết kí hiệu nguyên tử iron.
Câu 2 (1 điểm): Viết cấu hình electron nguyên tử của các nguyên tố: aluminium (Z = 13); phosphorus (Z = 15) và biểu diễn cấu hình electron của chúng theo ô orbital. Từ đó, xác định số electron độc thân của mỗi nguyên tử này.
Câu 3: Phosphorus (P) được dùng vào mục đích quân sự như sản xuất bom, đạn cháy, đạn khói. Biết tổng số hạt trong nguyên tử P là 46, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 14 hạt.
a) Xác định vị trí phosphorus trong bảng tuần hoàn (có giải thích ngắn gọn cách xác định).
b) Phân loại nguyên tố P dựa vào cấu hình electron và tính chất hóa học.
Đáp án đề thi Hóa học lớp 10 Giữa học kì 1 Chân trời sáng tạo - (Đề số 3)
NĂM HỌC 2022 – 2023
MÔN: HÓA HỌC 10 (CHÂN TRỜI SÁNG TẠO)
Phần I: Trắc nghiệm
|
1-C |
2-C |
3-B |
4-B |
5-C |
6-D |
7-B |
8-C |
9-D |
10-A |
|
11-B |
12-A |
13-A |
14-D |
15-C |
16-D |
17-C |
18-C |
19-D |
20-C |
|
21-B |
22-D |
23-A |
24-B |
25-D |
26-A |
27-C |
28-D |
|
|
Câu 1:
Đáp án đúng là: C
Hóa học nghiên cứu về thành phần, cấu trúc, tính chất và sự biến đổi của chất cũng như ứng dụng của chúng.
⇒ Sự chuyển hóa thức ăn trong hệ tiêu hóa thuộc đối tượng nghiên cứu của Hóa học.
Câu 2:
Đáp án đúng là: C
Hòa tan đường vào nước, thu được dung dịch nước đường là hiện tượng vật lí vì không có sự tạo thành chất mới.
Câu 3:
Đáp án đúng là: B
Bước đặt giả thuyết: “Tinh dầu tràm trà có khả năng kháng khuẩn” ứng với bước nêu giả thuyết khoa học trong phương pháp nghiên cứu hóa học.
Câu 4:
Đáp án đúng là: B
Phương pháp nghiên cứu thực nghiệm là nghiên cứu vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng …
Câu 5:
Đáp án đúng là: C
Hạt nhân nguyên tử gồm hai loại hạt là proton và neutron. Trong đó, proton mang điện tích dương còn neutron không mang điện.
Câu 6:
Đáp án đúng là: D
Phát biểu D không đúng, do nguyên tử hydrogen không có neutron trong hạt nhân.
Câu 7:
Đáp án đúng là: B
Số proton có trong hạt nhân nguyên tử X là:
(hạt)
Vậy X là K (potassium).
Câu 8:
Đáp án đúng là: C
Hạt mang điện tích dương trong nguyên tử là hạt proton.
Nguyên tử Al có số electron = số proton = 13 (hạt).
Câu 9:
Đáp án đúng là: D
Phát biểu A sai vì số đơn vị điện tích hạt nhân là Z.
Phát biểu B sai vì điện tích hạt nhân là +Z.
Phát biểu C sai vì số hạt neutron N = A – Z.
Phát biểu D đúng vì số hạt mang điện trong nguyên tử là P + E = 2Z.
Câu 10:
Đáp án đúng là: A
Nguyên tử trung hòa về điện vì có tổng số hạt proton bằng tổng số hạt electron hay số đơn vị điện tích dương của hạt nhân bằng số đơn vị điện tích âm của các electron trong nguyên tử.
Câu 11:
Đáp án đúng là: B
Hạt electron mang điện tích âm và có khối lượng.
Câu 12:
Đáp án đúng là: A
Nguyên tố hóa học là tập hợp các nguyên tử có cùng điện tích hạt nhân.
Câu 13:
Đáp án đúng là: A
Dựa vào kí hiệu nguyên tử Al ta có:
+ Số proton = số electron = số hiệu nguyên tử (Z) = 13.
+ Số neutron = số khối (A) – số hiệu nguyên tử (Z) = 27 – 13 = 14 (hạt).
Câu 14:
Đáp án đúng là: D
Các nguyên tử thuộc cùng một nguyên tố hoá học do có cùng số đơn vị điện tích hạt nhân là 8.
Câu 15:
Đáp án đúng là: C
Nguyên tử có số neutron là: 63 – 29 = 34.
Nguyên tử có số neutron là: 65 – 29 = 36.
Câu 16:
Đáp án đúng là: D
Câu 17:
Đáp án đúng là: C
- Orbital s có dạng hình cầu:
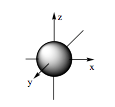
- Orbital p có dạng hình số tám nổi:
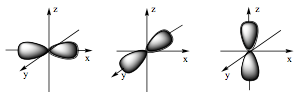
Câu 18:
Đáp án đúng là: C
Số electron tối đa trong lớp n là 2n2 (n ≤ 4).
Câu 19:
Đáp án đúng là: D
Lớp K gần hạt nhân nhất, liên kết chặt chẽ với hạt nhân nhất.
Câu 20:
Đáp án đúng là: C
N (Z = 7): 1s22s22p3 ⇒ N có 5 electron ở lớp ngoài cùng.
Na (Z = 11): [Ne]3s1 ⇒ Na có 1 electron ở lớp ngoài cùng.
Al (Z = 13): [Ne]3s23p1 ⇒ Al có 3 electron ở lớp ngoài cùng.
C (Z = 6): 1s22s22p2 ⇒ C có 4 electron ở lớp ngoài cùng.
Câu 21:
Đáp án đúng là: B
Trường hợp A và D sai do 2 electron trong cùng một AO phải có chiều tự quay ngược nhau.
Trường hợp C sai do trong cùng một phân lớp chưa bão hòa, các electron sẽ phân bố vào các orbital sao cho số electron độc thân là tối đa.
Câu 22:
Đáp án đúng là: D
Nguyên tắc sắp xếp các nguyên tố trong bảng tuần hoàn hiện nay:
+ Các nguyên tố được sắp xếp theo chiều tăng dần của điện tích hạt nhân nguyên tử.
+ Các nguyên tố có cùng số lớp electron trong nguyên tử được xếp vào cùng một chu kì.
+ Các nguyên tố mà nguyên tử có cấu hình electron tương tự nhau được xếp cùng một nhóm.
Câu 23:
Đáp án đúng là: A
X ở chu kì 3 nên có 3 lớp electron; X thuộc nhóm IVA nên có 4 electron ở lớp ngoài cùng.
Cấu hình electron nguyên tử X: 1s22s22p63s23p2.
Câu 24:
Đáp án đúng là: B
Hầu hết các chu kì trong bảng tuần hoàn các nguyên tố hóa học đều bắt đầu bằng kim loại kiềm (trừ chu kì 1).
Câu 25:
Đáp án đúng là: D
Bảng tuần hoàn hiện nay gồm có 18 cột, chia thành 8 nhóm A và 8 nhóm B (riêng nhóm VIIIB có 3 cột).
Câu 26:
Đáp án đúng là: A
Các nguyên tố thuộc cùng một nhóm A trong bảng tuần hoàn sẽ có cùng số electron hóa trị.
Câu 27:
Đáp án đúng là: C
X: 1s22s22p63s2 là kim loại do có 2 electron ở lớp ngoài cùng.
Y: 1s22s22p63s23p64s1 là kim loại do có 1 electron ở lớp ngoài cùng.
Z: 1s22s22p63s23p5 là phi kim do có 7 electron ở lớp ngoài cùng.
Câu 28:
Đáp án đúng là: D
X có tổng các electron trên phân lớp p là 9 nên cấu hình electron của X như sau:
1s22s22p63s23p3.
Vậy X thuộc nguyên tố p.
Phần II: Tự luận
Câu 1:
a) Hạt nhân của nguyên tử iron có điện tích bằng +26 và số khối bằng 56 ⇒ Nguyên tử iron có:
+ Số proton = số electron = 26.
+ Số neutron = 56 – 26 = 30.
b) Kí hiệu nguyên tử iron:
Câu 2:
+ Cấu hình electron nguyên tử aluminium (Al): 1s22s22p63s23p1
Cấu hình electron aluminium theo ô orbital:

Số electron độc thân của nguyên tử Al: 1 electron.
+ Cấu hình electron nguyên tử phosphorus (P):1s22s22p63s23p3
Cấu hình electron phosphorus theo ô orbital:

Số electron độc thân của nguyên tử P: 3 electron.
Câu 3:
a) Gọi số proton, neutron và electron có trong nguyên tử P lần lượt là: P, N và E.
(Trong đó: P = E)
Theo bài ra ta có hệ phương trình:
⇒ Số hiệu nguyên tử P (Z) = số proton = số electron = 15.
Cấu hình electron nguyên tử P: 1s22s22p63s23p3, vậy P ở:
+ Số thứ tự ô 15 (do Z = 15);
+ Chu kì 3 (do có 3 lớp electron);
+ Nhóm VA (do có 5 electron hóa trị, nguyên tố p).
b) Dựa vào cấu hình electron xác định được P là nguyên tố p, có tính phi kim (do cấu hình electron lớp ngoài cùng 3s23p3).
Đề thi giữa kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 4
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1 - Chân trời sáng tạo
Năm học ......................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 4)
Đề bài:
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Nội dung nào dưới đây là đối tượng nghiên cứu của hóa học?
A. Sự lớn lên và sinh sản của tế bào.
B. Tốc độ của ánh sáng trong chân không.
C. Ứng dụng của chất.
D. Sự hình thành hệ Mặt Trời.
Câu 2: Phương pháp nghiên cứu lí thuyết là
A. sử dụng những định luật, nguyên lí, quy tắc, cơ chế, mô hình … để tiếp tục làm rõ những vấn đề của lí thuyết hóa học.
B. nghiên cứu những vấn đề dựa trên kết quả thí nghiệm, khảo sát, thu thập số liệu, phân tích, định lượng…
C. giải quyết các vấn đề hóa học được ứng dụng trong các lĩnh vực khác nhau.
D. nghiên cứu thành phần, cấu trúc, tính chất và sự biến đổi của chất.
Câu 3: Trong các chất: magnesium, nitrogen, oxygen, sodium chloride. Hợp chất là
A. magnesium.
B. nitrogen.
C. oxygen.
D. sodium chloride.
Câu 4: Thứ tự các bước trong phương pháp nghiên cứu hóa học là
A. xác định vấn đề nghiên cứu; nêu giả thuyết khoa học; thực hiện nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề.
B. nêu giả thuyết khoa học; xác định vấn đề nghiên cứu; thực hiện nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề.
C. xác định vấn đề nghiên cứu; nêu giả thuyết khoa học; viết báo cáo: thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu.
D. nêu giả thuyết khoa học; xác định vấn đề nghiên cứu; viết báo cáo: thảo luận kết quả và kết luận vấn đề; thực hiện nghiên cứu.
Câu 5: Các hạt cấu tạo nên hạt nhân của hầu hết các nguyên tử là
A. electron và neutron.
B. proton và neutron.
C. neutron và electron.
D. electron, proton và neutron.
Câu 6: Phát biểu nào sai khi nói về neutron?
A. Tồn tại trong hạt nhân nguyên tử.
B. Có khối lượng bằng khối lượng proton.
C. Có khối lượng lớn hơn khối lượng electron.
D. Không mang điện.
Câu 7: Nguyên tử aluminium có 13 proton và 14 neutron. Số hạt mang điện có trong nguyên tử này là
A. 13. B. 14.
C. 27. D. 26.
Câu 8: Hạt electron có điện tích là
A. 1,602 × 10-19 C.
B. -1,602 × 10-19 C.
C. +1,602 × 10-19 C.
D. -1,602 × 1019 C.
Câu 9: Nguyên tử carbon có điện tích hạt nhân là +6. Số electron của nguyên tử này là
A. 6. B. 12.
C. 18. D. 24.
Câu 10: Nếu xem nguyên tử như một quả cầu, có bán kính khoảng 10-10 m thì bán kính hạt nhân nguyên tử vào khoảng
A. 10-8 m.
B. 10-14 m.
C. 10-12 m.
D. 104 m.
Câu 11: Đơn vị khối lượng nguyên tử kí hiệu là
A. meV.
B. amu.
C. nanometre.
D. angstrom.
Câu 12: Số đơn vị điện tích hạt nhân nguyên tử (kí hiệu là Z) của một nguyên tố gọi là
A. số khối.
B. nguyên tử khối.
C. số hiệu nguyên tử.
D. số neutron.
Câu 13: Số hạt electron của nguyên tử có kí kiệu là
A. 31. B. 16. C. 15. D. 30.
Câu 14: Cho các nguyên tử sau: . Những nguyên tử là đồng vị của cùng một nguyên tố hóa học là
A. A và B.
B. B và C.
C. C và D.
D. A và D.
Câu 15: Từ hai đồng vị hydrogen ( và ) và đồng vị , có thể tạo thành được số loại phân tử H2O là
A. 1. B. 2. C. 3. D. 4.
Câu 16: Nguyên tử carbon có hai đồng vị bền: chiếm 98,89% và chiếm 1,11%. Nguyên tử khối trung bình của carbon là
A. 12,50.
B. 12,02.
C. 12,01.
D. 12,06.
Câu 17: Orbital s có dạng
A. hình tròn.
B. hình số 8 nổi.
C. hình cầu.
D. hình bầu dục.
Câu 18: Lớp M có số electron tối đa bằng
A. 3. B. 4. C. 9. D. 18.
Câu 19: Sự phân bố electron theo ô orbital nào dưới đây là đúng?
A. ![]()
B. ![]()
C. ![]()
D. ![]()
Câu 20: Cấu hình electron của nguyên tử Cl (Z = 17) là
A. 1s22s22p63s23p6.
B. 1s22s22p63s23p5.
C. 1s22s22p63s23p3.
D. 1s22s22p63s23p4.
Câu 21: Nguyên tố X có số hiệu nguyên tử bằng 14. Electron cuối cùng của nguyên tử nguyên tố X điền vào lớp, phân lớp nào sau đây?
A. K, s.
B. L, p.
C. M, p.
D. N, d.
Câu 22: Phân lớp chứa đủ số electron tối đa được gọi là
A. phân lớp bão hòa.
B. phân lớp bán bão hòa.
C. phân lớp nửa bão hòa.
D. phân lớp chưa bão hòa.
Câu 23: Ô nguyên tố trong bảng tuần hoàn không cho biết thông tin nào sau đây?
A. Kí hiệu nguyên tố.
B. Tên nguyên tố.
C. Số hiệu nguyên tử.
D. Số khối của hạt nhân.
Câu 24: Chu kì 4 của bảng tuần hoàn có số nguyên tố là
A. 2 nguyên tố.
B. 18 nguyên tố.
C. 32 nguyên tố.
D. 8 nguyên tố.
Câu 25: Nguyên tử X có cấu hình electron [Ne]3s23p1. Vị trí của X trong bảng hệ thống tuần hoàn là
A. số thứ tự 3, chu kì 3, nhóm IIIA.
B. số thứ tự 11, chu kì 3, nhóm IIIA.
C. số thứ tự 13, chu kì 2, nhóm IA.
D. số thứ tự 13, chu kì 3, nhóm IIIA.
Câu 26: Ở trạng thái cơ bản, cấu hình electron lớp ngoài cùng của nguyên tử nguyên tố X là 3s2. Số thứ tự nguyên tố X trong bảng tuần hoàn là
A. 12. B. 13.
C. 11. D. 14.
Câu 27: Cho cấu hình electron các nguyên tố sau đây: Na: [Ne]3s1; Cr: [Ar]3d54s1; Br: [Ar]3d104s24p5; F: 1s22s22p5; Cu: [Ar]3d104s1. Số nguyên tố thuộc khối s trong các nguyên tố trên là
A. 0. B. 1.
C. 2. D. 3.
Câu 28: Bảng tuần hoàn hiện nay có số cột, số nhóm A và số nhóm B lần lượt là
A. 18, 8, 8.
B. 18, 8, 10.
C. 18, 10, 8.
D. 16, 8, 8.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Nguyên tử X có tổng số các loại hạt bằng 52, trong đó số hạt mang điện nhiều hơn số hạt không mang điện là 16 hạt.
a) Xác định thành phần các hạt cấu tạo nên nguyên tử X.
b) Viết kí hiệu nguyên tử X.
Câu 2 (1 điểm): Nguyên tử của nguyên tố A có electron ở mức năng lượng cao nhất là 3p. Nguyên tử của nguyên tố B có một electron ở lớp ngoài cùng 4s. Nguyên tử A và B có số electron hơn kém nhau là 3.
a) Viết cấu hình electron nguyên tử A, B.
b) Biểu diễn cấu hình electron A, B theo ô orbital và cho biết số electron độc thân có trong mỗi nguyên tử này.
Câu 3 (1 điểm): Hai nguyên tố X và Y đứng kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn, có tổng số điện tích hạt nhân bằng 25. Biết ZX < ZY, hãy xác định vị trí của X, Y trong bảng tuần hoàn (có giải thích ngắn gọn cách xác định).
Đề thi giữa kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 5
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1 - Chân trời sáng tạo
Năm học ......................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 5)
Phần I: Trắc nghiệm (7 điểm)
Câu 1: Phương pháp nghiên cứu nhằm mục đích giải quyết các vấn đề hóa học được ứng dụng trong các lĩnh vực khác nhau được gọi là
A. phương pháp nghiên cứu lí thuyết.
B. phương pháp nghiên cứu thực nghiệm.
C. phương pháp nghiên cứu ứng dụng.
D. phương pháp nghiên cứu lí luận.
Câu 2: Để nghiên cứu thành phần hóa học và bước đầu ứng dụng tinh dầu tràm trà trong sản xuất nước súc miệng, các nhà nghiên cứu đã thực hiện thí nghiệm chiết xuất tinh dầu bằng phương pháp lôi cuốn hơi nước. Thí nghiệm này thuộc bước nào trong các bước nghiên cứu hóa học?
A. Xác định vấn đề nghiên cứu.
B. Nêu giả thuyết khoa học.
C. Thực hiện nghiên cứu (lí thuyết, thực nghiệm, ứng dụng).
D. Viết báo cáo: thảo luận kết quả và kết luận vấn đề.
Câu 3: Nội dung nào dưới đây thuộc đối tượng nghiên cứu của hóa học?
A. Công thức chuyển động ném ngang.
B. Giải pháp giảm thiểu tác hại của mưa acid.
C. Quá trình phân chia tế bào.
D. Quá trình hô hấp ở thực vật.
Câu 4: Nguyên tử chứa những hạt mang điện là
A. proton, electron và neutron.
B. proton và neutron.
C. proton và electron.
D. electron và neutron.
Câu 5: Nhận định nào sau đây là không đúng với hạt electron?
A. Hạt electron được kí hiệu là e.
B. Điện tích: qe = -1,602.10-19 coulomb.
C. Khối lượng: me = 9,11.10-28 gam.
D. Điện tích của electron được quy ước là 1.
Câu 6: Thành phần nào không bị lệch hướng trong trường điện?
A. Tia âm cực.
B. Tia a.
C. Nguyên tử lithium.
B. Proton.
Câu 7: Cho các phát biểu sau:
(1) Trong nguyên tử, hạt không mang điện là hạt electron.
(2) Tất cả các nguyên tử đều trung hòa về điện.
(3) Trong nguyên tử, hạt mang điện là neutron và electron.
(4) Khối lượng của hạt proton gấp hạt electron khoảng 1818 lần.
Số phát biểu sai là
A. 1. B. 2. C. 3. D. 4.
Câu 8: Một nguyên tử oxygen có 8 electron; 8 proton và 8 neutron. Số hạt mang điện có trong nguyên tử oxygen là
A. 8. B. 16. C. 24. D. 32.
Câu 9: Mộ nguyên tử phosphorus có 15 proton, 15 electron và 16 neutron. Điện tích hạt nhân nguyên tử này là
A. +15. B. +16. C. +31. D. +30.
Câu 10: Nếu hình dung hạt nhân nguyên tử là khối cầu có đường kính 10 cm thì nguyên tử sẽ là khối cầu có đường kính khoảng
A. 1 m.
B. 1 cm.
C. 1 mm.
D. 1 km.
Câu 11: Một nguyên tử nitrogen có 7 proton, 7 electron và 8 neutron. Khối lượng nguyên tử này (theo đơn vị amu) là
A. 14,00.
B. 15,00.
C. 25,00.
D. 16,00.
Câu 12: Nguyên tố hóa học là tập hợp những nguyên tử có cùng
A. số khối.
B. số neutron.
C. số proton.
D. số neutron và số proton.
Câu 13: Kí hiệu nguyên tử nào sau đây được viết đúng?
A. .
B. .
C. .
D. .
Câu 14: Có 3 nguyên tử: . Những nguyên tử nào là đồng vị của một nguyên tố?
A. X, Y.
B. Y, Z.
C. X, Z.
D. X, Y, Z.
Câu 15: Số neutron trong nguyên tử là
A. 3. B. 7. C. 11. D. 4.
Câu 16: Trong tự nhiên, đồng (hay copper) có hai đồng vị bền là 63Cu và 65Cu. Nguyên tử khối trung bình của đồng là 63,55. Phần trăm số nguyên tử của mỗi đồng vị 63Cu và 65Cu lần lượt là
A. 72,5% và 27,5%.
B. 27,5% và 72,5%
C. 25,0% và 75,0%.
D. 75,0% và 25,0%.
Câu 17: Orbital nguyên tử là
A. khu vực không gian xung quanh nguyên tử mà tại đó xác suất có mặt electron khoảng 90%.
B. đám mây chứa electron có dạng hình số tám nổi.
C. khu vực không gian xung quanh hạt nhân mà tại đó xác suất có mặt electron khoảng 90%.
D. quỹ đạo chuyển động của electron quay quanh hạt nhân có kích thước năng lượng xác định.
Câu 18: Phân lớp 4p có số electron tối đa là
A. 6. B. 18. C. 14. D. 10.
Câu 19: Sự phân bố electron trên các phân lớp thuộc các lớp electron dựa vào nguyên lí hay quy tắc nào sau đây?
A. Nguyên lí vững bền và nguyên lí Pauli.
B. Nguyên lí vững bền và quy tắc Hund.
C. Nguyên lí Pauli và quy tắc Hund.
D. Nguyên lí vững bền và quy tắc Pauli.
Câu 20: Nguyên tử của nguyên tố sodium (Z = 11) có cấu hình electron là
A. 1s22s22p63s2.
B. 1s22s22p6.
C. 1s22s22p63s1.
D. 1s22s22p53s2.
Câu 21: Nguyên tử của nguyên tố potassium có 19 electron. Ở trạng thái cơ bản, potassium có số electron độc thân là
A. 8. B. 9. C. 11. D. 10.
Câu 22: Trong bảng hệ thống tuần hoàn, chu kì là dãy các nguyên tố mà
A. nguyên tử của chúng có cùng số electron lớp vỏ ngoài cùng.
B. cấu hình electron giống hệt nhau.
C. nguyên tử của chúng có cùng số lớp electron.
D. cấu hình electron lớp vỏ giống hệt nhau.
Câu 23: Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn là
A. 3 và 3.
B. 4 và 3.
C. 3 và 4.
D. 4 và 4.
Câu 24: Nguyên tố có số hiệu nguyên tử 19 thuộc chu kì nào trong bảng tuần hoàn?
A. chu kì 2.
B. chu kì 3.
C. chu kì 4.
D. chu kì 5.
Câu 25: Nguyên tố X thuộc chu kì 3, nhóm VIA. Cấu hình electron của nguyên tử X là
A. 1s22s22p4.
B. 1s22s22p63s23p4.
C. 1s22s22p63s23p1.
D. 1s22s22p63s23p3.
Câu 26: Các nguyên tố nhóm B trong bảng tuần hoàn là
A. các nguyên tố s và các nguyên tố p.
B. các nguyên tố p và các nguyên tố d.
C. các nguyên tố d và các nguyên tố f.
D. các nguyên tố s và các nguyên tố f.
Câu 27: Nguyên tử nguyên tố X có tổng các electron trên phân lớp p là 7. Vậy X thuộc loại nguyên tố nào sau đây?
A. s. B. d. C. f. D. p.
Câu 28: Cho biết số hiệu nguyên tử của các nguyên tố X và Y lần lượt là ZX = 12, ZY = 16. Phát biểu nào sau đây là đúng?
A. X và Y đều là nguyên tố kim loại.
B. X và Y đều là nguyên tố phi kim.
C. X là nguyên tố kim loại, Y là nguyên tố phi kim.
D. X là nguyên tố phi kim, Y là nguyên tố kim loại.
Phần II: Tự luận (3 điểm)
Câu 1 (1 điểm): Nguyên tử của nguyên tố R có tổng số hạt proton, neutron và electron là 116, trong đó tổng số hạt mang điện nhiều hơn số hạt không mang điện là 24.
a) Xác định thành phần các hạt cấu tạo nên nguyên tử R.
b) Viết kí hiệu nguyên tử của nguyên tố R.
Câu 2 (2 điểm): Cho các nguyên tử nguyên tố sau: F (Z = 9); Ar (Z = 18).
a) Viết cấu hình electron của F; Ar và dự đoán tính chất hóa học của chúng.
b) Biểu diễn cấu hình electron của F, Ar theo ô orbital. Xác định số electron độc thân của mỗi nguyên tử này.
Câu 3 (3 điểm): X, Y là 2 nguyên tố kế tiếp nhau trong cùng một chu kì của bảng tuần hoàn các nguyên tố hoá học. Tổng số hiệu nguyên tử của X, Y là 29. Biết ZX < ZY, xác định vị trí của X, Y trong bảng tuần hoàn các nguyên tố hóa học (có giải thích ngắn gọn cách xác định).
Đề thi giữa kì 1 Hóa học lớp 10 Chân trời sáng tạo có đáp án - Đề 6
Phòng Giáo dục và Đào tạo .....
Đề thi Giữa Học kì 1 - Chân trời sáng tạo
Năm học ......................
Môn: Hóa học 10
Thời gian làm bài: 45 phút
(Đề số 6)
I. TRẮC NGHIỆM
Câu 1: Nguyên tố X được sử dụng rộng rãi để chống đóng băng và khử băng như một chất bảo quản. Nguyên tố Y là nguyên tố thiết yếu cho các cơ thể sống, đồng thời nó được sử dụng nhiều trong việc sản xuất phân bón. Nguyên tử của nguyên tố X có electron ở mức năng lượng cao nhất là 3p. Nguyên tử nguyên tố Y có một electron ở lớp ngoài cùng là 4s. Nguyên tử X và Y có số electron hơn kém nhau là 3. Nguyên tử X và Y lần lượt là
A. khí hiếm và kim loại.
B. kim loại và khí hiếm.
C. kim loại và kim loại.
D. phi kim và kim loại.
Câu 2: Cấu hình electron ở trạng thái cơ bản của nguyên tử nguyên tố X có tổng số electron trong các phân lớp p là 8. Nguyên tố X là
A. Si (Z=14).
B. O (Z=8).
C. Al (Z=13).
D. Cl (Z=17).
Câu 3: Phát biểu nào đúng khi nói về các orbital trong một phân lớp electron?
A. Có sự định hướng không gian.
B. Có cùng mức năng lượng.
C. Khác nhau về mức năng lượng.
D. Có hình dạng không phụ thuộc vào đặc điểm mỗi phân lớp.
Câu 4: Mỗi orbital nguyên tử chứa tối đa
A. 1 electron.
B. 2 electron.
C. 3 electron.
D. 4 electron.
Câu 5: Cho các phát biểu sau:
(1) Tất cả các hạt nhân nguyên tử đều chứa proton và neutron.
(2) Khối lượng nguyên tử tập trung phần lớn ở lớp vỏ.
(3) Trong nguyên tử, số electron bằng số proton.
(4) Trong hạt nhân nguyên tử, hạt mang điện là proton và electron.
(5) Trong nguyên tử, hạt electron có khối lượng không đáng kể so với các hạt còn lại.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Câu 6: Các nguyên tố từ Li đến F, theo chiều tăng của điện tích hạt nhân thì
A. bán kính nguyên tử tăng, độ âm điện giảm.
B. bán kính nguyên tử và độ âm điện đều tăng.
C. bán kính nguyên tử giảm, độ âm điện tăng.
D. bán kính nguyên tử và độ âm điện đều giảm.
Câu 7: Sắp xếp các hyđroxide NaOH, Al(OH)3, Mg(OH)2 theo chiều tăng dần tính base
A. NaOH, Mg(OH)2, Al(OH)3.
B. Mg(OH)2, Al(OH)3, NaOH.
C. Al(OH)3, Mg(OH)2, NaOH.
D. NaOH, Al(OH)3, Mg(OH)2.
Câu 8: Nguyên tố ở chu kì 5, nhóm VIIA có cấu hình electron hoá trị là.
A. 4s24p5
B. 5s25p5
C. 4d45s2
D. 7s27p3.
Câu 9: Nguyên tử A có 12 electron, 12 neutron, kí hiệu nguyên tử của A là
A. .
B. .
C. .
D. .
Câu 10: Cấu hình electron của Cu (Z = 29) là
A. 1s2 2s2 2p6 3s2 3p6 3d10 4s1.
B. 1s2 2s2 2p6 3s2 3p6 3d9 4s2.
C. 1s2 2s2 2p6 3s2 3p6 4s2 3d9.
D. 1s2 2s2 2p6 3s2 3p6 4s2 3d10.
II. TỰ LUẬN
Câu 1: Trong tự nhiên, hợp chất X tồn tại ở dạng quặng có công thức ABY2. X được khai thác và sử dụng nhiều trong luyện kim hoặc sản xuất acid. Trong phân tử X, nguyên tử của hai nguyên tố A và B đều có phân lớp ngoài cùng là 4s, các ion A2+ và B2+ có số electron lớp ngoài cùng lần lượt là 17 và 14. Tổng số hạt proton trong X là 87.
(a) Viết cấu hình electron nguyên tử của A và B.
(b) Xác định X.
Câu 2: Nguyên tố R thuộc nhóm A và có 3electron ở lớp ngoài cùng , trong công thức oxide cao nhất của nó có oxygen chiếm 47,06% về mặt khối lượng.
a) Xác định kim loại R
b) Hòa tan oxit của kim loại R trên bằng 58,8g dung dịch acid H2SO4 5% vừa đủ thu được dung dịch B.Tính khối lượng muối tạo thành và nồng độ phần trăm của dung dịch B thu được sau phản ứng?
Đáp án
Phần trắc nghiệm
|
1D |
2A |
3B |
4B |
5B |
6C |
7A |
8B |
9D |
10A |
II. TỰ LUẬN
Câu 1:
Lời giải chi tiết
a) Cấu hình electron của A và B có dạng:
[Ne]3s23p63dx4sy (0 ≤ x ≤ 10; 1 ≤ y ≤ 2)
- Nếu y = 1 thì cấu hình của A2+ là: [Ne]3s23p63dx-1
Khi đó có: 2 + 6 + x – 1 = 17 ⇒ x = 10
Cấu hình electron của A là: [Ar]3d104s1
⇒ A là 29Cu
- Nếu y = 2 thì cấu hình của A2+ là: [Ne]3s23p63dx
Khi đó có: 2 + 6 + x = 17 ⇒ x = 9
Cấu hình electron của A là: [Ar]3d94s2 (không bền vững)
Xét tương tự với B:
- Nếu y = 1 thì cấu hình electron của B là [Ar]3d74s1 (không hợp lí)
- Nếu y = 2 thì cấu hình electron của B là [Ar]3d64s1 . B là 26Fe
b) Tổng số proton trong X là 87.
⇒ pA + pB + 2pY = 87
⇔ 29 + 26 + 2.pY = 87
⇔ pY = 16
⇒ Y là 16S
Vậy quặng X có công thức là: CuFeS2
Câu 2:
Lời giải chi tiết
a)Oxide cao nhất của R là R2O3 => => MR = 27 => R là aluminium (Al)
b) => =>= 0,03 mol.
Oxide cao nhất của Al là Al2O3
Al2O3 + H2SO4Al2(SO4)3 + 3H2O
0,03 ← 0,03 → 0,03 (mol)
mdd spu = += 0,03.102 +58,8 = 61,86 g
= 0,03.342 = 10,26 gam
= =16,59%