Với tóm tắt lý thuyết Hóa học lớp 10 Bài 11: Liên kết cộng hóa trị sách Cánh diều hay, chi tiết cùng với bài tập trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học 10.
Lý thuyết Hóa học lớp 10 Bài 11: Liên kết cộng hóa trị
A. Lý thuyết Liên kết cộng hóa trị
I. Liên kết cộng hóa trị
- Quy tắc octet có thể đạt được bằng cách góp chung electron.
- Electron dùng chung là electron được coi như thuộc về đồng thời hai nguyên tử tham gia liên kết.
- Liên kết cộng hóa trị là liên kết được hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử.
- Liên kết cộng hóa trị thường gặp giữa phi kim với phi kim.
Ví dụ 1: Nguyên từ hydrogen (H) có cấu hình electron là 1s1, chlorine (Cl) có cấu hình electron là [Ne]3s23p5. Để đạt được cấu hình của khí hiếm gần nhất, mỗi nguyên tử này đều cần thêm 1 electron. Vì vậy, mỗi nguyên tử H và Cl cùng góp 1 electron để tạo nên 1 cặp electron dùng chung cho cả hai nguyên tử.
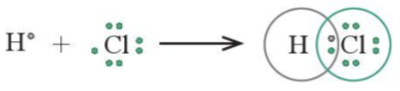 Hình 11.1. Sơ đồ mô tả sự hình thành cặp electron dùng chung của HCl
Hình 11.1. Sơ đồ mô tả sự hình thành cặp electron dùng chung của HCl
+ Như vậy, liên kết giữa nguyên tử H và Cl được tạo nên bởi 1 cặp electron dùng chung. Công thức ![]() được gọi là công thức electron của HCl.
được gọi là công thức electron của HCl.
+ Nếu giữa hai nguyên tử chỉ có một cặp electron dùng chung thì cặp electron này được biểu diễn bằng một nối đơn (-) và được gọi là liên kết đơn. Khi đó HCl được biểu diễn như sau:
![]()
+ Công thức trên được gọi là công thức Lewis của HCl.
+ Hợp chất HCl được tạo nên bởi liên kết cộng hóa trị nên thuộc loại hợp chất cộng hóa trị.
- Kết luận: Công thức Lewis biểu diễn cấu tạo phân tử qua các liên kết (cặp electron dùng chung) và các electron hóa trị riêng.
- Chú ý:
+ Nếu giữa hai nguyên tử có hai cặp electron dùng chung thì hai cặp electron này được biểu diễn bằng một nối đôi (=) và gọi là liên kết đôi.
+ Nếu giữa hai nguyên tử có ba cặp electron dùng chung thì ba cặp electron này được biểu diễn bằng một nối ba (≡) và gọi là liên kết ba.
Ví dụ 2: Phân tử ammonia kết hợp với ion H+ tạo ra cation ammonium ()
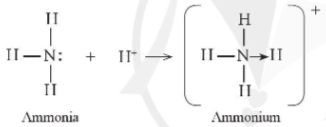
Hình 11.4. Sơ đồ mô tả sự hình thành liên kết cho – nhận trong cation ammonium
+ Trên nguyên tử N còn một cặp electron hóa trị riêng, khi hình thành ion , cặp electron này trở thành cặp electron dùng chung cho cả N và H, cả N và các nguyên tử H đều thỏa mãn quy tắc octet.
+ Như vậy, liên kết đơn giữa nguyên tử N trong NH3 với H+ được tạo thành bởi một cặp electron góp chung của nguyên tử N.
+ Để chỉ rõ sự khác biệt về nguồn gốc cặp electron dùng chung, liên kết tạo bởi cặp electron của N và ion H+ được kí hiệu là mũi tên (®) xuất phát từ N. Loại liên kết này được gọi là liên kết cho – nhận.
- Kết luận: Liên kết cho – nhận là liên kết cộng hóa trị mà cặp electron dùng chung được đóng góp từ một nguyên tử.
II. Phân loại liên kết theo độ âm điện
- Dựa vào độ âm điện (Δχ, đọc là đen – ta khi) giữa hai nguyên tử A và B , có thể dự đoán được loại liên kết giữa hai nguyên tử đó.
Δχ = χ(B) – χ(A), trong đó χ(B) > χ(A)
- Phân loại liên kết theo độ âm điện
+ 0 £ Δχ < 0,4: Liên kết cộng hóa trị không cực
A : B
+ 0,4 £ Δχ < 1,7: Liên kết cộng hóa trị có cực
:
+ Δχ > 1,7: Liên kết ion
:
Lưu ý:
- Một số trường hợp ngoại lệ không tuân theo cách phân loại theo độ âm điện như: hợp chất cộng hóa trị HF, hợp chất ion MnI2, ...
- Trong liên kết giữa nguyên tử A và B, nếu độ âm điện của nguyên tử A nhỏ hơn độ âm điện của nguyên tử B thì cặp electron dùng chung sẽ bị lệch về phía nguyên tử B. Nguyên tử B lúc này mang một phần điện tích âm (), nguyên tử A mang một phần điện tích dương (). Liên kết này gọi là liên kết cộng hóa trị có cực.
III. Liên kết sigma (s) và liên lết pi (p)
- Liên kết cộng hóa trị được hình thành từ cặp electron dùng chung. Để tạo nên một cặp electron dùng chung, hai AO chứa electron độc thân (hoặc giữa một AO trống và 1 AO bão hòa electron) cần xen phủ với nhau.
- Có hai kiểu xen phủ AO là xen phủ trục và xen phủ bên.
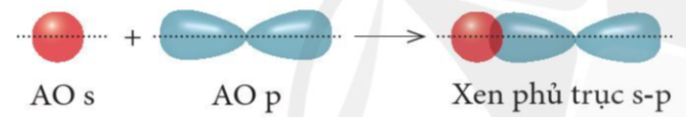
- Xen phủ trục: là xen phủ giữa hai AO dọc theo trục nối (trục z) hai nguyên tử. Có ba khả năng xen phủ trục.
+ Xen phủ giữa AO s với AO s

+ Xen phủ giữa AO s với AO p
+ Xen phủ giữa AO p với AO p
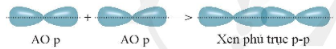
Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma (s).
- Xen phủ bên: là sự xen phủ xảy ra giữa hai AO p song song với nhau.
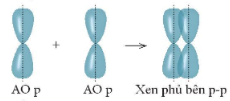
Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (p).
- Kết luận: Liên kết đơn còn gọi là liên kết s, liên kết đôi gồm một liên kết s và một liên kết p, liên kết ba gồm một liên kết s và hai liên kết p.
Lưu ý:
- Khi các nguyên tử liên kết với nhau, các AO phải được sắp xếp ở vị trí phù hợp. Chẳng hạn khi hình thành phân tử hai nguyên tử, vị trí của các AO như sau:
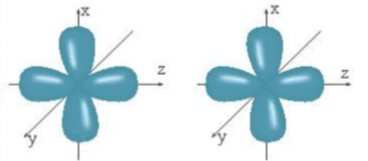
+ Hai AO pz nằm dọc trên cùng một trục nên chỉ có thể xen phủ trục với nhau.
+ Hai AO px (cũng như hai AO py) là song song với nhau nên chỉ có thể xen phủ bên với nhau.
- Liên kết s bền vững hơn liên kết p bởi vùng xen phủ AO chứa electron chung chắn giữa hai hạt nhân, làm giảm lực đẩy giữa chúng. Để phân tử bền vững thì trong phân tử phải luôn có liên kết s.
IV. Năng lượng của liên kết cộng hóa trị
- Khi các nguyên tử liên kết với nhau sẽ tạo thành một hệ bền vững hơn, quá trình này giải phóng năng lượng. Do vậy, để phá vỡ liên kết giữa các nguyên tử thì phải cung cấp năng lượng.
Ví dụ: Để phá vỡ liên kết H – H trong 1 mol khí H2 ở 25oC và 1 bar cần năng lượng là 436 kJ.
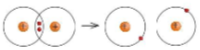
Hình 11.5. Sơ đồ sự phá vỡ liên kết H – H
- Năng lượng liên kết (Eb) là năng lượng cần thiết để phá vỡ một liên kết xác định trong phân tử ở thể khí, tại 25oC và 1 bar.
- Đơn vị của năng lượng liên kết thường là kJ mol-1.
- Năng lượng liên kết càng lớn, liên kết đó càng bền.
Ví dụ: Năng lượng liên kết H – H 436 kJ mol-1, của F – F là 159 kJ mol-1. Như vậy liên kết H – H bền hơn liên kết F – F.
B. Trắc nghiệm Liên kết cộng hóa trị
Câu 1. Liên kết cộng hóa trị là liên kết hình thành bởi
A. lực hút tĩnh điện giữa các ion mang điện tích trái dấu
B. một cặp electron dùng chung giữa hai nguyên tử
C. một hay nhiều cặp electron dùng chung giữa hai nguyên tử
D. các electron hóa trị riêng
Đáp án: C
Giải thích:
Liên kết cộng hóa trị là liên kết hình thành bởi một hay nhiều cặp electron dùng chung giữa hai nguyên tử.
Câu 2. Cho các phát biểu sau
(1) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị không cực.
(2) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực.
(3) Cặp electron dùng chung luôn được tạo nên tử 2 electron của cùng một nguyên tử.
(4) Cặp electron dùng chung được tạo nên tử 2 electron hóa trị.
Phát biểu đúng là
A. (1) và (3)
B. (1) và (4)
C. (2) và (3)
D. (2) và (4)
Đáp án: D
Giải thích:
(1) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị không cực. ⇒ Sai.
(2) Nếu cặp electron dùng chung bị lệch về phía một nguyên tử thì đó là liên kết cộng hóa trị có cực. ⇒ Đúng.
(3) Cặp electron dùng chung luôn được tạo nên tử 2 electron của cùng một nguyên tử. ⇒ Sai.
Cặp electron dùng chung thường được tạo nên từ 2 electron của của hai nguyên tử. Ngoại trừ trường hợp liên kết cho nhận thì cặp electron dùng chung được đóng góp từ 1 nguyên tử.
(4) Cặp electron dùng chung được tạo nên tử 2 electron hóa trị. ⇒ Đúng.
Câu 3. Cho các phát biểu sau
(1) Liên kết đôi được tạo nên từ 2 liên kết σ.
(2) Liên kết ba được tạo nên từ 2 liên kết σ và 1 liên kết π.
(3) Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
(4) Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Phát biểu đúng là
A. (1) và (2)
B. (1) và (4)
C. (3) và (2)
D. (3) và (4)
Đáp án: D
Giải thích:
Phát biểu đúng là
(3) Liên kết đôi được tạo nên từ 1 liên kết σ và 1 liên kết π.
(4) Liên kết ba được tạo nên từ 1 liên kết σ và 2 liên kết π.
Câu 4. Cho công thức electron của phân tử HF dưới đây. Số electron dùng chung, số electron hóa trị riêng của F lần lượt là
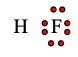
A. 2 electron dùng chung, 6 electron hóa trị riêng
B. 6 electron dùng chung, 2 electron hóa trị riêng
C. 1 electron dùng chung, 3 electron hóa trị riêng
D. 3 electron dùng chung, 1 electron hóa trị riêng
Đáp án: A
Giải thích:
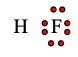
Giữa 2 nguyên tử có 2 dấu chấm ⇒ có 2 electron dùng chung.
Các phía còn lại của F có tổng cộng 6 chấm ⇒ có 6 electron hóa trị riêng.
Câu 5. Cho công thức Lewis của phân tử NH3 dưới đây. Số electron dùng chung, số electron hóa trị riêng của N lần lượt là
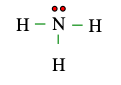
A. 2 electron dùng chung, 3 electron hóa trị riêng
B. 3 electron dùng chung, 2 electron hóa trị riêng
C. 6 electron dùng chung, 2 electron hóa trị riêng
D. 2 electron dùng chung, 6 electron hóa trị riêng
Đáp án: C
Giải thích:
Xung quanh nguyên tử N có tổng cộng 3 nối đơn (−) mà mỗi nối đơn biểu diễn 1 cặp electron dùng chung. ⇒ có 6 electron dùng chung.
Phía còn lại của nguyên tử N có 2 dấu chấm ⇒ có 2 electron hóa trị riêng.
Câu 6. Công thức biểu diễn cấu tạo nguyên tử qua các liên kết và các electron hóa trị riêng là
A. công thức phân tử
B. công thức electron
C. công thức Lewis
D. công thức đơn giản nhất
Đáp án: C
Giải thích: Công thức biểu diễn cấu tạo nguyên tử qua các liên kết (cặp electron dùng chung) và các electron hóa trị riêng là công thức Lewis.
Câu 7. Liên kết giữa O với C trong phân tử CO2 có số cặp electron chung là
A. 1
B. 2
C. 3
D. 4
Đáp án: B
Giải thích:
O (Z = 8): [He]2s22p4 ⇒ có 6 electron lớp ngoài cùng ⇒ xu hướng nhận 2 electron để đạt cấu hình electron bền vững ⇒ góp 2 electron.
C (Z = 6): [He]2s22p2 ⇒ có 4 electron lớp ngoài cùng ⇒ xu hướng nhận 4 electron để đạt cấu hình electron bền vững ⇒ góp 4 electron.
Công thức electron của phân tử CO2:
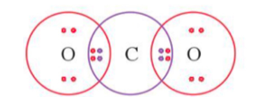
Vậy giữa 2 nguyên tử O và C có 2 cặp electron dùng chung.
Câu 8. Hợp chất nào dưới đây là hợp chất cộng hóa trị?
A. NaCl
B. K2O
C. CaO
D. H2O
Đáp án: D
Giải thích:
Hợp chất cộng hóa trị là hợp chất được tạo nên bởi liên kết cộng hóa trị.
Liên kết cộng hóa trị thường hình thành giữa phi kim và phi kim.
H và O đều là phi kim ⇒ Liên kết giữa H và O là liên kết cộng hóa trị.
⇒ Phân tử H2O thuộc loại hợp chất cộng hóa trị.
Câu 9. Liên kết trong phân tử nào dưới đây là liên kết ba?
A. NH3
B. CO2
C. O2
D. N2
Đáp án: D
Giải thích:
N (Z = 7): [He]2s22p3 ⇒ có 5 electron lớp ngoài cùng ⇒ xu hướng nhận 3 electron để đạt cấu hình electron bền vững ⇒ góp 3 electron.
Công thức electron của phân tử N2 là
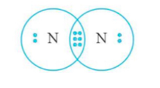
Công thức Lewis là
Vậy liên kết trong phân tử N2 là liên kết ba.
Câu 10. Dựa vào giá trị độ âm điện, liên kết giữa nguyên tử H và Cl thuộc loại
A. liên kết ion
B. liên kết cộng hóa trị có cực
C. liên kết cộng hóa trị không cực
D. liên kết đơn
Đáp án: B
Giải thích:
Có χ(H) = 2,2 và χ(Cl) = 3,16
Nên
Mà 0,4 ≤ 0,96 < 1,7 ⇒ liên kết giữa nguyên tử H và Cl thuộc loại liên kết cộng hóa trị có cực.
Câu 11. Dựa vào độ âm điện, liên kết trong phân tử nào dưới đây là liên kết cộng hóa trị không cực?
A. NaCl
B. CH4
C. H2O
D. HCl
Đáp án: B
Giải thích:
⇒ Liên kết trong phân tử NaCl là liên kết ion.
⇒ Liên kết trong phân tử CH4 là liên kết cộng hóa trị không cực.
mà 0,4 ≤ 1,24 < 1,7 ⇒ Liên kết trong phân tử H2O là liên kết cộng hóa trị có cực.
mà 0,4 ≤ 0,96 < 1,7 ⇒ Liên kết trong phân tử HCl là liên kết cộng hóa trị có cực.
Câu 12. Các AO xen phủ tạo liên kết đơn trong phân tử Cl2 là
A. 2 AO s xen phủ trục tạo liên kết đơn
B. 1 AO s và 1 AO p xen phủ trục tạo liên kết đơn
C. 2 AO p xen phủ trục tạo liên kết đơn
D. 2 AO ps xen phủ bên tạo liên kết đơn
Đáp án: C
Giải thích:
Cl (Z = 17): [Ne]3s23p5
Ô orbital của lớp electron ngoài cùng:
|
↑↓ |
|
↑↓ |
↑↓ |
↑ |
3s2 3p5
Có 1 AO p chứa electron độc thân.
Do đó liên kết đơn giữa 2 nguyên tử Cl trong phân tử Cl2 được tạo nên từ sự xen phủ trục của 2 AO p.
Câu 13. Khẳng định sai là
A. Liên kết được tạo nên từ xen phủ trục của hai AO gọi là liên kết sigma (σ)
B. Liên kết được tạo nên từ xen phủ bên của hai AO gọi là liên kết pi (π)
C. Liên kết đơn còn gọi là liên kết π
D. Liên kết đôi gồm một liên kết σ và một liên kết π, liên kết ba gồm một liên kết σ và hai liên kết π
Đáp án: C
Giải thích:
Liên kết đơn còn gọi là liên kết π là khẳng định sai.
⇒ Liên kết đơn còn gọi là liên kết σ.
Câu 14. Cho biết năng lượng liên kết của O – H là: 464 kJ mol−1. Tổng năng lượng liên kết trong phân tử H2O là
A. 464 kJ mol−1
B. 232 kJ mol−1
C. 928 kJ mol−1
D. 982 kJ mol−1
Đáp án: C
Giải thích: Trong phân tử H2O có hai liên kết O – H nên tổng năng lượng liên kết trong phân tử H2O là: 464.2 = 928 (kJ mol−1)
Câu 15. Trong các phân tử: HBr; HF; HCl; HI. Phân tử có liên kết bền nhất là
A. HF
B. HCl
C. HBr
D. HI
Đáp án: A
Giải thích:
Năng lượng liên kết của liên kết H – F trong phân tử HF là 565 kJ mol−1.
Năng lượng liên kết của liên kết H – Cl trong phân tử HCl là 431 kJ mol−1.
Năng lượng liên kết của liên kết H – Br trong phân tử HBr là 364 kJ mol−1.
Năng lượng liên kết của liên kết H – I trong phân tử HI là 297 kJ mol−1.
Năng lượng liên kết của liên kết H – F lớn nhất. Do đó liên kết trong phân tử HF bền nhất.
Bài giảng Hóa học 10 Bài 11: Liên kết cộng hóa trị - Cánh diều
Xem thêm các bài tóm tắt lý thuyết Hóa học 10 Cánh diều hay, chi tiết khác:
Bài 12: Liên kết hydrogen và tương tác Van Der Waals
Bài 13: Phản ứng oxi hóa – khử
Bài 14: Phản ứng hóa học và enthalpy