Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03 M được 2V ml dung dịch Y. Dung dịch Y có pH là:
A. 1
B. 2
C. 3
D. 4
 Giải bởi Vietjack
Giải bởi Vietjack
Chọn đáp án B
nNaOH = 0,01V.10-3 = 10-5V (mol)
nHCl = 0,03.V.10-3 = 3.10-5V (mol) > nNaOH
NaOH + HCl → NaCl + H2O
nNaOH phản ứng = nHCl phản ứng = 10-5V (mol)
nHCl dư = 3.10-5V - 10-5V = 2.10-5V (mol)
[H+] = = 0,01 (M)
⇒ pH = -log[H+] = 2
Lý thuyết pH của dung dịch. Chuẩn độ acid – base
I. pH của dung dịch, chất chỉ thị
1. pH của dung dịch
|
pH = -lg[H+] hoặc [H+] = 10-pH
|
với [H+] là nồng độ mol của ion H+.
- Môi trường acid có pH < 7.
- Môi trường base có pH > 7.
- Môi trường trung tính có pH = 7.
2. Ý nghĩa của pH trong thực tiễn
- pH có ý nghĩa trong tự nhiên, trong sản xuất và trong cơ thể sống xảy ra trong dung dịch nước với sự có mặt của các acid – base.
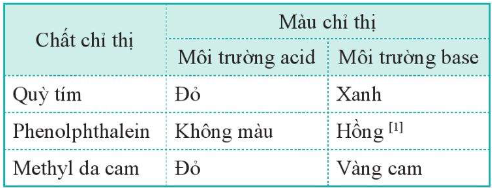
3. Xác định pH bằng chất chỉ thị
II. Chuẩn độ dung dịch acid và base
Nguyên tắc: Chuẩn độ là phương pháp xác định nồng độ của một chất bằng một dung dịch chuẩn đã biết nồng độ.
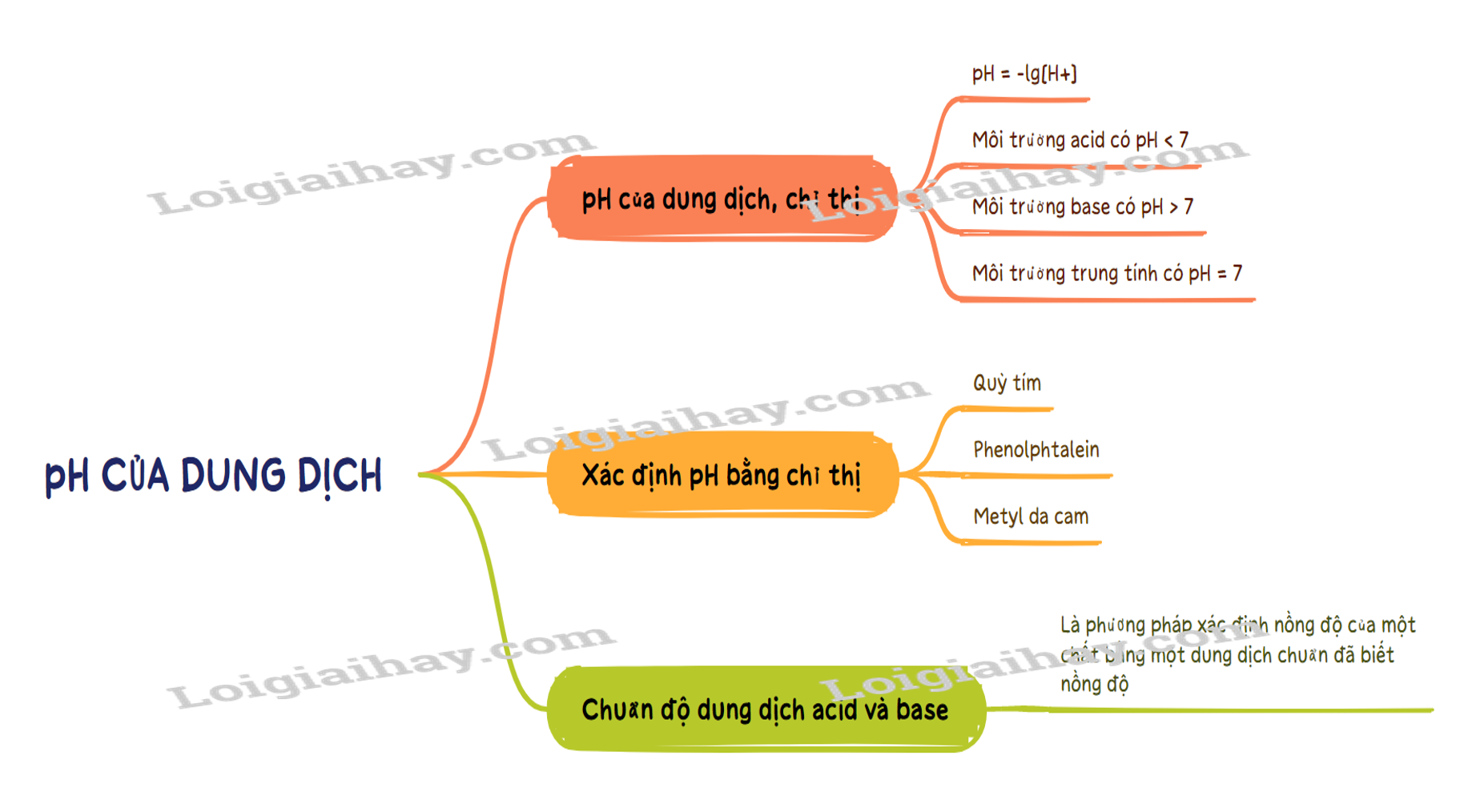
Sơ đồ tư duy pH của dung dịch. Chuẩn độ acid – base
Xem thêm một số kiến thức liên quan:
15 câu Trắc nghiệm pH của dung dịch. Chuẩn độ acid – base (Cánh diều) có đáp án – Hóa học lớp 11
Lý thuyết pH của dung dịch. Chuẩn độ acid – base (Cánh diều) hay, chi tiết | Hóa học 11
Dung dịch NaOH có pH = 12. Cần pha loãng dung dịch này bao nhiêu lần để thu được dung dịch NaOH mới có pH = 11?
Thể tích dung dịch Ba(OH)2 0,025M cần cho vào 100 ml dung dịch hỗn hợp gồm HNO3 và HCl có pH = 1, để thu được dung dịch có pH = 2 là
Dung dịch HCl có pH = 3, số lần để pha loãng dung dịch để thu được dung dịch HCl có pH = 4 là:
Thể tích dung dịch Ba(OH)2 0,025M cần cho vào 100 ml dung dịch hỗn hợp gồm HNO3 và HCl có pH = 1, để thu được dung dịch có pH = 2 là
Cho ba dung dịch có cùng giá trị pH, các dung dịch được sắp xếp theo thứ tự nồng độ mol tăng dần là:
Trộn 100ml dung dịch (gồm Ba(OH)2 0,1M và NaOH 0,1M) với 400 ml dung dịch (gồm H2SO4 0,0375 M và HCl 0,0125 M) thu được dung dịch X, giá trị pH của dung dịch X là:
Cho 40 ml dung dịch HCl 0,75M vào 160 ml dung dịch chứa đồng thời Ba(OH)2 0,08M và KOH 0,04M. pH của dung dịch thu được là:
Trộn lẫn V ml dung dịch NaOH 0,01M với V ml dung dịch HCl 0,03 M được 2V ml dung dịch Y. Dung dịch Y có pH là:
pH của dung dịch H2SO4 0,0005 M và pH của dung dịch CH3COOH 0,1 M (α = 4,25%) lần lượt là
Cho ba dung dịch có cùng giá trị pH, các dung dịch được sắp xếp theo thứ tự nồng độ mol tăng dần là:
Có V1 ml HCl (pH = 2). Cần thêm V2 ml H2O để được dung dịch HCl mới có pH = 3. Quan hệ V1 và V2 là :
pH của dung dịch H2SO4 0,0005 M và pH của dung dịch CH3COOH 0,1 M (α = 4,25%) lần lượt là
Dung dịch HCl và CH3COOH có cùng nồng độ. pH của hai dung dịch này tương ứng là x và y. Cứ 100 phân tử CH3COOH thì có 1 phân tử phân li. Quan hệ giữa x và y là:
Có V1 ml HCl (pH = 2). Cần thêm V2 ml H2O để được dung dịch HCl mới có pH = 3. Quan hệ V1 và V2 là :