Tailieumoi.vn xin giới thiệu phương trình CH≡C-CH2-CH3 + HCl → CH2=CCl-CH2-CH3 gồm điều kiện phản ứng, cách thực hiện, hiện tượng phản ứng và một số bài tập liên quan giúp các em củng cố toàn bộ kiến thức và rèn luyện kĩ năng làm bài tập về phương trình phản ứng hóa học. Mời các bạn đón xem:
Phương trình CH≡C-CH2-CH3 + HCl → CH2=CCl-CH2-CH3
1. Phản ứng hóa học:
CH≡C-CH2-CH3 + HCl 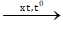
2. Điều kiện phản ứng
- Nhiệt độ và xúc tác HgCl2
3. Cách thực hiện phản ứng
- Dẫn 2 khí but-1-in và HCl vào bình có xúc tác HgCl2 ở nhiệt độ cao
4. Hiện tượng nhận biết phản ứng
- Không có
5. Tính chất hóa học
5.1. Tính chất hóa học của C4H6
a. Phản ứng cộng
- Cộng brom
- Dẫn butin qua dung dịch brom màu da cam.
+ Hiện tượng: Dung dịch brom bị mất màu. butin có phản ứng cộng với brom trong dung dịch.
+ Sản phẩm mới sinh ra có liên kết đôi trong phân tử nên có thể cộng tiếp với một phân tử brom nữa:
+ Trong điều kiện thích hợp, butin cũng có phản ứng cộng với hiđro và một số chất khác.
- Cộng hiđro
- Cộng hiđro clorua
+ Phản ứng cộng HX, H2O vào các ankin trong dãy đồng đẳng của axetilen cũng tuân theo quy tắc Mac-côp-nhi-côp như anken.
b. Phản ứng oxi hóa
- Butin là hiđrocacbon, vì vậy khi đốt, propin sẽ cháy tạo ra cacbon đioxit và nước, tương tự metan và etilen.
- Propin cháy trong không khí với ngọn lửa sáng, tỏa nhiều nhiệt.
c. Phản ứng thế bới kim loại
- Tính chất riêng của các ankin có nối ba đầu mạch
5.2. Tính chất hóa học của HCl
- Axit HCl làm đổi màu quỳ tím: Khi nhúng quỳ tím vào dung dịch axit sẽ có hiện tượng quỳ tím chuyển đỏ.
- Axit clohidric tác dụng với kim loại đứng trước H, tạo thành muối và hidro
Fe + 2HCl → FeCl2 + H2↑
- Axit clohidric tác dụng với oxit kim loại, tạo thành muối Clorua và nước
6HCl + Al2O3 →2AlCl3 + 3H2O
- Axit clohidric tác dụng với Bazơ, tạo thành muối Clorua và nước
3HCl + Al(OH)3 → AlCl3 + 3H2O
- Axit clohidric tác dụng với muối, tạo thành muối mới và axit mới
AgNO3 + 2HCl → AgCl↓ + HNO3
- Axit clohidric tác dụng với hợp chất có tính oxi hoá, thể hiện tính khử
6HCl + KClO3 → KCl + 3Cl2↑ + 3H2O
Lưu ý: Axit HCl sẽ không tác dụng với những kim loại đứng sau H trong dãy điện hoá, không tác dụng với các phi kim, axit, oxit kim loại, oxit phi kim.
6. Bạn có biết
- Phản ứng trên gọi là phản ứng cộng hidro halogenua.
- Phản ứng xảy ra qua hai giai đoạn tạo ra hai sản phẩm khác nhau.
7. Bài tập liên quan
Ví dụ 1: Cho phản ứng sau:
CH≡C-CH2-CH3 + HCl → CH2 = CCl-CH2-CH3
Điều kiện của phản ứng là:
A. Xúc tác
B. Nhiệt độ
C. Áp suất
D. Cả A và B
Hướng dẫn
Dẫn 2 khí but-1-in và HCl vào bình có xúc tác HgCl2 ở nhiệt độ cao
CH≡C-CH2-CH3 + HCl → CH2=CCl-CH2-CH3
Đáp án D
Ví dụ 2: But-1-in tác dụng với HCl theo tỉ lệ 1:1 tạo ra sản phẩm là:
A. CH2=CCl-CH2-CH3
B. CH3-CH=CCl-CH3
C. CH2=CCl-CH2-CH2Cl
D. CH2=CCl-CHCl-CH3
Hướng dẫn
But-1-in tác dụng với HCl theo tỉ lệ 1:1
CH≡C-CH2-CH3 + HCl → CH2=CCl-CH2-CH3
Đáp án A
Ví dụ 3: Cho 10,8g but-1-in tác dụng với HCl thì thu được m (g) dẫn xuất halogen. Tính giá trị của m?
A. 0,905 g
B. 9,05 g
C. 1,81 g
D. 18,1 g
Hướng dẫn
Số mol của but-1-in là: 10,8/54 = 0,2 mol
→ m = 0,2.90,5 = 18,1 g
Đáp án D
8. Một số phương trình phản ứng hoá học khác của Ankin và hợp chất: