Bộ 13 đề thi thử THPT QG chuẩn môn Hóa học năm 2023 - GV Lê Đăng Khương có đáp án
Chỉ 100k mua trọn Bộ 13 đề thi thử THPT QG chuẩn môn Hóa học năm 2023 - GV Lê Đăng Khương có đáp án bản word có lời giải chi tiết (chỉ 20k cho 1 đề thi bất kì):
B1: Gửi phí vào tài khoản 0711000255837 - NGUYEN THANH TUYEN - Ngân hàng Vietcombank
B2: Nhắn tin tới zalo Vietjack Official - nhấn vào đây để thông báo và nhận giáo án.
Xem thử tài liệu tại đây: Link tài liệu
Bộ Giáo dục và Đào tạo
Kì thi tốt nghiệp THPT Quốc gia
Năm học 2022-2023
Bài thi môn: Hóa học
Thời gian làm bài: 50 phút
(không kể thời gian phát đề)
Đề số 2
Câu 1. Kim loại M có các tính chất: nhẹ, bền trong không khí ở nhiệt độ thường; tan được trong dung dịch NaOH nhưng không tan trong dung dịch HNO3 đặc nguội và H2SO4 đặc nguội. Kim loại M là:
A. Zn B. Fe C. Cr D. Al
Câu 2. Dùng chất nào sau đây phân biệt 2 khí SO2 và CO2 bằng phương pháp hóa học?
A. Dung dịch HCl
B. Nước vôi trong
C. Dung dịch NaOH
D. Dung dịch nước brom
Câu 3. Tên thay thế của ancol có công thức cấu tạo thu gọn CH3(CH2)2CH2OH là
A. propan-1-ol
B. butan-1-ol
C. butan-2-ol
D. pentan-2-ol
Câu 4. Phát biểu nào sau đây sai?
A. Phenol (C6H5OH) phản ứng được với dung dịch NaOH, tạo ra muối và nước.
B. Phân tử phenol có nhóm –OH.
C. Phân tử phenol có vòng benzen.
D. Phenol có tính bazơ.
Câu 5. Cho các chất: Al, Fe3O4, NaHCO3, Fe(NO3)2, Cr2O3, Cr(OH)3. Số chất tác dụng được với cả dung dịch HCl và dung dịch NaOH loãng?
A. 4. B. 3. C. 2. D. 5.
Câu 6. Hợp chất etylamin là
A. Amin bậc II.
B. Amin bậc I.
C. Amin bậc III.
D. Amin bậc IV.
Câu 7. Một este E mạch hở có công thức phân tử C4H6O2. Thủy phân E trong môi trường axit thu được sản phẩm có phản ứng tráng bạc. Có bao nhiêu công thức cấu tạo của E thỏa mãn tính chất trên?
A. 1. B. 3. C. 2. D. 4.
Câu 8. Số proton và số nơtron có trong một nguyên tử nhôm ( ) lần lượt là
A. 13 và 14.
B. 14 và 13.
C. 12 và 14.
D. 13 và 15.
Câu 9. Saccarozơ và axit fomic đều có phản ứng:
A. Thủy phân trong môi trường axit.
B. Với Cu(OH)2 ở nhiệt độ thường.
C. Với AgNO3 trong dung dịch NH3.
D. Với dung dịch NaCl.
Câu 10. Chất hữu cơ chủ yếu dùng điều chế trực tiếp axit axetic trong công nghiệp hiện nay là:
A. Axetanđehit.
B. Etyl axetat.
C. Ancol etylic.
D. Ancol metylic.
Câu 11. Cho phản ứng:
N2(k) + 3H2(k) → 2NH3(k) ΔH = –92 KJ
và các yếu tố: (1) Giảm nhiệt độ; (2) Giảm áp suất; (3) Thêm xúc tác bột sắt; (4) Giảm nồng độ H2. Số yếu tố làm cân bằng chuyển dịch theo chiều nghịch là:
A. 3. B. 1. C. 2. D. 0.
Câu 12. Phát biểu nào sau đây đúng?
A. Độ dinh dưỡng của phân lân được đánh giá theo % về khối lượng của K2O trong phân.
B. Phân đạm cung cấp nitơ cho cây trồng dưới dạng ion NH4+ hoặc NO3–.
C. Độ dinh dưỡng của phân kali được đánh giá theo % về khối lượng của kali trong phân.
D. Supephotphat đơn có thành phần chính là Ca(H2PO4)2.
Câu 13. Phát biểu nào sau đây không đúng:
A. Xesi là kim loại mềm nhất.
B. Đi từ Li đến Cs, nhìn chung nhiệt độ nóng chảy của kim loại giảm dần.
C. Xesi là kim loại có thế điện cực chuẩn nhỏ nhất.
D. Xesi là kim loại có năng lượng ion hóa I1 nhỏ nhất.
Câu 14. Công thức phân tử nào sau đây phù hợp với một este no, mạch hở?
A. C12H16O10.
B. C10H20O4.
C. C11H16O10.
D. C13H15O13.
Câu 15. Cho 4,5 gam amin X đơn chức, bậc 1 tác dụng với lượng vừa đủ dung dịch HCl thu được 8,15 gam muối. Tên gọi của X là:
A. Alanin.
B. Đietyl amin.
C. Đimetyl amin.
D. Etyl amin.
Câu 16. Ancol no mạch hở A chứa n nguyên tử C và m nhóm OH trong cấu tạo phân tử. Cho 18 gam A tác dụng hết với Na cho 4,48 lít H2 (đktc). Mối quan hệ giữa n và m là:
A. 29 m = 14n + 2.
B. 35m = 21n + 2.
C. 11m = 7n + 1.
D. 7m = 4n + 2.
Câu 17. Để bảo quản Na người ta ngâm Na trong:
A. phenol lỏng
B. dầu hỏa
C. nước
D. ancol etylic
Câu 18. Chất không phải axit béo là
A. axit panmitic.
B. axit stearic.
C. axit oleic.
D. axit axetic.
Câu 19. Hỗn hợp X gồm Al, Ca, Al4C3 và CaC2. Cho 15,15 gam X vào nước dư, chỉ thu được dung dịch Y và hỗn hợp khí Z (C2H2, CH4, H2). Đốt cháy hết Z, thu được 4,48 lít CO2 (đktc) và 9,45 gam H2O. Nhỏ từ từ 200 ml dung dịch HCl 2M vào Y, thu được m gam kết tủa. Giá trị m là:
A. 15,6 B. 19,5 C. 27,3 D. 16,9
Câu 20. Bố trí một sơ đồ thí nghiệm như hình vẽ:
Biết rằng ở bình (2) có các điều kiện phản ứng đầy đủ và phản ứng xảy ra hoàn toàn. Sản phẩm và khí dư đều thoát hết khỏi bình (1). Hiệu suất của phản ứng hợp nước trong bình (1) là
A. 80%. B. 90%. C. 75%. D. 25%.
Câu 21. Đốt cháy hoàn toàn hỗn hợp X gồm ba peptit mạch hở cần dùng 1,11 mol O2, sản phẩm cháy gồm CO2, H2O và N2 được dẫn qua nước vôi trong lấy dư, thu được 97 gam kết tủa; đồng thời khí thoát ra có thể tích là 3,36 lít (đktc). Nếu đun nóng lượng X trên với dung dịch KOH vừa đủ, thu được m gam hỗn hợp Y gồm 4 muối của Gly, Ala, Val và Glu. Biết độ tan của N2 trong nước không đáng kể. Giá trị của m là:
A. 45,32 B. 44,52 C. 42,46 D. 43,34
Câu 22. Có những nhận xét sau:
a. Từ Na2SO4 cần tối thiểu ba phản ứng hóa học để điều chế kim loại natri.
b. Có thể điều chế Cu bằng phương pháp thủy luyện, phương pháp nhiệt luyện và phương pháp điện phân.
c. Vai trò của criolit là chất xúc tác trong quá trình sản xuất nhôm bằng cách điện phân nóng chảy Al2O3.
d. Trong pin điện hóa cũng như trong điện phân, ở anot xảy ra quá trình khử, catot xảy ra quá trình oxi hóa.
e. Nối thanh Cu với thanh Zn bằng dây dẫn rồi nhúng vào dung dịch HCl thì khí thoát ra chủ yếu ở thanh Zn.
f. Các kim loại kiềm là các chất rắn, màu trắng, dễ nóng chảy, dẫn điện và dẫn nhiệt kém.
g. Các hợp kim thường dẫn điện tốt hơn so với các kim loại.
h. Tính chất vật lí và tính chất cơ học của hợp kim khác nhiều so với kim loại tạo thành hợp kim.
i. Tính dẫn điện của các kim loại giảm dần theo thứ tự Ag, Au, Cu, Al.
k. Gang xám chứa ít cacbon, rất ít silic, chứa nhiều xementit (Fe3C). Gang xám rất cứng và giòn, chủ yếu dùng để luyện thép. Số nhận xét đúng là:
A. 4 B. 3 C. 2 D. 5
Câu 23. Cho các phát biểu sau:
(a) Đốt cháy hoàn toàn hỗn hợp gồm axit no, mạch hở, đơn chức và este no, mạch hở, đơn chức luôn thu được số mol CO2 bằng số mol H2O.
(b) Phân tử khối của hợp chất hữu cơ chứa 3 nguyên tố C, H, O luôn là số chẵn.
(c) Số nguyên tử hiđro trong phân tử amin luôn là số lẻ.
(d) Dung dịch fructozơ bị oxi hóa bởi H2 (xúc tác Ni, t°) tạo ra sobitol.
(e) Saccarozơ không có phản ứng tráng bạc vì phân tử không có nhóm -OH hemiaxetal.
(f) Este tạo bởi axit no, 2 chức, mạch hở và ancol no, hai chức, mạch hở luôn có công thức dạng .
(g) Đa số các polime dễ tan trong các dung môi hữu cơ như benzen, ete, xăng.
(h) Các amino axit là các chất lỏng, có nhiệt độ sôi cao.
(i) Anilin có tên thay thế là phenylamin.
(k) Đường mía, đường củ cải, đường thốt nốt, đường mạch nha đều có thành phần chính là saccarozơ.
Số phát biểu đúng là:
A. 4. B. 2. C. 5. D. 3.
Câu 24 Hỗn hợp X gồm 1 ancol đơn chức và 1 este đơn chức (mạch hở, phân tử có cùng số nguyên tử cacbon). Đốt cháy hoàn toàn m gam X cần dùng vừa đủ V lít khí O2 ở đktc, thu được 10,08 lít CO2 (đktc) và 7,2 gam H2O. Mặt khác, m gam X phản ứng với dung dịch NaOH dư, thu được 0,15 mol hỗn hợp ancol. Giá trị của V gần nhất với:
A. 11,8 B. 12,9 C. 24,6 D. 23,5
Câu 25. Hỗn hợp X gồm hiđro, propen, axit acrylic, ancol anlylic (C3H5OH). Đốt cháy hoàn toàn 0,75 mol X, thu được 30,24 lít khí CO2 (đktc). Đun nóng X với bột Ni một thời gian, thu được hỗn hợp Y. Tỉ khối hơi của Y so với X bằng 1,25. Cho 0,1 mol Y phản ứng vừa đủ với V lít dung dịch Br2 0,1M. Giá trị của V là
A. 0,6. B. 0,5. C. 0,3. D. 0,4.
Câu 26. Hòa tan hết 25 gam hỗn hợp X gồm Cu và các oxit sắt (trong hỗn hợp X oxi chiếm 16,8% về khối lượng) cần vừa đúng dung dịch hỗn hợp A chứa b mol HCl và 0,25 mol HNO3 thu được 1,68 lít NO (đktc) là sản phẩm khử duy nhất và dung dịch Y. Cho dung dịch Y tác dụng với một lượng dung dịch AgNO3 vừa đủ thu được m gam kết tủa và dung dịch Z. Cho dung dịch Z tác dụng với một lượng dư dung dịch NaOH, lọc kết tủa, nung đến khối lượng không đổi thu được 28 gam chất rắn. Các phản ứng xảy ra hoàn toàn. Giá trị gần nhất với m là:
A. 90. B. 100. C. 110. D. 80.
Câu 27. Sục 6,16 lít CO2 (đktc) vào 1 lít dung dịch chứa NaOH x (mol/l) và Na2CO3 y (mol/l) thu được dung dịch X. Cho từ từ 200 ml dung dịch chứa HCl 1M và H2SO4 0,3M vào dung dịch X thu được 2,688 lít khí CO2 (đktc) và dung dịch Y. Cho Ba(OH)2 dư vào dung dịch Y thu được 59,29 gam kết tủa. Tỉ lệ x : y là gần nhất với:
A. 4,1. B. 5,1. C. 3,1. D. 2,1.
Câu 28. Dung dịch X chứa FeCl3 và CuCl2 có cùng nồng độ mol. Tiến hành điện phân dung dịch X bằng điện cực trơ tới khi khối lượng catot tăng 12,4 gam thì dừng điện phân, lúc đó ở anot thoát ra V lít khí (đktc). Cho AgNO3 dư vào dung dịch sau điện phân thu được 39,5 gam kết tủa. Nhúng thanh catot vào dung dịch HCl thấy khí thoát ra. Giá trị của V là?
A. 7,056 lít.
B. 6,160 lít.
C. 6,384 lít.
D. 6,720 lít.
Câu 29. Cho m gam hỗn hợp bột X gồm FexOy, CuO và Cu vào 600 ml dung dịch HCl 1M, thu được dung dịch Y (không chứa HCl) và còn lại 6,4 gam kim loại không tan. Cho Y tác dụng với dung dịch AgNO3 dư thu được 102,3 gam kết tủa. Các phản ứng xảy ra hoàn toàn. Giá trị của m gần nhất với:
A. 22,7. B. 34,1. C. 29,1. D. 27,5.
Câu 30. Cho 14,58 gam hỗn hợp X gồm chất béo Y và axit béo Z (trong đó Y được tạo từ glixerol và axit Z) tác dụng vừa đủ với 0,05 mol NaOH, thu được 0,92 mol glixerol. Khối lượng phân tử của axit Z (g/mol):
A. 239 B. 284 C. 256 D. 282
Câu 31. Hợp chất X mạch hở tạo bởi axit cacboxylic Y và ancol đa chức Z. Đốt cháy hoàn toàn Y thu được 1,792 lít CO2 và 1,44 gam nước. Lấy 0,15 mol Z vào bình chứa Na dư, kết thúc phản ứng sinh ra 3,36 lít H2; đồng thời khối lượng bình tăng 11,1 gam. Đốt cháy hoàn toàn 0,05 mol hỗn hợp E chứa X, Y, Z cần 5,376 lít O2, thu được 4,704 lít CO2 và 3,6 gam nước. Các khí đo đktc. Phần trăm khối lượng của Y trong E là:
A. 11,63% B. 23,26% C. 17,44% D. 21,51%
Câu 32. X, Y là 2 axit cacboxylic đều no và mạch hở (MX < MY). Đốt cháy a mol X cũng như Y đều thu được a mol H2O. Z và T là 2 este đều mạch hở và không chứa nhóm chức khác. Đun hỗn hợp E chứa X, Y, Z, T với 240 ml dung dịch NaOH 1M, thu được 16,14 gam hỗn hợp 2 muối và hỗn hợp F gồm 2 ancol kế tiếp thuộc cùng dãy đồng đẳng. Đốt toàn bộ F thu được 5,824 lít CO2 (đktc) và 7,92 gam nước. % khối lượng của Y trong E gần nhất với:
A. 8%. B. 6%. C. 10% D. 12%.
Câu 33. Tiến hành các thí nghiệm sau:
(1) Cho Zn vào dung dịch AgNO3.
(2) Cho Fe vào dung dịch Fe2(SO4)3.
(3) Cho Na vào dung dịch CuSO4.
(4) Dẫn khí CO (dư) qua bột CuO nóng.
(5) Điện phân dung dịch KNO3 với điện cực trơ, có màng ngăn.
(6) Điện phân dung dịch Fe2(SO4)3 đến khi catot có khí thoát ra.
(7) Cho Na vào dung dịch MgSO4.
(8) Nhiệt phân Hg(NO3)2.
(9) Nhiệt phân AgNO3.
(10) Dẫn khí H2 qua Cr2O3 nung ở nhiệt độ cao.
(11) Sục khí H2S vào dung dịch AgNO3.
(12) Cho Zn dư vào dung dịch CrCl3. Số thí nghiệm có tạo thành kim loại là:
A. 5. B. 6. C. 7. D. 8.
Câu 34. Hỗn hợp E chứa 2 axit cacboxylic và 1 este đều mạch hở, không phân nhánh và không chứa nhóm chức khác. Đốt cháy 25,48 gam E cần dùng 0,73 mol O2 thu được 7,92 gam nước. Hiđro hóa hoàn toàn 25,48 gam E thu được hỗn hợp F. Đun nóng F với dung dịch NaOH vừa đủ thu được một ancol Z có khối lượng 7,36 gam và 2 muối X, Y có tỉ lệ mol tương ứng 1 : 2 (MX < MY). Đun nóng 2 muối với vôi tôi xút thu được 4,704 lít (đktc) hỗn hợp khí có tỉ khối so với He bằng 15,5/3. Phần trăm khối lượng của axit có khối lượng phân tử lớn trong E là:
A. 11,582%.
B. 11,384%.
C. 13,423%.
D. 11,185%.
Câu 35. Hợp chất X (chứa C, H, O, N) có công thức phân tử trùng với công thức đơn giản nhất, vừa tác dụng với axit vừa tác dụng với kiềm. Trong X, % khối lượng của nguyên tố C, H, N lần lượt là 40,449%; 7,865%; 15,73%. Khi cho 4,45 g X phản ứng hoàn toàn với NaOH (đun nóng) được 4,85 g muối khan. Nhận định nào về X sau đây không đúng:
A. X là hợp chất no, tạp chức.
B. X tác dụng với NaOH theo tỉ lệ 1 : 1.
C. X là đồng đẳng của glyxin.
D. Phân tử X chứa 1 nhóm este.
Câu 36. Cho hỗn hợp X gồm CuO và NaOH có tỉ lệ số mol 1:1 tác dụng vừa đủ với dung dịch hỗn hợp HCl 1M và H2SO4 0,5M thu được dung dịch Y chỉ chứa m gam hỗn hợp muối trung hòa. Điện phân dung dịch Y với điện cực trơ, màng ngăn xốp cường độ I = 2,68A đến khi khối lượng dung dịch giảm 20,225 gam mất t giây thì dừng lại, thu được dung dịch Z. Cho m gam Fe vào dung dịch Z sau khi phản ứng kết thúc thu được 0,9675m gam hỗn hợp 2 kim loại. Hiệu suất điện phân 100%. Giá trị của t gần nhất với:
A. 11542.
B. 12654.
C. 12135.
D. 11946.
Câu 37. Khi sục từ từ khí CO2 vào dung dịch Ca(OH)2.
Đồ thị biểu diễn sự phụ thuộc khối lượng kết tủa theo số mol của CO2 như trên. Khối lượng kết tủa cực đại là:
A. 6 gam.
B. 6,5 gam.
C. 5,5 gam.
D. 5 gam.
Câu 38. Cho hỗn hợp E gồm tripeptit X có dạng Gly-M-M (được tạo nên từ các α-amino axit thuộc cùng dãy đồng đẳng), amin Y và este no, hai chức Z (X, Y, Z đều mạch hở, X và Z cùng số nguyên tử cacbon). Đun m gam E với dung dịch NaOH, cô cạn dung dịch sau phản ứng, thu được phần rắn chỉ chứa ba muối và 0,04 mol hỗn hợp hơi T gồm ba chất hữu cơ có tỉ khối hơi so với H2 bằng 24,75. Đốt toàn bộ muối trên cần 7,672 lít O2 (đktc), thu được 5,83 gam Na2CO3 và 15,2 gam hỗn hợp CO2 và H2O. Phần trăm khối lượng của Y trong E là:
A. 11,345%.
B. 12,698%.
C. 12,720%.
D. 9,735%.
Câu 39. Peptit X CxHyOzN6 mạch hở tạo bởi một α-amino axit no chứa 1 nhóm -NH2 và 1 nhóm -COOH. Để phản ứng hết 19g hỗn hợp E chứa X, este Y (CnH2n-2O4) và este Z (CmH2m-4O6) cần 300 ml dung dịch NaOH 1M thu được hỗn hợp muối và 2 ancol có cùng số cacbon. Lấy toàn bộ hỗn hợp muối nung với vôi tôi xút được hỗn hợp F chứa 2 khí có tỉ khối so với H2 là 3,9. Đốt cháy 19 g E cần 0,685 mol O2 thu được 9,72 g H2O. Biết X, Y đều là este thuần chức. Phần trăm khối lượng của X trong hỗn hợp E gần nhất với:
A. 19%. B. 23%. C. 28%. D. 32%.
Câu 40. Hỗn hợp H gồm 3 este mạch hở X, Y, Z. Trong đó MX < MY < MZ. Y, Z có cùng số liên kết C=C và đều được tạo từ các axit cacboxylic thuần chức và ancol. Đốt cháy hoàn toàn 0,06 mol H thu được 3,78 gam H2O. Hiđro hóa hoàn toàn 0,06 mol H cần 0,672 lít H2 (đktc), đem sản phẩm thu được tác dụng vừa đủ với dung dịch NaOH thì được dung dịch M chỉ chứa 2 muối và hỗn hợp F gồm 2 ancol có cùng số cacbon. Cho F tác dụng với Na dư thấy có 0,784 lít khí thoát ra ở đktc. Các phản ứng xảy ra hoàn toàn. Phần trăm khối lượng của Y trong H gần nhất với:
A. 34,2%. B. 36,7%. C. 35,3%. D. 32,1%.
| Câu 1 | Câu 2 | Câu 3 | Câu 4 | Câu 5 |
|---|---|---|---|---|
| D | D | B | D | A |
| Câu 6 | Câu 7 | Câu 8 | Câu 9 | Câu 10 |
| B | D | A | A | D |
| Câu 11 | Câu 12 | Câu 13 | Câu 14 | Câu 15 |
| B | B | C | A | D |
| Câu 16 | Câu 17 | Câu 18 | Câu 19 | Câu 20 |
| A | B | D | D | A |
| Câu 21 | Câu 22 | Câu 23 | Câu 24 | Câu 25 |
| B | C | C | D | B |
| Câu 26 | Câu 27 | Câu 28 | Câu 29 | Câu 30 |
| B | B | B | C | B |
| Câu 31 | Câu 32 | Câu 33 | Câu 34 | Câu 35 |
| B | B | C | D | A |
| Câu 36 | Câu 37 | Câu 38 | Câu 39 | Câu 40 |
| A | A | B | A | C |
Câu 1. Chọn đáp án D
A. Zn tan được trong dung dịch HNO3 đặc nguội và H2SO4 đặc nguội. ⇒ Loại.
B. Fe không bền trong không khí ở nhiệt độ thường, dễ bị ăn mòn, hóa gỉ sắt. ⇒ Loại.
C. Cr thuộc nhóm kim loại nặng ⇒ Loại.
D. Al có đầy đủ các đặc điểm đã nêu: nhẹ, bền trong không khí ở nhiệt độ thường (tạo lớp màng oxit nhôm bền, bảo vệ kim loại bên trong khỏi sự ăn mòn); tan được trong dung dịch NaOH nhưng không tan trong dung dịch HNO3 đặc nguội và H2SO4 đặc nguội.
Kiến thức cần nhớ
Các kim loại như Al, Fe, Cr không phản ứng với HNO3 và H2SO4 đặc nguội
Câu 2. Chọn đáp án D
Chọn dung dịch nước brom để phân biệt 2 khí SO2 và CO2:
+ Khí SO2 làm mất màu nước brom.
SO2 + Br2 + 2H2O → H2SO4 + 2HBr
+ Khí CO2 không làm mất màu nước brom.
- HCl đều không phản ứng với 2 khí.
- NaOH đều phản ứng với 2 khí tạo dung dịch không màu, không có điểm khác biệt.
- Nước vôi trong đều phản ứng với 2 khí tạo kết tủa trắng.
⇒ Không dùng được 3 chất trên để phân biệt 2 khí.
Câu 3. Chọn đáp án B
A. propan-1-ol: CH3CH2CH2OH
B. butan-1-ol: CH3(CH2)2CH2OH
C. butan-2-ol: CH3CH(OH)CH2CH3
D. pentan-2-ol: CH3CH(OH)CH2CH2CH3
Câu 4. Chọn đáp án D
A đúng. Phương trình phản ứng:
2C6H5OH + 2Na → 2C6H5ONa + H2
B và C đúng. CTCT của phenol là C6H5OH
D sai. Phenol có tính acid yếu.
Câu 5. Chọn đáp án A
Các chất tác dụng được với cả dung dịch HCl và dung dịch NaOH loãng là: Al, NaHCO3, Fe(NO3)2, Cr(OH)3.
2Al + 6HCl → 2AlCl3 + 3H2
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
NaHCO3 + HCl → NaCl + CO2 + H2O
NaHCO3 + NaOH → Na2CO3 + H2O
9Fe(NO3)2 + 12HCl → 5Fe(NO3)3 + 4FeCl3 + 3NO + 6H2O
Fe(NO3)2 + 2NaOH → Fe(OH)2 + 2NaNO3
Cr(OH)3 + 3HCl → CrCl3 + 3H2O
Cr(OH)3 + NaOH → NaCrO2 + 2H2O
Câu 6. Chọn đáp án B
Etylamin có CTCT: CH3CH2NH2
Đây là hợp chất amin bậc I.
Câu 7. Chọn đáp án D
Các công thức thỏa mãn là:
HCOOCH2CH=CH2
HCOOCH=CHCH3
HCOOC(CH3)=CH2
CH3COOCH=CH2
Câu 8. Chọn đáp án A
Nhôm: 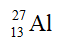
Câu 9. Chọn đáp án A
A sai. Axit fomic không bị thủy phân trong môi trường acid.
B đúng. Saccarozơ có nhiều nhóm –OH gắn với C liền kề nên tạo phức được với Cu(OH)2 ở nhiệt độ thường.
2HCOOH + Cu(OH)2 → (HCOO)2Cu + 2H2O
C đúng. Saccarozơ là đường không khử, không có khả năng tham gia phản ứng tráng gương.
D đúng. Cả 2 chất đều không phản ứng với NaCl.
Câu 10. Chọn đáp án D.
Ancol metylic dùng để điều chế trực tiếp axit axetic trong công nghiệp hiện nay.
Kiến thức cần nhớ
Các phương pháp điều chế acid acetic:
- Lên men giấm là phương pháp cổ nhất, hiện nay chỉ dùng để sản xuất giấm ăn.
C2H5OH + O2 
- Oxi hóa acetaldehyd là phương pháp điều chế hay dùng trước kia:
2CH3CHO + O2 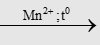
- Không điều chế từ ethyl acetat vì cho hiệu suất rất thấp
- Đi từ methanol và CO nhờ xúc tác thích hợp là phương pháp hiện nay hay được dùng nhất vì giá thành rẻ nhất, cho hiệu suất cao.
CH3OH + CO 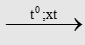
Câu 11. Chọn đáp án B
(1) Giảm nhiệt độ làm cân bằng chuyển dịch theo chiều thuận vì phản ứng thuận thu nhiệt (ΔH < 0).
(2) Giảm áp suất làm cân bằng chuyển dịch theo chiều nghịch để làm tăng số mol khí, tăng áp suất chung của hệ.
(3) Thêm xúc tác bột sắt không làm chuyển dịch cân bằng vì làm tăng tốc độ cả phản ứng thuận và phản ứng nghịch.
(4) Giảm nồng độ H2 làm cân bằng chuyển dịch theo chiều thuận để làm giảm số mol khí H2. Vậy chỉ có một yếu tố làm cân bằng chuyển dịch theo chiều nghịch.
Kiến thức cần nhớ
Cân bằng hóa học là trạng thái của phản ứng thuận nghịch khi tốc độ của phản ứng thuận bằng tốc độ phản ứng nghịch.
Các yếu tố ảnh hưởng đến cân bằng hóa học.
Nguyên lí Lơ-Sa-tơ-li-ê: Một phản ứng thuận nghịch đang ở trạng thái cân bằng khi chịu một tác động từ bên ngoài như biến đổi nồng độ, nhiệt độ, áp suất thì cân bằng sẽ chuyển dịch theo chiều chống lại sự biến đổi đó.
a. Nồng độ: Tăng nồng độ chất tham gia phản ứng → cân bằng chuyển dịch theo chiều thuận và ngược lại.
b. Áp suất: Tăng áp suất → cân bằng chuyển dịch về phía có số phân tử khí ít hơn, giảm áp suất cân bằng dịch về phía có số phân tử khí nhiều hơn.
c. Nhiệt độ: Tăng nhiệt độ → cân bằng chuyển dịch về chiều thu nhiệt, giảm nhiệt độ cân bằng chuyển dịch về chiều tỏa nhiệt.
Chú ý: ΔH = H2 – H1 nếu ΔH > 0: Thu nhiệt; ΔH < 0: Tỏa nhiệt
Câu 12. Chọn đáp án B
A sai. Độ dinh dưỡng của phân lân được đánh giá theo % về khối lượng của P2O5 trong phân.
B đúng. NH4+ và NO3– là 2 dạng ion cung cấp đạm mà dễ tan, cây dễ hấp thu.
C sai. Độ dinh dưỡng của phân kali được đánh giá theo % về khối lượng của K2O trong phân.
D sai. Supephotphat đơn có thành phần chính là Ca(H2PO4)2 và CaSO4.
Câu 13. Chọn đáp án C
A đúng. Kim loại Cesi mềm như sáp, là kim loại mềm nhất.
B đúng. Đi từ Li đến Cs, bán kính kim loại tăng dần, các nguyên tử dễ tách nhau hơn, nhìn chung nhiệt độ nóng chảy của chúng giảm dần.
C sai. Liti là kim loại có thế điện cực chuẩn nhỏ nhất (-3,05 V).
D đúng. Kim loại kiềm có cấu hình e lớp ngoài cùng là ns1, chúng dễ tách 1 e để tạo cấu hình bền của khí hiếm, do vậy kim loại kiềm có năng lượng ion hóa I1 nhỏ nhất. Trong đó, Cs có bán kính lớn nhất, dễ tách 1 e lớp ngoài nhất nên Cs có năng lượng ion hóa I1 nhỏ nhất.
Câu 14. Chọn đáp án A
Đặt CTTQ của este là: CxHyO2z
Este no, mạch hở có độ bội liên kết
Thử các đáp án chỉ thấy có công thức A phù hợp (x=12,y=16,z=5).
Câu 15. Chọn đáp án D
Áp dụng tăng giảm khối lượng có:
⇒ X: CH3CH2NH2
Câu 16. Chọn đáp án A
Đặt CTTQ của A là CnH2n+2Om
18 gam A + Na → 0,2 mol H2
⇒
Câu 17. Chọn đáp án B
Trong các chất trên, chỉ có dầu hóa không phản ứng được với Na nên được dùng để bảo quản Na khỏi tác nhân không khí, độ ẩm, hơi nước…
Phương trình phản ứng:
2C6H5OH + Na → 2C6H5ONa + H2
2H2O + 2Na → 2NaOH + H2
2C2H5OH + 2Na → 2C2H5ONa + H2
Kiến thức cần nhớ
Kim loại kiềm nằm ở nhóm IA đó là những kim loại có cấu hình e ở lớp ngoài cùng ns1. Đây là nhóm kim loại điển hình.
▪ So với các nguyên tử khác trong cùng 1 chu kì thì kim loại kiềm có bán kính nguyên tử lớn hơn, độ âm điện nhỏ, năng lượng ion hóa nhỏ. Nên kim loại kiềm rất dễ nhường 1 electron trong các phản ứng hóa học. Hay nói cách khác kim loại kiềm có tính khử mạnh.
▪ Về cấu tạo mạng tinh thể nhóm kim loại kiềm đều có cấu tạo mạng tinh thể lập phương tâm khối, đây là kiểu mạng kém đặc khít nhất. Do đó, kim loại kiềm là nhóm kim loại nhẹ, có nhiệt độ nóng chảy, nhiệt độ sôi thấp. Chúng có màu trắng bạc và có ánh kim.
▪ Do có tính khử mạnh nên khi cho kim loại kiềm vào nước, nó xảy ra phản ứng rất mãnh liệt và gây nổ tạo dung dịch hidroxit tương ứng và giải phóng khí H2 ⇒ để bảo quản kim loại kiềm người ta thường ngâm nó trong dầu hỏa.
Chú ý: Khi cho kim loại kiềm vào các dung dịch.
- Dung dịch axit thì chúng sẽ phản ứng với dung dịch axit trước, sau đó nếu còn dư chúng sẽ phản ứng với nước.
- Dung dịch muối thì chúng sẽ phản ứng với nước có trong dung dịch tạo dung dịch kiềm, sau đó xảy ra phản ứng trao đổi với muối nếu có.
- Cần chú ý mối quan hệ sau để cho việc tính toán được nhanh: nOH- = 2.nH2 .
Câu 18. Chọn đáp án D
Acid panmitic, acid stearic, acid oleic đều là các acid béo, là thành phần cấu tạo nên chất béo.
Chỉ có acid acetic không phải là một acid béo.
Câu 19. Chọn đáp án D
Quy đổi 15,15 gam hỗn hợp X thành Ca, Al và C. Xét quá trình đốt hỗn hợp khí Z, ta có hệ sau:
Dung dịch Y gồm Ca2+ (0,15 mol), AlO2– (0,25 mol) và OH–. Xét dung dịch Y có:
Khi cho 0,4 mol HCl tác dụng với dung dịch Y ta nhận thấy: nAlO2- < nH+ - nOH- < 4nAlO2-
Câu 20. Chọn đáp án A
Câu 21. Chọn đáp án B
Câu 22. Chọn đáp án C
a) Sai. Từ Na2SO4 cần tối thiểu 2 phản ứng để điều chế kim loại Na.
Na2SO4 + BaCl2 → 2NaCl + BaSO4
2NaCl 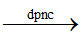
b) Đúng. Phương pháp thủy luyện:
CuSO4 + Fe → Cu + FeSO4
Phương pháp nhiệt luyện:
CuO + CO 
Phương pháp điện phân:
CuCl2 → Cu + Cl2
c) Đúng.
d) Sai. Trong điện phân, ở catot xảy ra quá trình khử, ở anot xảy ra quá trình oxi hóa.
Catot: Cu2+ + 2e → Cu
Anot: 2Cl- → Cl2 + 2e
e) Sai. Nối thanh Cu với thanh Zn bằng dây dẫn rồi nhúng vào dung dịch HCl thì khí thoát ra chủ yếu ở thanh Cu. Cu đóng vai trò là catot, Zn đóng vai trò anot.
Catot: 2H+ + 2e → H2
Anot: Zn → Zn2+ + 2e
f) Sai. Kim loại kiềm có khả năng dẫn điện cao.
g) Sai. Các hợp kim thường dẫn điện kém hơn so với các kim loại do trong hợp kim còn có các liên kết cộng hóa trị làm giảm độ linh động của electron.
h) Sai. Tính chất vật lý của hợp kim không khác nhiều kim loại tạo ra chúng.
i) Sai. Tính dẫn điện của các kim loại giảm dần theo thứ tự Ag, Cu, Au, Al.
k) Sai. Gang xám: Chứa nhiều C và S, ít cứng và kém giòn hơn gang trắng, dùng chế tạo máy, ống dẫn nước. Gang xám dùng để đúc bệ máy, ống dẫn nước,…
Câu 23. Chọn đáp án C
(a) Đúng. Axit no, mạch hở, đơn chức và este no, mạch hở, đơn chức có CTTQ là CnH2nO2.
(b) Đúng. Một hợp chất hữu cơ chứa 3 nguyên tố C, H, O có CTTQ là CnH2n+2-2kOm.
(là một số chẵn).
(c) Sai. Điamin có số nguyên tử H chẵn.
(d) Sai. Dung dịch fructozơ bị khử bởi H2 (xúc tác Ni, t°) tạo ra sobitol.
(e) Đúng.
(f) Đúng. Este no, có 2 chức –COO– và 1 vòng nên độ bội liên kết công thức dạng CnH2n-4O4.
(g) Sai. Đa số các polime không tan trong các dung môi hữu cơ như benzen, ete, xăng
(h) Sai. Các amino axit là các chất rắn, có nhiệt độ sôi cao.
(i) Đúng. Anilin có tên thay thế là phenylamin.
(k) Sai. Đường mạch nha đều có thành phần chính là maltozơ.
Câu 24. Chọn đáp án D

Câu 25. Chọn đáp án B

Câu 26. Chọn đáp án B
Câu 27. Chọn đáp án B
Câu 28. Chọn đáp án B
Nhúng thanh catot vào dung dịch HCl thấy khí thoát ra nên thanh catot chứa Fe./p>
Cho AgNO3 dư vào dung dịch sau điện phân thu được kết tủa nên Fe2+ và Cl- còn dư.
| Catot: Fe3+ + e → Fe2+ Cu2+ + 2e → Cu Fe2+ + 2e → Fe |
Anot: 2Cl– → Cl2 + 2e |
Đặt số mol FeCl3, CuCl2 trong X là x, số mol Fe2+ dư là y.
Câu 29. Chọn đáp án C
Câu 30. Chọn đáp án B
Câu 31. Chọn đáp án B
0,15 mol Z + Na → 0,15 mol H2
⇒ Z là ancol 2 chức.
mbình tăng = mz-mH2 = 11,1 g
⇒ mz = 11,1+2.0,15 = 11,4 g
⇒ Y là axit no, đơn chức, mạch hở.
0,05 mol E + 0,24 mol O2 → 0,21 mol CO2 + 0,2 mol H2O.
Đặt số mol của X, Y, Z trong E lần lượt là x, y, z.
Câu 32. Chọn đáp án B
Số H của X, Y = 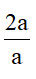
F + O2 → 0,26 mol CO2 + 0,44 mol H2O
⇒ nF = nH2O - nCO2 mol
Số C trung bình của F = 
⇒ 2 ancol là CH3OH và C2H5OH
Kết hợp với số mol 2 ancol ta có E gồm:
CH3OOC-COOC2H5: 0,08 mol
HCOOCH3: 0,02 mol
HCOOH: 0,04 mol
(COOH)2: 0,01 mol
Câu 33. Chọn đáp án C
(1) Zn + 2AgNO3 → Zn(NO3)2 + 2Ag
(2) Fe + Fe2(SO4)3 → 3FeSO4
(3) 2Na + 2H2O → 2NaOH + H2
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
(4) CO + CuO 
(5) 2H2O → 2H2 + O2
(6) 2Fe2(SO4)3 + 2H2O 
2FeSO4 + 2H2O 
2H2O → 2H2 + O2
(7) 2Na + 2H2O → 2NaOH + H2
2NaOH + MgSO4 → Na2SO4 + Mg(OH)2
(8) Hg(NO3)2 
(9) AgNO3 
(10) 3H2 + Cr2O3 
(11) H2S + 2AgNO3 → Ag2S + 2HNO3
(12) Zn + 2CrCl3 → ZnCl2 + 2CrCl2
Zn + CrCl2 → ZnCl2 + Cr
Có tất cả 7 phản ứng tạo thành kim loại.
Câu 34. Chọn đáp án D


Câu 35. Chọn đáp án A
Câu 36. Chọn đáp án A
Đặt nCuO = nNaOH = a mol,nHCl= 2b mol,nH2SO4 = b mol
Bảo toàn điện tích dung dịch Y: 2a + a = 2b + b (1)
Cho Fe vào Z thu được hỗn hợp 2 kim loại nên Fe còn dư, dung dịch Z chứa Cu2+ dư. Khối lượng kim loại giảm nên Z chứa H+.
| Catot: Cu2+ + 2e → Cu | Anot: 2Cl- → Cl2 + 2e 2H2O → 4H+ + O2 + 4e |
Đặt số mol Cu2+ đã bị điện phân là x
Câu 37. Chọn đáp án A
Câu 38. Chọn đáp án B

Câu 39. Chọn đáp án A

Câu 40. Chọn đáp án C
Ta có:
Sản phẩm sau hiđro hóa gồm các este no, tác dụng với NaOH chỉ chứa 2 muối và hỗn hợp F gồm 2 ancol có cùng số cacbon
⇒ 2 ancol chỉ có thể là
C2H5OH: a mol; C2H4(OH)2: b mol
Hỗn hợp H gồm este đơn chức (x mol) và este hai chức (y mol)
⇒ X là este đơn chức; Y là este đơn chức và Z là este hai chức: nz = 0,01 mol
Ta có:
Trong phản ứng hiđro hóa:nπ → R chỉ có thể chứa tối đa 2 liên kết π
Nếu R chỉ chứa 1 liên kết π → u=0,03; v=0,02 → R = C2H3 → %my = 35,5%
Kiến thức cần nhớ
Trong phản ứng cháy của hợp chất hữu cơ bất kì:
- Mối quan hệ: nCO2 - nH2O + nN2 = nπ - nX
- Bảo toàn electron: (4.C + H – 2.O).nX = 4nO2
- Bảo toàn liên kết π: k.nX = nH2(p-) + nBr2(p-)