Tailieumoi.vn giới thiệu Giải sách bài tập Hoá học lớp 12 Bài 37: Luyện tập: Tính chất hoá học của sắt và hợp chất của sắt chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 12. Mời các bạn đón xem:
Bài giảng Hóa học 12 Bài 37: Luyện tập: Tính chất hóa học của sắt và hợp chất của sắt
Giải SBT Hoá học 12 Bài 37: Luyện tập: Tính chất hoá học của sắt và hợp chất của sắt
Bài 37.1 trang 90 SBT Hoá học 12: Để bảo quản dung dịch FeSO4 trong phòng thí nghiêm, người ta ngâm vào dung dịch đó một đinh sắt đã làm sạch. Chọn cách giải thích đúng cho việc làm trên.
A. Để Fe tác dụng hết với H2SƠ4 dư khi điều chế FeSO4 bằng phản ứng :
Fe + H2SO4(loãng) → FeSO4 + H2↑
B. Để Fe tác dụng với các tạp chất trong dung dịch, chẳng hạn với tạp chất là CuSO4 :
Fe + CuSO4 → FeSO4 + Cu
C. Để sắt tác dụng hết O2 hoà tan :
2Fe + O2 → 2FeO
D. Để sắt khử muối sắt(III) thành muối sắt(II) :
Fe + Fe2(SO4)3 → 3FeSO4
Phương pháp giải:
Dựa vào lí thuyết về sắt và hợp chất của sắt
Lời giải:
Để bảo quản dung dịch FeSO4 trong phòng thí nghiệm, người ta ngâm vào dung dịch đó một đinh sắt đã làm sạch, để khử muối sắt (III) thành muối sắt (II)
Fe + Fe2(SO4)3 3FeSO4
Chọn D.
Bài 37.2 trang 90 SBT Hoá học 12: Cho hai phương trình hoá học sau :
Cu + 2FeCl3 → 2FeCl2 + CuCl2
Fe + CuCl2 → FeCl2 + Cu
Có thể rút ra kết luận nào sau đây
A. Tính oxi hoá : Fe3+ > Cu2> Fe2+.
B. Tính oxi hoá : Fe2+ > Cu2+ > Fe3+.
C. Tính khử : Fe > Fe2+ > Cu.
D. Tính khử : Fe2+ > Fe > Cu.
Phương pháp giải:
Chất khử mạnh phản ứng với chất oxi hóa mạnh tạo thành chất oxi hóa yếu hơn và tính khử yếu hơn
Lời giải:
Tính oxi hóa của Fe3+ > Cu2+ > Fe2+
Chọn A.
Bài 37.3 trang 91 SBT Hoá học 12: Nhúng thanh sắt (đã đánh sạch) vào các dung dịch ở ba thí nghiệm sau :
Thí nghiệm 1 : nhúng vào dung dịch CuSO4.
Thí nghiệm 2 :- nhúng vào dung dịch NaOH.
Thí nghiệm 3 : nhúng vào dung dịch Fe2(SO4)3.
Giả sử rằng các kim loại sinh ra (nếu có) đều bám vào thanh sắt thì nhận xét nào sau đây đúng ?
A. Ở thí nghiệm 1, khối lượng thanh sắt giảm.
B. Ở thí nghiệm 2, khối lượng thanh sắt không đổi.
C. Ớ thí nghiệm 3, khối lượng thanh sắt không đổi.
D. A, B, C đều đúng.
Phương pháp giải:
Dựa vào lí thuyết về sắt và hợp chất của sắt
Lời giải:
Thí nghiệm 1: Fe + CuSO4 FeSO4 + Cu
Do nguyên tử khối của Cu lớn hơn nguyên tử khối của Fe nên khối lượng thanh sắt tăng
Thí nghiệm 2: Không có phản ứng nên khối lượng thanh sắt không đổi
Thí nghiệm 3: Fe + Fe2(SO4)3 3FeSO4
Do Fe bị hòa tan trong dung dịch Fe2(SO4)3 nên khối lượng thanh sắt giảm
Chọn B.
Bài 37.4 trang 91 SBT Hoá học 12: Cho khí CO khử hoàn toàn 10 g quặng hematit. Lượng sắt thu được cho tác dụng hết với dung dịch H2SO4 loãng thu được 2,24 lít H2 (đktc). Phần trăm khối lượng của Fe2O3 trong quặng là
A. 70%. B. 75%.
C. 80%. D. 85%.
Phương pháp giải:
Từ số mol H2, suy ra số mol Fe sinh ra, suy ra số mol Fe2O3 có trong quặng.
Từ đó tính được khối lượng Fe2O3 và thành phần % khối lượng Fe2O3 trong quặng
Lời giải:
Từ (1) và (2)
Chọn C.
Bài 37.5 trang 91 SBT Hoá học 12: Cho 6,72 gam Fe vào dung dịch chứa 0,3 mol H2SO4 đặc, nóng (giả thiết S02 là sản phẩm khử duy nhất). Sau khi phản ứng xảy ra hoàn toàn, thu được
A. 0,03 mol Fe2(SO4)3 và 0,06 mol FeSO4
B. 0,05 mol Fe2(SO4)3 0,02 mol Fe dư.
C. 0,02 mol Fe2(SO4)3 và 0,08 mol FeSO4.
D. 0,12 mol FeSO4.
Phương pháp giải:
Viết phương trình và tính toán theo phương trình phản ứng
Lời giải:
Sử dụng phương trình cho – nhận e và phương trình bán phản ứng ta có:
Fe dư: 0,02 mol
Vậy muối thu được gồm:
Chọn A.
Bài 37.6 trang 91 SBT Hoá học 12: Cho khí CO khử hoàn toàn đến Fe một hỗn hợp gồm : FeO, Fe2O3, Fe3O4 thấy có 4,48 lít CO2 (đktc) thoát ra. Thể tích CO (đktc) đã tham gia phản ứng là
A. 1,12 lít. B. 2,24 lít.
C. 3,36 lít. D. 4,48 lít.
Phương pháp giải:
Bảo toàn nguyên tố C suy ra số mol CO phản ứng, tính được thể tích khí CO tham gia phản ứng.
Lời giải:
Số mol CO phản ứng = số mol CO2 sinh ra
Chọn D.
Bài 37.7 trang 91 SBT Hoá học 12: Cho 11,36 gam hỗn hợp gồm Fe, FeO, Fe2O3 và Fe3O4 phản ứng hết với dung dịch HNO3 loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất, ở đktc) và dung dịch X. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 43,076 B. 34,076
C. 43,706 D. 34,706
Phương pháp giải:
Quy đổi hỗn hợp về Fe (x mol) và O (y mol)
Lập phương trình khối lượng hỗn hợp
Lập phương trình bảo toàn electron
Giải hệ phương trình tìm ra số mol Fe và O
Bảo toàn nguyên tố Fe, tìm ra số mol muối, từ đó tính khối lượng muối
Lời giải:
Quy đổi hỗn hợp về Fe (x mol) và O (y mol)
56x + 16y = 11,36
Quá trình trao đổi electron:
Fe Fe3+ + 3e O + 2e O-2
N+5 + 3e N+2
Áp dụng bảo toàn electron: (2)
Từ (1) và (2) x = 0,16; y = 0,15
Bảo toàn nguyên tố Fe:
Bài 37.8 trang 92 SBT Hoá học 12: Thực hiện những biến đổi hoá học trong sơ đồ sau bằng cách viết phương trình hoá học của các phản ứng và nêu điều kiện của phản ứng (nếu có).
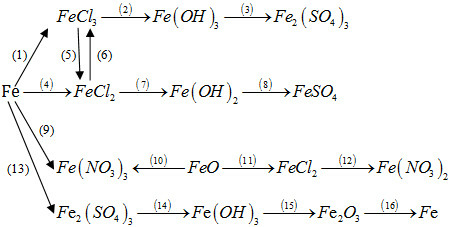
Phương pháp giải:
Dựa vào lý thuyết của sắt và hợp chất.
Lời giải:
(2) FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
(3) 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
(4) Fe + 2HCl → FeCl2 + H2
(5) 2FeCl3 + Fe → 3FeCl2
(6) 2FeCl2 + Cl2 → 2FeCl3
(7) FeCl2 + 2NaOH → Fe(OH)2 + 2NaCl
(8) Fe(OH)2 + H2SO4 → FeSO4 + 2H2O
(9) Fe + 4HNO3 → Fe(NO3)3 + NO + 2H2O
(10) FeO + 4HNO3 → Fe(NO3)3 + NO2 + 2H2O
(11) FeO + 2HCl → FeCl2 + H2O
(12) FeCl2 + 2AgNO3→ Fe(NO3)2 + 2AgCl↓
(13) 2Fe + 6H2SO4 (đ) → Fe2(SO4)3 + 3SO2 +6H2O
(14) Fe2(SO4)3 + 6NaOH → 2Fe(OH)3↓ + 3Na2SO4
Bài 37.9 trang 92 SBT Hoá học 12: Dung dịch A có chứa CuSO4 và Fe2(SO4)3
a) Thêm Mg vào dung dịch A→ dung dịch B có 3 muối tan.
b) Thêm Mg vào dung dịch A → dung dịch C có 2 muối tan.
Viết PTHH của các phản ứng xảy ra.
Lời giải:
a) Mg +Fe2(SO4)3 → MgSO4 + 2FeSO4 (1)
Mg + CuSO4→ MgS04 + Cu (2)
Dung dịch B có 3 muối là MgSO4, FeSO4 và CuSO4 dư.
b) Dung dịch C có 2 muối tan là MgSO4 và FeSO4.
Bài 37.10 trang 92 SBT Hoá học 12: Muốn có đủ khí clo để tác dụng với 1,12 g Fe cần phải dùng bao nhiêu gam K2Cr2O7 và bao nhiêu mililít dung dịch HCl 36,5% (D = 1,19 g/ml)
Phương pháp giải:
Tính số mol Fe, suy ra số mol khí clo cần dùng
từ số mol khí clo tính được số mol HCl và K2Cr2O7
n Fe= 1,12: 56= 0,04 mol
Các phản ứng xảy ra:
K2Cr2O7 + 14HCl → 2KCl + 2CrCl3 + 3Cl2 + 7H2O (1)
2Fe + 3Cl2 → 2FeCl3 (2)
Theo pt (2) ta có :
Theo pt (1) ta có :
.
Bài 37.11 trang 92 SBT Hoá học 12: Hỗn hợp A gồm Fe và kim loại M có hoá trị không đổi trong mọi hợp chất, M đứng trước hiđro trong dãy điện hoá. Tỉ lệ số mol của M và Fe trong hỗn hợp A là 1 : 2. Cho 13,9 g hỗn hợp A tác dụng với khí Cl2 thì cần dùng 10,08 lít Cl2. Cho 13,9 g hỗn hợp A tác dụng với dung dịch HCl thì thu được 7,84 lít H2. Các thể tích khí đều đo ở đktc. Xác định kim loại M và % khối lượng của mỗi kim loại trong hỗn hợp A.
Phương pháp giải:
Gọi số mol của Fe và M là x và 2x
Lập phương trình số mol khí H2
Lập phương trình số mol khí Cl2
Giải hệ phương trình suy ra x và n
Tính khối lượng của Fe, suy ra khối lượng của M
Tìm được nguyên tử khối của M, kết luận.
Lời giải:
2M + 2nHCl → MCln + n H2
x 0,5nx(mol)
Fe + 2HCl → FeCl2 + H2
2x 2x (mol)
(1)
2M + nCl2 → 2MCln
x 0,5nx(mol)
2Fe + 3Cl2 → 2FeCl3
2x 3x (mol)
Từ (1) và (2) → n= 3, x= 0,1
mFe= 2.0,1.56= 11,2 g ; m M= 13,9-11,2= 2,7g
→M M= 2,7:0,1=27 → M là Al
Bài 37.12 trang 92 SBT Hoá học 12: Cho luồng khí CO dư đi qua ống sứ đựng m gam hỗn hợp FeO và Fe2O3 nung nóng. Sau khi kết thúc phản ứng, khối lượng chất rắn trong ống sứ là 5,5 gam. Cho khí đi ra khỏi ống sứ hấp thụ vào nước vôi trong dư thấy có 5 gam kết tủa. Xác định giá trị của m.
Phương pháp giải:
Nhận xét: Cứ 1 mol CO phản ứng sinh ra 1 mol CO2 thì khối lượng chất rắn giảm 16 gam.
Mà số mol CO2 bằng số mol CaCO3, suy ra khối lượng chất rắn giảm
Từ đó tính được khối lượng oxit sắt ban đầu.
Lời giải:
Ta có sơ đồ phản ứng :
Nhận thấy, cứ 1 mol CO phản ứng sinh ra 1 mol CO2 thì khối lượng chất rắn giảm 16 gam
Mặt khác ta có : n CO2 =nCaCO3 =0,05 mol ⟹ khối lượng rắn giảm = 0,05.16 = 0,8 (gam)
⟹ khối lượng hỗn hợp oxit sắt ban đầu là : m = 5,5 + 0,8 = 6,3 (gam).
Bài 37.13 trang 92 SBT Hoá học 12: Cho 18,5 gam hỗn hợp X gồm Fe, Fe304 tác dụng với 200 ml dung dịch HNO3 loãng đun nóng và khuấy đều. Sau khi phản ứng xảy ra hoàn toàn được 2,24 lít khí NO duy nhất (đktc), dung dịch Y và còn lại 1,46 gam kim loại. Xác định khối lượng muối trong Y và nồng độ mol của dung dịch HNO3.
Phương pháp giải:
Gọi x và y là số mol Fe và Fe3O4 phản ứng
Lập phương trình tổng khối lượng Fe và Fe3O4 phản ứng
Bảo toàn e cho phản ứng
Giải hệ, suy ra số mol Fe(NO3)3
Bảo toàn N tìm được số mol HNO3
Lời giải:
Sau phản ứng kim loại còn dư, vậy Fe chỉ bị oxi hoá lên Fe2+
Gọi x, y là số mol Fe và Fe3O4 phản ứng, khối lượng rắn phản ứng là
18,5- 1,46= 17,04 (gam).
⟹ 56x + 232y = 17,04 gam (1)
Ta có phương trình cho - nhận e :
Fe → Fe2+ + 2e Fe304 + 2e → 3Fe +2
x → x → 2x mol y → 2y → 3y (mol)
N+5+ 3e → N+2
0,3 ← 0,1 (mol)
Áp dụng ĐLBTĐT, ta có : 2x = 2y + 0,3 (2)
Từ (1) và (2), giải hệ ta có : x = 0,18; y = 0,03
Vậy muối thu được là Fe(NO3)2 : (x + 3y) = 0,27 mol ⟹ m = 48,6 g
Số mol HNO3 phản ứng = 2.nFe(NO3 )2 +nN0 = 2.0,27 + 0,1 = 0,64 mol
⟹ CM(HNO3) = 3,2 (M).
Bài 37.14 trang 92 SBT Hoá học 12: Hoà tan hoàn toàn 10 gam hỗn hợp X (Fe, Fe2O3) trong dung dịch HNO3 vừa đủ được 1,12 lít NO (đktc, sản phẩm khử duy nhất) và dung dịch Y. Cho Y tác dụng với NaOH dư được kết tủa Z. Nung Z trong không khí đến khối lượng không đổi được m gam chất rắn. Xác định giá trị của m.
Phương pháp giải:
Từ số mol NO tìm được số mol Fe, tính số mol Fe và suy ra số mol Fe2O3 do Fe sinh ra
Tính khối lượng Fe2O3 ban đầu trong hỗn hợp
Suy ra giá trị m
Lời giải:
Ta có sơ đồ phản ứng:
Vì chỉ có Fe phản ứng sinh ra khí NO, sử dụng phương trình cho - nhận e
⟹ nFe =nNO =0,05-mol.
m Fe ban đầu =0,05.56 = 2,8(gam) ⟹ m Fe2O3 sau = 160.0,025 = 4(gam)
ban đầu = 10 - 2,8 = 7,2 (gam)
Vậy m = 4 + 7,2 =11,2 (gam).