Tailieumoi.vn giới thiệu Giải sách bài tập Hoá học lớp 12 Bài 26: Kim loại kiềm thổ chi tiết giúp học sinh xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hoá học 12. Mời các bạn đón xem:
Bài giảng Hóa học 12 Bài 26: Kim loại kiềm thổ và hợp chất quan trọng của chúng
Giải SBT Hoá học 12 Bài 26: Kim loại kiềm thổ
Bài 26.1 trang 57 SBT Hoá học 12: Ở trạng thái cơ bản, nguyên tử kim loại kiềm thổ có số electron hoá trị là
A. 1e. B. 2e.
C. 3e. D. 4e.
Phương pháp giải:
Dựa vào lý thuyết về các kim loại kiềm thổ
Lời giải:
Ở trạng thái cơ bản, nguyên tử kim loại kiềm thổ có số electron hóa trị là 2 electron.
Chọn B.
Bài 26.2 trang 57 SBT Hoá học 12: Chỉ dùng thêm thuốc thử nào cho dưới đây có thể nhận biết được 3 lọ mất nhãn chứa các dung dịch : H2SO4, BaCl2, Na2SO4 ?
A. Quỳ tím.
B. Bột kẽm.
C. Na2CO3.
D. Quỳ tím hoặc bột kẽm hoặc Na2CO3.
Phương pháp giải:
Thử với từng loại thuốc thử, thấy dùng quỳ tím, bột kẽm hoặc Na2CO3 đều nhận biết được 3 dung dịch H2SO4, BaCl2, Na2SO4
Lời giải:
1. Dùng thuốc thử là quỳ tím
+ Quỳ tím chuyển sang màu đỏ: H2SO4
+ Không có hiện tượng: BaCl2, Na2SO4
- Cho dung dịch H2SO4 đã nhận biết được vào 2 dung dịch chưa nhận biết được
+ Xuất hiện kết tủa trắng: BaCl2
+ Không có hiện tượng: Na2SO4
H2SO4 + BaCl2 BaSO4 + 2HCl
2. Dùng thuốc thử là bột kẽm
+ Xuất hiện khí không màu thoát ra: H2SO4
Zn + H2SO4 ZnSO4 + H2
+ Không có hiện tượng: BaCl2, Na2SO4
- Cho dung dịch H2SO4 đã nhận biết được vào 2 dung dịch chưa nhận biết được
+ Xuất hiện kết tủa trắng: BaCl2
H2SO4 + BaCl2 BaSO4 + 2HCl
+ Không có hiện tượng: Na2SO4
3. Dùng thuốc thử là Na2CO3
+ Xuất hiện khí không màu thoát ra: H2SO4
Na2CO3 + H2SO4 Na2SO4 + CO2 + H2O
+ Xuất hiện kết tủa trắng: BaCl2
Na2CO3 + BaCl2 BaCO3 + 2NaCl
+ Không có hiện tượng: Na2SO4
Chọn D.
Bài 26.3 trang 57 SBT Hoá học 12: Cho các chất : Ca, Ca(OH)2, CaCO3, CaO. Dựa vào mối quan hệ giữa các hợp chất vô cơ, dãy biến đổi nào sau đây có thể thực hiện được ?
A. Ca → CaCO3 → Ca(OH)2 → CaO
B. Ca → CaO → Ca(OH)2 → CaCO3
C. CaCO3 → Ca → CaO → Ca(OH)2
D. CaCO3 →Ca(OH)2 → Ca→ CaO
Phương pháp giải:
Dựa vào mối quan hệ giữa các hợp chất
Lời giải:
2Ca + O2 2CaO
CaO + H2O Ca(OH)2
Ca(OH)2 + Na2CO3 CaCO3 + 2NaOH
Chọn B
Bài 26.4 trang 57 SBT Hoá học 12: Có thể dùng chất nào sau đây để làm mềm nước có tính cứng tạm thời ?
A. NaCl B. H2SO4
C. Na2CO3 D. KNO3
Phương pháp giải:
Dựa vào lý thuyết về nước cứng.
Lời giải:
Để làm mềm nước cứng tạm thời, ta sử dụng Na2CO3
Chọn C.
Bài 26.5 trang 57 SBT Hoá học 12: Anion gốc axit nào sau đây có thể làm mềm nước cứng ?
A. NO3- B. SO4 2-
C. CIO4- D. PO4 3-
Phương pháp giải:
Để làm mềm nước cứng, ta loại bỏ ion Ca2+ và Mg2+ bằng cách tạo kết tủa với các ion này
Lời giải:
Anion làm mềm nước cứng là
Chọn D.
Bài 26.6 trang 57 SBT Hoá học 12: Trong một dung dịch có a mol Ca2+, b mol Mg2+, c mol Cl- , d mol . Biểu thức liên hệ giữa a, b, c, d là
A. a + b = c + d. B. 2a + 2b = c + d.
C. 3a + 3b = c + d D. 2a + c = b + d
Phương pháp giải:
Áp dụng phương pháp bảo toàn điện tích
Lời giải:
Áp dụng phương pháp bảo toàn điện tích:
Chọn B.
Bài 26.7 trang 58 SBT Hoá học 12: Trong nước tự nhiên thường có lẫn một lượng nhỏ các muối Ca(NO3)2, Mg(NO3)2, Ca(HCO3)2, Mg(HCO3)2. Có thể dùng dung dịch nào sau đây để loại đồng thời các cation trong các muối trên ra khỏi nước ?
A. Dung dịch NaOH
B. Dung dịch K2SO4
C. Dung dịch Na2CO3
D. Dung dịch NaNO3
Phương pháp giải:
Sử dụng chất có thể tạo kết tủa với các cation Ca2+ và Mg2+
Lời giải:
Dùng dung dịch Na2CO3 có thể tách các cation Ca2+ và Mg2+ ra khỏi nước
Ca(NO3)2 + Na2CO3 CaCO3 + 2NaNO3
Mg(NO3)2 + Na2CO3 MgCO3 + 2NaNO3
Ca(HCO3)2 + Na2CO3 CaCO3 + 2NaHCO3
Mg(HCO3)2 + Na2CO3 MgCO3 + 2NaHCO3
Chọn C.
Bài 26.8 trang 58 SBT Hoá học 12: Có thể loại bỏ tính cứng tạm thời của nước bằng cách đun sôi vì lí do nào sau đây ?
A. Nước sôi ở nhiệt độ cao (ở 100°c, áp suất khí quyển).
B. Khi đun sôi đã làm tăng độ tan của các chất kết tủa.
C. Khi đun sôi các chất khí hoà tan trong nước thoát ra.
D. Các muối hiđrocacbonat của canxi và magie bị phân huỷ bởi nhiệt để tạo kết tủa.
Phương pháp giải:
Dựa vào phương trình phản ứng nhiệt phân muối hiđrocacbonat
Lời giải:
Muối hiđrocacbonat của canxi và magie bị phân hủy bởi nhiệt để tạo kết tủa theo phương trình phản ứng:
Từ đó loại được ion Ca2+ và Mg2+ra khỏi dung dịch.
Chọn D.
Bài 26.9 trang 58 SBT Hoá học 12: Để oxi hoá hoàn toàn một kim loại M hoá trị II thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. Kim loại M là
A. Zn. B. Mg.
C. Ca. D. Ba.
Phương pháp giải:
Gọi công thức của oxit là MO
Khối lượng oxi bằng 40% khối lượng của M nên
Kim loại M
Lời giải:
Gọi công thức của oxit là MO
Vì khối lượng oxi bằng 40% khối lượng của M nên
Kim loại là Ca
Chọn C.
Bài 26.10 trang 58 SBT Hoá học 12: Nung hỗn hợp muối cacbonat của hai kim loại kế tiếp nhau trong nhóm IIA tới khối lượng không đổi thu được 2,24 lít CO2 (đktc) và 4,64 g hỗn hợp hai oxit. Hai kim loại đó là
A. Mg và Ca. B. Be và Mg.
C. Ca và Sr D. Sr và Ba.
Phương pháp giải:
Gọi công thức chung của 2 muối cacbonat là
Từ số mol của CO2, suy ra số mol 2 oxit. Từ đó tìm được
Kết luận 2 kim loại
Lời giải:
Gọi công thức chung của 2 muối cacbonat là
M1 < 30,4 M1 là Mg (MMg = 24 g/mol)
M2 > 30,4 M2 là Ca (MCa = 40 g/mol)
Chọn A.
Bài 26.11 trang 59 SBT Hoá học 12: Để trung hoà dung dịch hỗn hợp X chứa 0,1 mol NaOH và 0,15 mol Ba(OH)2 cần bao nhiêu lít dung dịch hỗn hợp Y chứa HCl 0,1M và H2SO4 0,05M ?
A. 1 lít B. 2 lít
C. 3 lít D. 4 lít
Phương pháp giải:
Mà
Vdd axit
Lời giải:
Dung dịch X có:
1 lít dung dịch Y có:
Chọn B.
Bài 26.12 trang 59 SBT Hoá học 12: Cho hỗn hợp 2 muối cacbonat của kim loại hoá trị II trong dung dịch HCl dư thu được 6,72 lít khí (đktc). Cô cạn dung dịch sau phản ứng thấy khối lượng muối khan thu được nhiều hơn khối lượng hai muối cacbonat ban đầu là
A. 3,0 g. B. 3,1 g.
C. 3,2 g. D. 3,3 g.
Phương pháp giải:
khối lượng tăng 11g
Vậy
Khối lượng tăng
Lời giải:
khối lượng tăng 11g
Vậy
⟹ Khối lượng tăng là 0,3. 11 = 3,3 (g)
Chọn D.
Bài 26.13 trang 59 SBT Hoá học 12: Cho a gam hỗn hợp BaCO3 và CaCO3 tác dụng hết với V lít dung dịch HCl 0,4M thấy giải phóng 4,48 lít CO2 (đktc), dẫn khí thu được vào dung dịch Ca(OH)2 dư.
a) Khối lượng kết tủa thu được là
A. 10 g. B. 15 g
C. 20 g D. 25 g.
b) Thể tích dung dịch HCl cần dùng là
A. 1,0 lít. B. 1,5 lít.
C. 1,6 lít. D. 1,7 lít.
c) Giá trị của a nằm trong khoảng nào dưới đây ?
A. 10 g < a < 20 g B. 20 g < a < 35,4 g
C. 20 g < a < 39,4 g D. 20 g < a < 40 g
Phương pháp giải:
a. Từ phương trình, suy ra số mol của CaCO3
Từ đó tính được khối lượng kết tủa.
b. Dựa vào 2 PTHH, nhận xét mối quan hệ về số mol giữa HCl và CO2
Từ đó tính được thể tích dung dịch HCl.
c. Giả sử hỗn hợp ban đầu chỉ có BaCO3, tính ra giá trị lớn nhất của a
Giả sử hỗn hợp ban đầu chỉ có CaCO3, tính ra giá trị nhỏ nhất của a
Lời giải:
a. PTHH:
Chọn C.
b. PTHH:
Nhận xét: Từ PTHH ta thấy
Chọn A.
c. Giả sử hỗn hợp ban đầu chỉ có BaCO3
Giả sử hỗn hợp ban đầu chỉ có CaCO3
Thực tế, hỗn hợp ban đầu chứa cả BaCO3 và CaCO3 nên giá trị của a nằm trong khoảng 20 gam < a < 39,4 gam
Chọn C.
Bài 26.14 trang 59 SBT Hoá học 12: Trong một cốc nước có chứa 0,03 mol Na+; 0,01 mol Ca2+; 0,01 mol
Mg2+, 0,04 mol ; 0,01 mol Cl-; 0,01 mol . Nước trong cốc thuộc loại
A. nước cứng tạm thời.
B. nước cứng vĩnh cửu.
C. nước cứng toàn phần.
D. nước mềm.
Lời giải:
Nước trong cốc chứa các anion nên nước trong cốc là nước cứng toàn phần.
Chọn C.
Bài 26.15 trang 60 SBT Hoá học 12: Trong một cốc nước chứa 0,02 mol Ca2+ ; 0,01 mol Mg2+ ; 0,04 mol HCO3- ; 0,02 mol Cl-. Nước trong cốc thuộc loại
A. nước cứng tạm thời
B. nước cứng vĩnh cửu.
C. nước cứng toàn phần
D. nước mềm.
Lời giải:
Do nước chứa các anion nên nước trong cốc là nước cứng toàn phần.
Chọn C.
Bài 26.16 trang 60 SBT Hoá học 12: Trong các phương pháp sau, phương pháp chỉ khử được tính cứng tạm thời của nước là
A. phương pháp hoá học (sử dụng Na2CO3, Na3PO4).
B. phương pháp nhiệt (đun sôi)
C. phương pháp lọc.
D. phương pháp trao đổi ion.
Lời giải:
Phương pháp chỉ khử được tính cứng tạm thời của nước là phương pháp nhiệt (đun sôi).
Chọn B.
Bài 26.17 trang 60 SBT Hoá học 12: Vì sao tính chất vật lí của kim loại nhóm IIA không biến đổi theo một quy luật nhất định ?
Lời giải:
Sự biến đổi không theo quy luật do kim loại nhóm IIA có những kiểu mạng tinh thể khác nhau : mạng lục phương (Be, Mg) ; mạng lập phương tâm diện (Ca, Sr) ; mạng lập phương tâm khối (Ba).
Bài 26.18 trang 60 SBT Hoá học 12: So sánh kim loại Mg và Ca về các mặt:
a) Cấu hình electron của nguyên tử.
b) Tác dụng với nước.
c) Phương pháp điều chế các đơn chất.
Lời giải:
a) Cấu hình electron : Mg : [Ne]3s2; Ca : [Ar]4s2
b) Tác dụng với nước : Ca tác dụng với nước ở điều kiện thường còn Mg không tác dụng.
c) Phương pháp điều chế : Cả Ca và Mg đều được điều chế bằng phương pháp điện phân nóng chảy hai muối MgCl2 và CaCl2.
Bài 26.19 trang 60 SBT Hoá học 12: Hãy dẫn ra những phản ứng để chứng tỏ rằng từ Be đến Ca, tính kim loại của các nguyên tố tăng dần.
Lời giải:
Phản ứng vớỉ nước :
- Be không tác dụng với nước ở nhiệt độ thường.
- Mg tác dụng chậm với nước nóng.
- Ca tác dụng với nước ở nhiệt độ thường
Tính chất của hiđroxit :
Be(OH)2 có tính lưỡng tính.
Mg(OH)2 là bazơ yếu.
Ca(OH)2 là bazơ mạnh.
Bài 26.20 trang 60 SBT Hoá học 12: Sục hỗn hợp khí CO2 và CO vào dung dịch Ca(OH)2 thấy có kết tủa. Lọc bỏ kết tủa, thu được dung dịch nước lọc. Đổ dung dịch NaOH vào nước lọc thấy xuất hiện kết tủa. Viết phương trình hoá học của các phản ứng xảy ra trong thí nghiệm trên.
Lời giải:
CO2 + Ca(OH)2 → CaCO3↓+ H2O (1)
CaCO3 + CO2 + H2O → Ca(HCO3)2 (2)
Ca(HCO3)2 + 2NaOH → CaCO3+ Na2CO3 + 2H2O (3).
Bài 26.21 trang 60 SBT Hoá học 12: Nước trong vùng có núi đá vôi thuộc loại nước cứng. Viết phương trình hoá học của các phản ứng mô tả sự tạo thành nước cứng.
Phương pháp giải:
Dựa vào thành phần của đá vôi và các điều kiện tự nhiên (như nước, không khí,...) để viết phương trình hóa học phù hợp.
Lời giải:
Trong thành phần của đá vôi có các hợp chất CaCO3, MgCO3. Nước mưa hoà tan khí CO2 trong không khí đã hoà tan dần các hợp chất CaCO3,MgCO3
Bài 26.22 trang 60 SBT Hoá học 12: Về mặt hoá học thì nước có tính cứng tạm thời và nước có tính cứng vĩnh cửu khác nhau ở điểm nào ?
Lời giải:
Khác nhau về thành phần anion của muối.
- Nước có tính cứng tạm thời chứa anion HCO3- khi đun nóng bị phân huỷ thành ion cacbonat làm kết tủa Ca2+ và Mg2+ .
- Nước có tính cứng vĩnh cửu chứa các anion SO42- và Cl-, khi đun nóng không làm kết tủa Ca2+ và Mg2+
Bài 26.23 trang 60 SBT Hoá học 12: Có 4 cốc đựng riêng biệt các loại nước : nước cất, nước có tính cứng tạm thời, nước có tính cứng vĩnh cửu và nước có tính cứng toàn phần. Hãy xác định loại nước đựng trong 4 cốc trên bằng phương pháp hoá học. Viết phương trình hoá học của các phản ứng đã dùng.
Phương pháp giải:
Đun sôi 4 dung dịch để chia các dung dịch thành 2 nhóm
Nhận biết mỗi chất trong mỗi nhóm bằng dung dịch Na2CO3.
Lời giải:
Đun sôi nước trong các cốc ta sẽ chia ra thành 2 nhóm :
(1) Không thấy vẩn đục là nước cất và nước có tính cứng vĩnh cửu.
(2) Thấy vẩn đục là nước có tính cứng tạm thời và nước có tính cứng toàn phần.
+ Thêm vài giọt dung dịch Na2CO3 vào mỗi cốc của nhóm (1). Nếu có kết tủa là nước có tính cứng vĩnh cửu, không có kết tủa là nước cất.
+ Lấy nước lọc của mỗi cốc ở nhóm (2) (sau khi đun sôi để nguội) cho thêm vài giọt dung dịch Na2CO3. Nếu có kết tủa là nước có tính cứng toàn phần, không có kết tủa là nước có tính cứng tạm thời.
Bài 26.24 trang 61 SBT Hoá học 12: Viết PTHH của các phản ứng trong sơ đồ biến hoá sau :
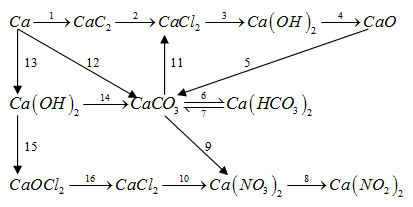
Phương pháp giải:
Dựa vào các tính chất, phản ứng đặc trưng của các hợp chất của canxi.
(1)
(2) CaC2 + 2HCl→ CaCl2 + C2H2
(5) CaO + CO2 → CaCO3
(6) CaCO3 + CO2 + H2O → Ca(HCO3)2
(8) Ca(NO3)2 → Ca(NO2)2 + O2
(9) CaCO3 + 2HNO3 → Ca(NO3)2 + CO2 + H2O
(10) CaCl2 + 2AgNO3 → Ca(NO3)2 + 2AgCl
(11) CaCO3 + 2HCl → CaCl2 + H2O + CO2
(12) Ca + CO2 + H2O → CaCO3 + H2
(13) Ca + 2H2O → Ca(OH)2 + H2
(14) Ca(OH)2 dư + CO2 → CaCO3 + H2O
(15) Ca(OH)2 + Cl2 → CaOCl2 + H2O
(16) CaOCl2 + 2HCl → CaCl2 + H2O + CO2
Hoặc
Bài 26.25 trang 61 SBT Hoá học 12: Viết phương trình phản ứng trong sơ đồ biến hóa sau:
Lời giải:
(1)
(2) 2Mg + O2 → 2MgO
(3) MgO + 2HNO3 → Mg(NO3)2 + H2O
(5) MgO + 2HCl → MgCl2 + H2O
(6) MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
(8) MgO + H2SO4 → MgSO4 + H2O
(9) MgSO4 + Na2CO3 → MgCO3 + Na2SO4
(10) MgCO3 + CO2 + H2O → Mg(HCO3)2
Bài 26.26 trang 61 SBT Hoá học 12: Hỗn hợp X chứa K2O, , NaHCO3 và BaCl2 có số mol mỗi chất đều bằng nhau. Cho hỗn hợp X vào nước dư, đun nóng thu được dung dịch Y. Xác định các ion có trong dung dịch Y.
Phương pháp giải:
Gọi số mol mỗi chất ban đầu là a mol
Viết các phương trình phản ứng của các chất với nước, các chất phản ứng với nhau, so sánh số mol để xét chất dư, chất hết
Lời giải:
Giả sử ban đầu mỗi chất đều là a mol.
Khi cho vào nước thì chỉ có K2O tác dụng với nước
K2O + H2O → 2KOH
a → 2a (mol)
KOH + NH4Cl → KCl + NH3 + H2O
a a (mol)
2KOH + 2NaHCO3 → K2CO3 + Na2CO3 + 2H2O
a a 0,5a 0,5a (mol)
CO3 2- + Ba 2+ → BaCO3
(0,5a + 0,5a) a
Vậy cuối cùng chỉ còn K+, Na+ và Cl-
Bài 26.27 trang 61 SBT Hoá học 12: Cho 8 g hỗn hợp gồm một kim loại kiềm thổ và oxit của nó tác dụng vừa đủ với 1 lít dung địch HCl 0,5M. Xác định kim loại kiềm thổ.
Phương pháp giải:
Gọi x và y là số mol của kim loại kiềm thổ X và oxit của nó XO
Lập phương trình khối lượng và phương trình số mol của hỗn hợp ban đầu
Giải hệ phương trình, tìm được nguyên tử khối của kim loại X
kết luận
Lời giải:
Gọi kim loại kiềm thổ là X (có khối lượng mol là M), oxit của nó là XO.
X + 2HCl → XCl2 + H2 (1)
XO + 2HCl → XCl2 + H2O (2)
Gọi x, y là số mol của kim loại kiềm thổ và oxit của nó. Số mol HCl tham gia phản ứng (1) và (2) là 0,5 mol.
Ta có hệ pt: Mx+ (M+16)y = 8
2x+2y = 0,5
Giải hệ phương trình ta được :
Biết 0 < x < 0,25, ta có : 0 < < 0,25
⟹ 0 < M - 16 < 16 => 16 < M < 32
Vậy kim loại kiềm thổ có nguyên tử khối bằng 24, đó là Mg.
Bài 26.28 trang 61 SBT Hoá học 12: Khi lấy 11,1 g muối clorua của một kim loại chỉ có hoá trị II và một lượng muối sunfat của kim loại đó có cùng số mol, thấy khác nhau 2,5 g. Xác định công thức hoá học của hai muối.
Phương pháp giải:
Đặt công thức của các muối là MCl2 và MSO4.
Gọi x là số mol mỗi muối. Theo đề bài ta tìm được giá trị của x
Từ đó tìm được khối lượng mol của M
kết luận công thức muối.
Lời giải:
Đặt công thức của các muối là MCl2 và MSO4.
Gọi x là số mol mỗi muối. Theo đề bài ta có .
(M + 96)x - (M + 71)x = 2,5 → x = 0,1 (mol)
Khối lượng mol của MCl2 là
Nguyên tử khối của M là 111 - 71 = 40 => M là Ca . Công thức các muối là CaCl2 và CaSO4.
Bài 26.29 trang 61 SBT Hoá học 12: Sục V lít khí CO2 (đktc) vào bình đựng 2 lít dung dịch Ca(OH)2 0,01M, thu được 1 g kết tủa. Xác định V
Phương pháp giải:
Trường hợp 1: Phản ứng chỉ tạo 1 gam kết tủa
Trường hợp 2: Phản ứng tạo ra nhiều hơn 1 gam kết tủa, sau đó tan bớt trong CO2 dư còn lại 1 gam
Lời giải:
Sục khí CO2 vào dung dịch Ca(OH)2 thu được 1 g kết tủa thì có 2 trường hợp xảy ra.
Trường hợp 1 : Phản ứng chỉ tạo ra 1 g kết tủa :
CO2 + Ca(OH)2 →CaCO3 + H2O (1)
0,01 =0,01 (mol)
Theo đề bài : nCa(OH)2 = 0,01.2 = 0,02 (mol). Vậy dư.
VCO2 = 22,4.0,01 = 0,224 (lít).
Trường hợp 2 : Phản ứng tạo ra nhiều hơn 1 g kết tủa, sau đó tan bớt trong CO2 dư còn lại 1 g.
CO2 + Ca(OH)2 →CaCO3+ H2O
0,02 0,02 0,02 (mol)
CaCO3 + CO2 + H2O → Ca(HCO3)2
0,01 0,01 (mol)
VCO2 = 22,4.(0,02 + 0,01) = 0,672 (lít).
Bài 26.30 trang 61 SBT Hoá học 12: Chỉ dùng nước và dung dịch HCl hãy trình bày cách nhận biết 4 chất rắn (đựng trong 4 lọ riêng biệt) : Na2CO3, CaCO3, Na2SO4, CaSO4.2H2O.
Phương pháp giải:
Hòa tan 4 chất rắn vào nước, chia nhóm chất tan và nhóm chất không tan
Sau đó cho dung dịch HCl tác dụng với các chất trong mỗi nhóm.
Lời giải:
Hoà vào nước ta được hai nhóm chất :
(1) Tan trong nước là Na2CO3 và Na2SO4. Phân biệt 2 chất này bằng dung dịch HCl. Tác dụng với dung dịch HCl là Na2CO3 (sủi bọt khí) ; không tác dụng với dung dịch HCl là Na2SO4.
(2) Không tan trong nước là CaCO3 và CaSO4.2H2O. Dùng dung dịch HCl để nhận ra CaCO3 (có sủi bọt khí) còn lại là CaSO4.2H2O.
Bài 26.31 trang 61 SBT Hoá học 12: Hoà tan 23,9 g hỗn hợp bột BaCO3 và MgCO3 trong nước cần 3,36 lít CO2 (đktc). Xác định khối lượng của mỗi muối trong hỗn hợp
Phương pháp giải:
Đặt số mol của BaCO3 và MgCO3 là x và y
Dựa vào đề bài, lập hệ phương trình và giải phương trình
Từ đó tính khối lượng mỗi muối
Lời giải:
BaCO3 + CO2 + H2O → Ba(HCO3)2 (1)
MgCO3 + CO2 +H2O →Mg(HCO3)2 (2)
Số mol CO2 đã cho là : 0,15 (mol)
Đặt x và y là số mol của BaCO3 và MgCO3 ta có hệ phương trình :
x + y =0,15
197x + 84y = 23,9
→x = 0,1 và y = 0,05
mBaCO3 = 197.0,1 = 19,7 (g)
mMgCO3 = 23,9 - 19,7 = 4,2 (g).