Với giải sách bài tập Hóa học 12 Bài 1: Ester – Lipid sách Kết nối tri thức hay, chi tiết giúp học sinh dễ dàng xem và so sánh lời giải từ đó biết cách làm bài tập trong SBT Hóa học 12. Mời các bạn đón xem:
Giải SBT Hóa học 12 Bài 1: Ester – Lipid
Câu 1.1 trang 7 Sách bài tập Hóa học 12: Có bao nhiêu ester có công thức phân tử là C4H8O2?
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Đáp án đúng là: C
Ứng với công thức phẩn tử C4H8O2 có 4 ester: HCOOCH2CH2CH3; HCOOCH(CH3)2; CH3COOC2H5; C2H5COOCH3.
Câu 1.2 trang 7 Sách bài tập Hóa học 12: Có bao nhiêu hợp chất hữu cơ đơn chức khác nhau có công thức phân tử là C3H6O2
A. 2.
B. 3.
C. 4.
D. 5.
Lời giải:
Đáp án đúng là: B
Có 3 chất thoả mãn: HCOOC2H5; CH3COOCH3; C2H5COOH.
Câu 1.3 trang 7 Sách bài tập Hóa học 12: Có 4 ester no, đơn chức, mạch hở được kí hiệu ngẫu nhiên lần lượt là X, Y, Z, T. Phân tử ester của mỗi chất nêu trên đều tạo bởi các carboxylic acid mạch không phân nhánh và ethyl alcohol. Độ tan của ester được cho ở bảng sau:
|
Ester |
X |
Y |
Z |
T |
|
Độ tan (g/100g nước) |
8,7 |
10,5 |
2,2 |
4,9 |
Trong 4 ester trên, ester có nhiều nguyên tử carbon nhất trong phân tử là
A. Y.
B. T.
C. X.
D. Z.
Lời giải:
Đáp án đúng là: D
Độ tan trong nước của ester giảm khi số nguyên tử C (khối lượng phân tử) tăng.
Độ tan trong nước của ester Z là nhỏ nhất nên Z có nhiều nguyên tử carbon nhất.
Câu 1.4 trang 7 Sách bài tập Hóa học 12: Cho 4 chất sau: butan - 1 - ol (1), butanoic acid (2), ethyl acetate (3) và pentan-2-ol (4). Chất có nhiệt độ sôi thấp nhất trong 4 chất trên là
A. (1).
B. (2).
C. (3).
D. (4).
Lời giải:
Đáp án đúng là: C
Ester có nhiệt độ sôi thấp hơn alcohol và carboxylic acid có cùng số nguyên tử C hoặc có phân tử khối tương đương.
Lại có: butan - 1 - ol (1) và pentan-2-ol (4) là alcohol; butanoic acid (2) là acid, chỉ có ethyl acetate (3) là ester.
Vậy ethyl acetate (3) có nhiệt độ sôi thấp nhất.
Câu 1.5 trang 8 Sách bài tập Hóa học 12: Tính chất nào sau đây không phải là tính chất thích hợp giúp ethyl methanoate (HCOOC2H5) được sử dụng trong sản xuất một số loại nước hoa?
A. Khả năng dễ cháy.
B. Có mùi thơm dễ chị
C. Không độc hại.
D. Nhiệt độ sôi thấp
Lời giải:
Đáp án đúng là: A
Khả năng dễ cháy không phải là tính chất thích hợp giúp ethyl methanoate (HCOOC2H5) được sử dụng trong sản xuất một số loại nước hoa
Câu 1.6 trang 8 Sách bài tập Hóa học 12: Ngoài sản phẩm phụ là nước, chất hữu cơ nào sau đây được hình thành từ phản ứng hóa học đã cho?
A.
B.
C.
D.
Lời giải:
Đáp án đúng là: C
CH3OH + CH3 – C6H4 – COOH ⇌ CH3 – C6H4 – COOCH3 + H2O
Câu 1.7 trang 8 Sách bài tập Hóa học 12: Aspirin là một trong những loại thuốc giảm đau, hạ sốt được sử dụng rộng rãi trên toàn thế giới. Aspirin có công thức cấu tạo như sau:
Trong điều kiện ẩm ướt, aspirin có thể bị thủy phân để tạo thành salicylic acid và acetic acid. Công thức cấu tạo nào sau đây là của salicylic acid?
Lời giải:
Đáp án đúng là: C
Phản ứng thuỷ phân aspirin:
Câu 1.8 trang 9 Sách bài tập Hóa học 12: Một nhóm học sinh đã thực hiện phản ứng điều chế ethyl acetate từ nguyên liệu ban đầu từ acetic acid và ethanol trong phòng thí nghiệm. Khi phản ứng kết thúc, nhóm đã thu được hỗn hợp sản phẩm gồm ethyl acetate và acetic acid, ethanol dư theo phương trình hóa học:
Vì ethyl acetate không phân cực, còn acetic acid và ethanol đều phân cực nên nhóm đã dùng dung môi hữu cơ không phân cực diethyl ether (C2H5OC2H5) để chiết ethyl acetate ra khỏi hỗn hợp sau phản ứng theo sơ đồ sau:
Cho các phát biểu sau về thí nghiệm của nhóm:
a) Diethyl ether là dung môi chiết lí tưởng trong thí nghiệm trên vì ethyl acetate tan tốt trong dung môi này, còn acetic acid và ethanol lại tan tốt trong dung môi nước.
b) Bằng phương pháp chưng cất đơn giản, ta có thể tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
c) Do diethyl ether có nhiệt độ sôi thấp hơn nhiều so với ethyl acetate (34,6 oC so với 77,1 oC) nên có thể thu được ethyl acetate sau khi chiết bằng cách dùng đèn cồn đun nhẹ cho dung môi diethyl ether bay hơi.
d) Để an toàn, ta có thể dùng nước nóng liên tục tưới lên bình cầu trong phương pháp chưng cất đơn giản để tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Lời giải:
Đáp án đúng là: C
Các phát biểu đúng là a), b) và d).
Giải thích:
- Dù diethyl ether có nhiệt độ sôi thấp hơn nhiều so với ethyl acetate nhưng không thể thu ethyl acetate sau khi chiết bằng cách dùng đèn cồn đun nhẹ cho dung môi diethyl ether bay hơi, do hơi diethyl ether đặc biệt dễ cháy, khi gặp ngọn lửa đèn cồn sẽ gây hoả hoạn, nguy hiểm.
- Cũng không nên sử dụng đèn cồn trong phương pháp chưng cất đơn giản để tách ethyl acetate ra khỏi dung môi diethyl ether sau khi chiết do diethyl ether có thể rò rỉ gây hoả hoạn. Có thể dùng bếp điện để đun cách thuỷ, nhưng an toàn nhất vẫn là dùng nước nóng tưới liên tục lên bình cầu chưng cất.
Câu 1.9 trang 10 Sách bài tập Hóa học 12: Bổ sung thông tin và hoàn thiện bảng theo mẫu trên. Nhiệt độ sôi của một số hợp chất hữu cơ được cho ở bảng dưới đây. Quan sát bảng dưới để trả lời các câu 1.9 và 1.10.
Lời giải:
Câu 1.10 trang 10 Sách bài tập Hóa học 12: Trình bày nhận xét và giải thích về nhiệt độ sôi của carboxylic acid và alcohol so với các chất còn lại trong bảng theo mẫu
|
Tên gọi |
Công thức cấu tạo |
Phân loại |
Phân tử khối |
Nhiệt độ sôi (°C) |
|
diethyl ether |
? |
? |
? |
34 |
|
ethyl formate |
? |
? |
? |
54 |
|
methyl acetate |
? |
? |
? |
57 |
|
butanal |
? |
? |
? |
76 |
|
butan-1-ol |
? |
? |
? |
118 |
|
propanoic acid |
? |
? |
? |
141 |
Lời giải:
Nhiệt độ sôi của carboxylic acid và alcohol cao hơn so với các chất có phân tử khối xấp xỉ hoặc tương đương còn lại trong bảng, trong đó nhiệt độ sôi của carboxylic acid cao hơn alcohol. Đó là do chỉ có carboxylic acid và alcohol tạo được liên kết hydrogen liên phân tử, trong đó liên kết hydrogen giữa các phân tử carboxylic acid bền hơn so với giữa các phân tử alcohol.
Câu 1.11 trang 10 Sách bài tập Hóa học 12: Với mỗi ester đã cho trong bảng theo mẫu sau, cho biết chúng tạo bởi từ những carboxylic acid và alcohol nào?
Lời giải:
Câu 1.12 trang 10 Sách bài tập Hóa học 12: Cho 6 hợp chất sau: HCOOH, CH3CH2CH2COOH, CH3CH2CH2CH2OH, CH3COOCH2CH3, CH3CH2CH2CH2CH2OH và HCOOCH2CH2CH2CH3. Hoàn thiện bảng theo mẫu sau. Giải thích
Lời giải:
Do ester không tạo được liên kết hydrogen giữa các phân tử nên ester có nhiệt độ sôi thấp hơn so với các alcohol và carboxylic acid có cùng số nguyên tử carbon.
Mặt khác, nhiệt độ sôi của carboxylic acid luôn cao hơn alcohol có cùng số nguyên tử carbon hoặc có phân tử khối tương đương.
Ngoài ra, nhiệt độ sôi của các chất cùng dãy đồng đẳng tăng theo chiều tăng của phân tử khối.
Vậy ta có bảng sau:
Câu 1.13 trang 11 Sách bài tập Hóa học 12: Thuỷ phân hoàn toàn triglyceride X thu được glycerol và 3 acid béo là lauric acid, palmitic acid và oleic acid. X có thể có bao nhiêu công thức cấu tạo?
Lời giải:
X có thể có 3 công thức cấu tạo
X có thể có 3 công thức cấu tạo
Câu 1.14 trang 11 Sách bài tập Hóa học 12: Vì sao ester có phân tử khối lớn có mùi thơm nhẹ hơn so với các ester có phân tử khối nhỏ hơn
Lời giải:
Ester có mùi thơm được nhận biết thông qua khứu giác. Điều này phụ thuộc vào hiện tượng bay hơi của ester, có nghĩa liên quan đến nhiệt độ sôi của ester.
Các ester có phân tử khối lớn hơn không có mùi thơm mạnh do có nhiệt độ sôi cao hơn các ester có phân tử khối nhỏ.
Ngoài ra, các ester có phân tử khối lớn tuy hoà tan được trong chất béo nhưng không hoà tan được trong nước, vì vậy ngay cả khi chúng đến được mũi, chúng cũng sẽ không đi qua lớp chất nhầy để đến được các cơ quan thụ cảm mùi hương.
Mặt khác với kích thước cồng kềnh, ester có phân tử khối lớn không tương thích với các thụ thể mùi hương. Do đó, ester có phân tử khối lớn hơn thì mùi thơm nhẹ hơn.
Câu 1.15 trang 11 Sách bài tập Hóa học 12: Giải thích vì sao nước hoa cao cấp hầu như không sử dụng ester làm hương liệu. Chất tạo mùi trong nước hoa cao cấp thường là những loại hợp chất nào? Cho ví dụ.
Lời giải:
Mặc dù hương vị và mùi “trái cây” của ester rất dễ chịu, nhưng chúng hiếm khi được sử dụng trong các loại nước hoa cao cấp. Lí do là các ester không bền với mồ hôi. Khi tiếp xúc với mồ hôi, chúng bị thuỷ phân tạo ra các carboxylic acid thường có mùi không dễ chịu như các ester. Ví dụ, butyric acid có mùi giống như bơ bị ôi thiu, đây cũng là chất có trong thành phần các chất tạo nên mùi hôi cơ thề, được tạo thành do sự thuỷ phân ethyl butyrate và methyl butyrate. Ethyl butyrate và methyl butyrate là những ester có mùi hấp dẫn của dâu và táo.
Trong nước hoa cao cấp, chất tạo hương có thể là hydrocarbon (terpene), aldehyde hoặc ketone. Ví dụ với terpene, myrcene (C10H16) được tìm thấy trong nhiều cây gai dầu, trái cây họ cam quýt, xoài, nguyệt quế, đinh hương, ... Limonene, đồng phân của myrcene được tìm thấy trong vỏ của các loại trái cây có múi, rau mùi, cần tây và hạt hồi, ... Với aldehyde, hầu như không loại nước hoa nào trên thế giới tồn tại mà không có sự hiện diện của chúng, chẳng hạn decanal (C10H20O), undecanal (C11H22O), có trong thành phần tinh dầu cam, quýt, hoa hồng, ... đã góp phần cùng một số chất tạo mùi khác tạo nên hương thơm đặc sắc của những loại nước hoa nổi tiếng nhất thế giới.
Muscone (C16H30O) là một ketone chủ yếu tạo nên mùi thơm của xạ hương. Xạ hương tạo cho nước hoa một mùi thơm đặc biệt dễ chịu và bền lâu. Ngày nay, xạ hương được sử dụng trong nước hoa đều là xạ hương tổng hợp.
Câu 1.16 trang 11 Sách bài tập Hóa học 12: Giải thích vì sao các chất béo đều nhẹ hơn nước và không tan trong nước
Lời giải:
Chất béo là những chất có phân tử lớn, cồng kềnh hơn nhiều so với phân tử nước. Do đó trong cùng một thể tích không gian, số các phân tử nước hiện diện nhiều hơn so với số các phân tử chất béo. Vì thế, chất béo có khối lượng riêng nhỏ hơn nước nên chất béo nhẹ hơn nước.
Chất béo là phân tử không phân cực nên không tan trong dung môi phân cực là nước
Câu 1.17 trang 11 Sách bài tập Hóa học 12: Cho biết mục đích của việc hydrogen hoá chất béo lỏng thành chất béo rắn
Lời giải:
Trong công nghiệp thực phẩm, dầu thực vật được chuyển đổi từ chất lỏng sang chất rắn bằng phản ứng hydrogen hoá. Bơ thực vật (margarine) được “làm cứng” theo cách này để chúng trở nên rắn hoặc bán rắn trong điều kiện thường. Việc làm này sẽ giúp kéo dài thời hạn sử dụng của thực phẩm và giữ hương vị ổn định do khó bị oxi hoá hơn dầu thực vật.
Câu 1.18 trang 11 Sách bài tập Hóa học 12: Một nhóm học sinh dưới sự hướng dẫn của giáo viên muốn thực hiện thí nghiệm điều chế ester nên đã tiến hành theo các bước sau.
Bước 1: Cho vào bình cầu đáy tròn 22 mL pentyl alcohol (D = 0,81 g/mL) và V mL acetic acid (D = 1,05 g/mL).
Bước 2: Thêm tiếp vào bình cầu đó 4 mL dung dịch sulfuric acid đặc và một ít đá bọt. Đun hồi lưu hỗn hợp trong khoảng 30 phút.
Bước 3: Sau một thời gian, nhóm học sinh tiến hành cân khối lượng ester thu được sau khi tách khỏi hỗn hợp và làm sạch, cân hiển thị khối lượng 17g.
a) Xác định V để tỉ lệ mol giữa pentyl alcohol và acetic acid là 1 : 1.
b) Đá bọt là gì? Nêu vai trò của đá bọt trong thí nghiệm trên.
c) Cho biết đặc điểm của phản ứng xảy ra trong thí nghiệm đã nêu.
d) Tính hiệu suất của phản ứng ester hoá trên.
e) Trong hỗn hợp phản ứng ban đầu ở bình cầu đáy tròn, nhóm thí nghiệm còn cho thêm một ít hạt silica gel có màu xanh vào trước khi đun hồi lưu.
- Mục đích của việc thêm vào các hạt silica gel là gì?
- Giải thích vì sao khi kết thúc thí nghiệm, các hạt silica gel từ màu xanh chuyển sang màu hồng.
Lời giải:
a) Vì tỉ lệ mol giữa pentyl alcohol và acetic acid là 1 : 1 nên
b) Đá bọt là loại đá được hình thành bởi dung nham núi lửa phun trào, có độ xốp cao và nhẹ.
Vai trò của đá bọt là giúp hỗn hợp phản ứng không bị sôi mạnh.
c) Phản ứng xảy ra trong thí nghiệm là phản ứng ester hoá. Đây là phản ứng thuận nghịch:
d) Trên lí thuyết:
nester = nacid = nalcohol = mol
Vậy hiệu suất phản ứng ester hóa là:
e)
- Mục đích của việc thêm vào các hạt silica gel: Hạt silica gel có nhiệm vụ hấp thụ nước sinh ra trong phản ứng ester hoá, nhờ đó giúp hiệu suất phản ứng ester hoá tăng lên.
- Kết thúc thí nghiệm, các hạt silica gel từ màu xanh chuyển sang màu hồng. Điều này được giải thích: Hạt silica gel có màu xanh do được nhuộm CoCl2. Khi hấp thụ một lượng nước bão hoà sẽ chuyển sang màu hồng, là màu của phức chất [Co(H2O)6]Cl2, hay viết dưới dạng muối ngậm nước là CoCl2.6H2O.
Bằng cách sấy khô silica gel đã hấp thụ nước, ta có thể tái sử dụng các hạt silica gel đã bão hoà nước.
Câu 1.19 trang 12 Sách bài tập Hóa học 12: Vì sao nói chất béo là thức ăn quan trọng của con người
Lời giải:
Một lượng nhỏ chất béo là phần thiết yếu của chế độ ăn uống cân bằng, lành mạnh. Chất béo là nguồn cung cấp các acid béo thiết yếu mà cơ thể không tự tổng hợp được. Ngoài ra, chất béo còn giúp cơ thể hấp thụ vitamin A, D và E. Những vitamin này tan trong chất béo, có nghĩa chúng chỉ có thể được cơ thể hấp thụ khi có mặt chất béo.
Câu 1.20 trang 12 Sách bài tập Hóa học 12: Vì sao trong thực tế, dầu thực vật tuy chứa chủ yếu chất béo không no nhưng lại khó bị ôi thiu hơn mỡ động vật chứa chủ yếu chất béo no?
Lời giải:
Trong thực tế, dầu thực vật tuy chứa chủ yếu chất béo không no nhưng lại khó bị ôi thiu hơn mỡ động vật chứa chủ yếu chất béo no. Nguyên nhân là do trong quá trình sản xuất dầu thực vật, người ta thường cho thêm một lượng nhỏ chất chống oxi hoá là một số dẫn xuất của phenol.
Câu 1.21 trang 12 Sách bài tập Hóa học 12: Một trong những cách làm mới lại bề mặt các vật dụng bằng gỗ đó là sử dụng sáp ong để đánh bóng. Sáp ong là một lipid với thành phần chính là myricyl palmitate. Đây là một ester có mạch không phân nhánh, công thức phân tử là C46H92O2. Viết công thức khung phân tử của myricyl palmitate.
Lời giải:
Câu 1.22 trang 12 Sách bài tập Hóa học 12:
a) Viết công thức khung phân tử của stearic acid và oleic acid, biết oleic acid là acid béo omega-9, có liên kết đôi C=C ở dạng cis.
b) Dự đoán nhiệt độ nóng chảy của oleic acid và stearic acid. Giải thích.
Lời giải:
a)
b) Oleic acid có liên kết đôi C=C ở dạng cis, zic zắc hơn stearic acid là acid béo no. Do đó các phân tử stearic acid trong mạng tinh thể xếp khít với nhau hơn so với oleic acid. Kết quả là lực hút giữa các phân tử stearic acid mạnh hơn so với oleic acid làm cho nhiệt độ nóng chảy của stearic acid (69 °C) cao hơn oleic acid (13,4 °C).
Câu 1.23 trang 12 Sách bài tập Hóa học 12: Cho bảng số liệu sau (*)
a) Viết công thức cấu tạo các chất béo trong bảng trên.
b) Dầu olive có hàm lượng các gốc oleate là 84%. Dầụ ca cao có tổng hàm lượng các gốc palmitate và stearate là 62%. Dầu nào có nhiệt độ đông đặc thấp hơn? Giải thích.
Lời giải:
a) Công thức cấu tạo của tripalmitin, tristearin và triolein lần lượt là: (C15H31COO)3C3H5, (C17H35COO)3C3H5 và (C17H33COO)3C3H5.
b) Dầu olive có hàm lượng các gốc acid béo không no cao, còn dầu ca cao có tổng hàm lượng các gốc acid béo no cao. Do đó ở điều kiện thường, dầu olive ở thể lỏng còn dầu ca cao lại ở thể rắn, có nghĩa là dầu olive có nhiệt độ đông đặc thấp hơn (-6 °C) so với dầu ca cao (34 °C).
Lý thuyết Ester – Lipid
1. Ester
- Khái niệm: Khi thay nhóm OH trong nhóm carboxylic của carboxylic acid bằng nhóm OR’ thì được ester. Trong đó, R’ là gốc hydrocarbon.
- Đặc điểm cấu tạo và cách gọi tên ester
- Ester đơn chức có công thức chung là R – COO – R’, trong đó R là gốc hydrocarbon hoặc nguyên tử H, R’ là gốc hydrocarbon
- Quy tắc gọi tên ester đơn chức: Tên ester RCOOR’ = Tên gốc R’ + Tên gốc acid RCOO
Ví dụ: HCOOCH3: methyl formate hay methyl methanoate
Tính chất vật lí của ester
- Do không có liên kết hydrogen giữa các phân tử, ester có nhiệt độ sôi thấp hơn nhiệt độ sôi của carboxylic acid hoặc alcohol có cùng số nguyên tử carbon hoặc có khối lượng phân tử tương đương
- Ester là những chất lỏng hoặc rắn ở điều kiện thường, hầu hết nhẹ hơn nước, thường ít tan trong nước. Một số ester có mùi thơm của hoa, quả chín như: ethyl butyrate có mùi dứa chín, isomayl acetate có mùi chuối chín,…
Tính chất hóa học của ester
- Phản ứng hóa học đặc trưng của ester là phản ứng thủy phân
- Phản ứng thủy phân ester trong môi trường acid như HCl, H2SO4,… thường là phản ứng thuận nghịch
Ví dụ: 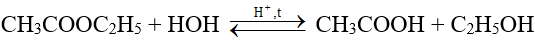
- Ester cũng bị thủy phân khi đun nóng với dung dịch kiềm như NaOH, KOH,… Phản ứng này được gọi là phản ứng xà phòng hóa.
Ví dụ: HCOOCH3 + NaOH HCOONa + CH3OH
Điều chế và ứng dụng của ester
Các ester thường được điều chế bằng cách đun hỗn hợp gồm carboxylic acid và alcohol sử dụng H2SO4 đặc làm xúc tác.
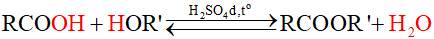
Một số ester được điều chế bằng phương pháp khác. Chẳng hạn, trong công nghiệp, vinyl acetate được tổng hợp từ ethylene và acetic acid với sự có mặt của oxygen, sử dụng xúc tác palladium:
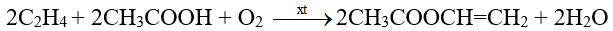
2. Chất béo
Khái niệm về lipid, chất béo, acid béo
- Lipid là những hợp chất hữu cơ có trong tế bào sống, không tan trong nước nhưng tan trong các dung môi khoong phân cực như ether, chloroform, carbon tetrachloride,…
- Lipid bao gồm chất béo, sáp, steroid, phospholipid,….
- Chất béo (triglyceride) là thành phần chính của mỡ động vật và dầu thực vật
- Chất béo là triester của glycerol với các acid béo
Công thức tổng quát của chất béo:

Một số acid béo thường gặp
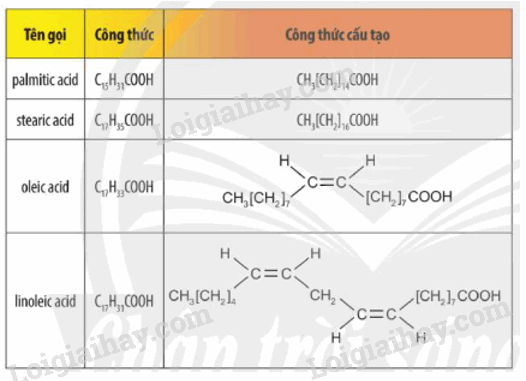
Với acid béo không no, số thứ tự chỉ vị trí liên kết đôi đầu tiên tính từ đuôi CH3 là n thì acid béo thuộc nhóm omega – n
Tìm hiểu tính chất vật lí và hóa học của chất béo
- Chất béo đều nhẹ hơn nước, khôngg tan trong nước nhưng tan trong các dung môi không phân cực như benzene, ether,… Do đó khối lượng phân tử nên chất béo thường có nhiệt độ cao.
- Ở nhiệt độ thường, chất béo chứa nhiều gốc acid béo không no thường ở thể lỏng (có nhiều trong dầu thực vật), chất béo chứa nhiều gốc acid béo no thường ở thể rắn (có nhiều trong mỡ động vật)
Chất béo cũng có phản ứng đặc trưng của ester là phản ứng thủy phân. Thủy phân chất béo trong môi trường kiềm, thu được sản phẩm gồm glycerol và các muối tương ứng của acid béo (thành phần chính của xà phòng).
Ví dụ:
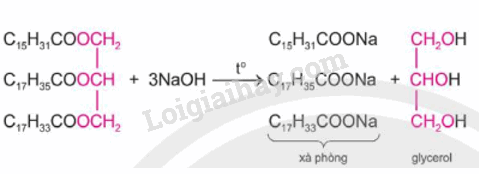
Ứng dụng của chất béo và acid béo
Chất béo là thức ăn quan trọng của con người. Trong cơ thể, chất béo bị oxi hóa thành CO2 và H2O, giải phóng năng lượng cho cơ thể. Chất béo dư thừa được tích lũy vào các mô mỡ.
- Acid béo omega – 3 và omega – 6 đều có lợi cho sức khỏe tim mạch, ngăn ngừa các bệnh về tim, động mạch vành, trong đó - linolenic acid và linoleic acid là hai acid béo thiết yếu vì cơ thể không tự tổng hợp được mà phải lấy từ nguồn thực phẩm bên ngoài.
Xem thêm các bài giải SBT Hóa học lớp 12 Chân trời sáng tạo hay, chi tiết khác: