Tailieumoi.vn xin giới thiệu đến các quý thầy cô Giáo án Hóa học 10 theo chủ đề và tính giản năm 2020-2021 mới nhất theo mẫu Giáo án môn hóa học chuẩn của Bộ Giáo dục. Hi vọng tài liệu này sẽ giúp thầy/cô dễ dàng biên soạn chi tiết Giáo án môn Hóa học lớp 10. Chúng tôi rất mong sẽ được thầy/cô đón nhận và đóng góp những ý kiến quý báu của mình.
Mời các quý thầy cô cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Ngày soạn:
Tiết: 1, 2: ÔN TẬP ĐẦU NĂM
I. Mục tiêu
1. Kiến thức
- Giúp HS hệ thống lại các kiến thức đã học ở THCS có liên quan đến lớp 10.
- Phân biệt các khái niệm nguyên tử, nguyên tố, phân tử, đơn chất, hợp chất, hỗn hợp.
2. Kĩ năng
- HS rèn luyện kỹ năng lập CT, tính theo công thức và phương trình phản ứng
- Tỉ khối của chất khí.
- Chuyển đổi giữa khối lượng mol (M), khối lượng chất (m), số mol (n), thể tích khí ở đktc (V), số mol phân tử chất (A).
3. Phát triển năng lực
* Các năng lực chung
- Năng lực tự học
- Năng lực hợp tác
- Năng lực phát hiện và giải quyết vấn đề
- Năng lực giao tiếp
- Năng lực sử dụng ngôn ngữ
* Các năng lực chuyên biệt
- Năng lực nhận thức hóa học
- Năng lực tính toán
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học
- Năng lực vận dụng kiến thức kỹ năng đã học
II. Chuẩn bị
- Chuẩn bị của GV: Hệ thống bài tập và câu hỏi gợi ý.
- Chuẩn bị của HS: Ôn tập các kiến thức thông qua họat động giải BT
III. Phương pháp
Đàm thoại tích cực, trực quan, nêu vấn đề.
IV. Tiến trình dạy học
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
A. HOẠT ĐỘNG KHỞI ĐỘNG GV cho HS xem bộ phim về cậu bé nguyên tử, yêu cầu HS trả lời em đã thu nhận được thông tin gì từ bộ phim trên?
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC GV: Yêu cầu HS nhắc lại các khái niệm: nguyên tử, phân tử, nguyên tố hóa học, đơn chất, hợp chất. Lấy ví dụ.
vd1 : Trong phân tử nước (H2O) Tỉ lệ nguyên tử : H : O = 2:1. Thứ tự liên kết : H-O-H vd2 : Trong phân tử axit sunfuric (H2SO4) Tỉ lệ nguyên tử : H : S : O = 2: 1 : 4 Thứ tự liên kết :
GV: Yêu cầu HS nhắc lại các khái niệm: mol, khối lượng mol nguyên tử, phân tử; thể tích mol chất khí. Lấy ví dụ.
- GV gọi HS lên bảng viết công thức.
GV: Yêu cầu HS nhắc lại công thức tính tỉ khối của khí A so với khí B, tỉ khối của A so với không khí. Lấy ví dụ.
C. LUYỆN TẬP 1. Tính khối lượng mol của các chất sau: H2SO4, Na2SO4, Cu(NO3)3, Al2O3. 2. Tính khối lượng mol của các chất sau: - Tỉ khối của X so với H2 là 22 - Tỉ khối của X so với so với CO2 là 1,02
Tiết 2: A. HOẠT ĐỘNG KHỞI ĐỘNG Trò chơi: MẢNH GHÉP HOÀN HẢO GV chuẩn bị các mảnh ghép về các công thức, chia lớp thành 8-10 nhóm, trong thời gian 3 phút, ghép các công thức tương ứng. Đội nào nhanh và chính xác nhất sẽ giành chiến thắng. 1) Khối lượng m 2) Thể tích khí (đkc) 3) Thể tích khí ở t0C, P, V 4) Thể tích dd, CM 5) Khối lượng chất tan, %C 6) Thể tích dd, D
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC
vd : Hòa tan hh gồm (Fe và Zn) trong 500 ml dd HCl 0,4M thu được dd A và 1,792 lít khí Hydro (đkc). Cô cạn dd A thu được 10,52 gam muối khan. a) Tính khối lưọng hh ban đầu ? b) Tính nồng độ mol các chất trong dd A ?
- GV gọi HS1 nhắc lại các hợp chất vô cơ như: oxit, axit, bazơ, muối. - GV gọi HS2 lên bảng viết vd từng tính chất
C. LUYỆN TẬP 1. Viết phản ứng (nếu có) khi cho H2SO4 loãng tác dụng với : Mg, Al2O3, K2CO3, Ba(OH)2, KOH, Fe(OH)2. 2. S SO2 SO3 H2SO4 CuSO4 Cu(OH)2 CuO CuCl2 Cu(NO3)2
|
I. Các khái niệm về chất 1. Nguyên tử - Là hạt vô cùng bé tạo nên các chất - Nguyên tử gồm có: + Hạt nhân mang điện tích dương, nằm ở tâm nguyên tử. + Lớp vỏ được tạo bởi các e mang điện tích âm, chuyển động xq hạt nhân và xếp thành từng lớp. - Hạt nhân tạo bởi hạt p và hạt n. + Hạt proton (p) : mang điện tích (+) + Hạt nơtron (n) : không mang điện - Khối lượng nguyên tử mngtư = mp + mn - Trong nguyên tử : số p = số e. vd : Nguyên tử Oxi + Hạt nhân có 8p và 8e. + Vỏ nguyên tử có 8e chuyển động xq hạt nhân trên 2 lớp . 2. Phân tử - Là hạt đại diện cho chất gồm 1 số nguyên tử liên kết với nhau và thể hiện đầy đủ tính chất hóa học của chất. - Thông thường phân tử gồm 2 nguyên tử trở lên. - Phân tử có thể gồm những nguyên tử cùng lọai : O2, Cl2, N2…,có thể gồm những nguyên tử khác loại : H2O, CaO, NaOH … - Phân tử khối là khối lượng của 1 phân tử tính bằng đvc, bằng tổng nguyên tử khối của các nguyên tử trong phân tử. vd : Phân tử khối của CO2 =12+16.2 = 44 đvc. * Nếu phân tử bị chia nhỏ thì không còn mang tính chất của chất. vd : Phân tử CaCO3 khi nung bị phân hủy thành CaO và CO2. Hai chất mới tạo thành không còn tính chất của CaCO3. 3. Nguyên tố hóa học - Là tập hợp những nguyên tử của cùng 1 nguyên tố, có cùng số proton. - Các nguyên tử thuộc cùng 1 nguyên tố có tính chất hóa học giống nhau. vd : Tập hợp những ngtử Clo (có 17 p trong hạt nhân) làm thành 1 nguyên tố Clo. 4. Đơn chất, hợp chất a. Đơn chất : Là những chất tạo nên từ 1 nguyên tố hóa học. vd : Khí Hydro (H2), khí nitơ (N2), sắt (Fe), nhôm (Al) … b. Hợp chất: Là những chất tạo nên từ 2 hay nhiều nguyên tố hóa học. vd : Nước (H2O) tạo nên từ 2 ngtố H và O H2SO4 tạo nên từ 3 nguyên tố H, S và O. II. Mol 1. Mol là gì? Mol là lượng chất chứa 6.1023 nguyên tử hay phân tử của chất đó. - Con số 6.1023 gọi là số Avogadro, ký hiệu là N. - Đối với phân tử có nhiều nguyên tử, khi nói mol cần phân biệt mol nguyên tử hay mol phân tử. 2. Khối lượng mol * Ký hiệu : M Khối lượng mol của 1 chất là khối lượng của 1 mol chất đó (tức là khối lượng của N nguyên tử hay phân tử) tính bằng gam, có trị số bằng số nguyên tử khối hay phân tử khối. vd : + K.lượng mol nguyên tử Oxy : MO = 16 g. + K.lượng mol phân tử Oxy : M= 32g. + K.lượng mol phân tử nước : M= 18 g. 3. Thể tích mol của chất khí Thể tích mol của chất khí là thể tích chiếm bởi 1 mol (tức là chiếm bởi N phân tử) chất khí đó. - Trong cùng đk nhiệt độ và áp suất, thể tích mol của mọi chất khí đều bằng nhau. - Ở đkc (t0 = 00C, P= 1atm), thể tích mol của mọi chất khí đều bằng 22,4 lít . V0= V0= V0= … = 22,4 lít III. Tỉ khối của chất khí 1. Tỉ khối của khí A so với khí B Để biểu thị khí A nặng hay nhẹ hơn khí B bao nhiêu lần, ta dùng đại lượng tỉ khối. dA/B = vd: Khí cacbonic nặng hay nhẹ hơn khí Hydro bao nhiêu lần.
dco2/H2 = \(\frac{{{M_{C{O_2}}}}}{{{M_{{H_2}}}}}\) = \(\frac{{44}}{2}\)= 22 Khí cacbonic nặng hơn khí Hydro 22 lần. 2. Tỉ khối của khí A so với không khí KK là hỗn hợp nhiều khí, khối lượng mol TB của KK (đkc) bằng 29. dA/KK = \(\frac{{{M_A}}}{{{M_{KK}}}}\) = \(\frac{{{M_A}}}{{29}}\) vd: Khí SO2 nặng hay nhẹ hơn không khí bao nhiêu lần.
dso2/KK = \(\frac{{{M_{S{O_2}}}}}{{{M_{KK}}}}\) = \(\frac{{64}}{{29}}\)= 2,21 Khí SO2 nặng hơn không khí 2,21 lần.
IV. Công thức 1. Tính số mol (n) n = \(\frac{m}{M}\) n = \(\frac{V}{{22,4}}\) n = \(\frac{{PV}}{{RT}}\)
n = CM . V 2. Tính khối lượng dung dịch
mdd = \(\frac{{{m_{ct}}.100}}{{\% C}}\)
mdd = V. D V. Phân loại chất vô cơ 1. Oxit: Là hợp chất gồm nguyên tố Oxy và nguyên tố khác. a. Oxit bazơ (oxit KL) CaO + CO2 CaCO3 Na2O + 2HCl 2NaCl + H2O b. Oxit axit (oxit PK) SO2 + CaO CaSO3 CO2 + 2NaOH Na2CO3 + H2O CO2 + NaOH NaHCO3 c. Oxit lưỡng tính (oxit của KL) Tác dụng với axit hay baz tạo thành muối ZnO + 2HCl ZnCl2 + H2O ZnO + 2NaOH Na2ZnO2 + H2O 2. Bazơ : là hợp chất gồm KL kết hợp với nhóm –OH. + Baz tan : NaOH, KOH, Ba(OH)2, Ca(OH)2 +Baz không tan : Cu(OH)2, Fe(OH)3 …. · Hóa tính - Làm quỳ tím hóa xanh. - Tác dụng với Axit, Oxit axit, muối. NaOH + HCl NaCl + H2O 2NaOH + CO2 Na2CO3 + H2O 2NaOH + FeCl2 2NaCl + Fe(OH)2 3. Axit : là hợp chất gồm Hydo kết hợp với gốc axit . + Axit mạnh : HCl, H2SO4, HNO3, … +Axit yếu : H2S, H2CO3, H2SO3 …. · Hóa tính - Làm quỳ tím hóa đỏ . - Tác dụng với KL trước H, Baz, Oxit baz, muối. 2HCl + Fe FeCl2 + H2 HCl + NaOH NaCl + H2O 2HCl + CuO CuCl2 + H2O HCl + AgNO3 AgCl¯ + HNO3 4. Muối : là hợp chất gồm kim lọai kết hợp với gốc axit. + Muối tan : NaCl, CuSO4, KNO3, … +Muối không tan : CuS, FeCO3, AgCl …. · Hóa tính Tác dụng với KL đứng trước , axit, baz kiềm , muối. CaCO3 + 2HCl CaCl2 + H2O+ CO2 FeCl2 + 2NaOH Fe(OH)2 + 2NaCl KCl + AgNO3 AgCl¯ + KNO3 CuSO4 + Fe FeSO4 + Cu¯
|
Ngày soạn:
Chương 1: NGUYÊN TỬ
Tiết: 3: THÀNH PHẦN NGUYÊN TỬ
I. Mục tiêu
1. Kiến thức
- Nguyên tử là phần tử nhỏ nhất của nguyên tố, có cấu tạo rỗng và phức tạp.
- Kích thước và khối lượng của nguyên tử.
2. Kĩ năng
- Biết hoạt động độc lập và hợp tác để hoàn thành nhiệm vụ học tập.
- Có kĩ năng tìm kiếm thông tin về nguyên tử trên mạng internet, lưu giữ và xử lí thông tin.
II. Phương tiện dạy học
- Chuẩn bị của GV:
+ Video giới thiệu về một số nhà bác học nghiên cứu, phát hiện thành phần cấu tạo nguyên tử.
+ Sơ đồ tóm tắt thí nghiệm tìm ra tia âm cực (hình 1.1 và hình 1.2 SGK); thí nghiệm khám phá hạt nhân nguyên tử (hình 1.3 SGK).
- Chuẩn bị của HS: Đọc lại SGK Hóa học lớp 8, phần cấu tạo nguyên tử.
III. Phát triển năng lực của học sinh
* Các năng lực chung
- Năng lực tự học
- Năng lực hợp tác
- Năng lực phát hiện và giải quyết vấn đề
- Năng lực giao tiếp
- Năng lực sử dụng ngôn ngữ
* Các năng lực chuyên biệt
- Năng lực nhận thức hóa học
- Năng lực tính toán
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học
- Năng lực vận dụng kiến thức kỹ năng đã học
IV. Phương pháp
Đàm thoại tích cực, trực quan, nêu vấn đề.
V. Trọng tâm bài giảng
Nguyên tử có cấu tạo rỗng gồm p, n, e.
VI. Tiến trình dạy học
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
Tiết 3: A. HOẠT ĐỘNG KHỞI ĐỘNG |
|
|
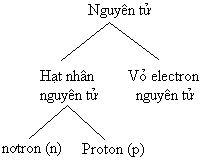
- Yêu cầu HS nhắc lại khái niệm nguyên tử (đã học lớp 8), nguyên tử được tạo thành từ những hạt nào? Kí hiệu của các hạt? GV tóm tắt sơ đồ Hạt nhân (p, n) Nguyên tử Vỏ (các e) Như vậy, chúng ta đã biết nguyên tử được cấu tạo từ các hạt nào? Kích thước và khối lượng như thế nào? Bài học hôm nay sẽ giải đáp câu hỏi đó. |
|
|
B. HOẠT ĐỘNG HÌNH THÀNH KIẾN THỨC Hoạt động 1: Thí nghiệm tìm ra electron và Thí nghiệm tìm ra hạt nhân nguyên tử: (Khuyến khích HS tự đọc) |
|
|
Hoạt động 2: Tìm hiểu cấu tạo hạt nhân |
|
|
- Proton là gì? Khối lượng và điện tích của proton? Nơtron là gì? Khối lượng và điện tích của nơtron? + Hạt nhân chưa phải là phần nhỏ nhất của nguyên tử. + Hạt nhân gồm các proton và nơtron. + Khối lượng và điện tích của proton và nơtron - Các thí nghiệm đã xác nhận nguyên tử là có thật, có cấu tạo rất phức tạp. Vậy kích thước và khối lượng của nguyên tử như thế nào? |
- Hạt nhân được tạo nên từ các hạt proton và nơtron. - mp = mn = 1,6726. 10-27kg - qp = 1+ qn = 0 |
|
Hoạt động 3 : Tìm hiểu kích thước và khối lượng của nguyên tử (Tự học có hướng dẫn) |
|
|
GV giúp HS hình dung nguyên tử có kích thước rất nhỏ, nếu coi nguyên tử là một khối cầu thì đường kính của nó ~10–10 m. Hạt nhân có kích thước rất nhỏ so với nguyên tử, đường kính của hạt nhân ~10–5 nm (nhỏ hơn nguyên tử ~ 10000 lần). - Có thể dùng đơn vị gam hay kg để đo khối lượng nguyên tử được không? Tại sao người ta sử dụng đơn vị u (đvC) bằng 1/12 khối lượng nguyên tử cacbon làm đơn vị ? - Dùng các đơn vị như gam hay kg để đo khối lượng nguyên tử rất bất tiện do số lẻ và có số mũ âm rất lớn, như 19,9264.10–27kg là khối lượng nguyên tử cacbon. Do đó, để thuận tiện hơn trong tính toán, người ta dùng đơn vị u (đvC). |
1. Kích thước - Nguyên tử các nguyên tố khác nhau có kích thước khác nhau. - Đơn vị đo kích thước nguyên tử là Å, nm. 1 Å = 10–10m, 1nm = 10 Å 2. Khối lượng - mngtử = mp + me + mn - Do me << mhạt nhân → mngtử = mp + mn - 1đvC = 1u = 1/12 khối lượng nguyên tử C = 1/N 1u =1,6605.10-27 kg |
|
C. LUYỆN TẬP |
|
|
- Tổng kết các nội dung đã học: + Nguyên tử có cấu tạo rỗng và phức tạp. + Cách tính khối lượng nguyên tử.
D. VẬN DỤNG VÀ TÌM TÒI MỞ RỘNG 1) Tính khối lượng nguyên tử Hiđro, kẽm, iot theo u. Biết: mH = 1,6735. 10-27 kg; mZn = 108,58. 10-27 kg mI = 210,725. 10-27 kg. 2) Tính khối lượng nguyên tử của Beri và oxi theo kg biết: mBe = 9,012u; mO = 15,99u.
|
 |
Ngày soạn:
Tiết 4, 5: HẠT NHÂN NGUYÊN TỬ.
NGUYÊN TỐ HÓA HỌC. ĐỒNG VỊ
I. Mục tiêu
1. Kiến thức
- Phân biệt khái niệm số đơn vị điện tích hạt nhân (Z) với điện tích hạt nhân (Z+).
- Quan hệ giữa số đơn vị điện tích hạt nhân, số proton, số electron trong nguyên tử.
- Khái niệm nguyên tố hoá học, số hiệu, kí hiệu nguyên tử.
2. Kĩ năng
- Giải các bài tập xác định số đơn vị điện tích hạt nhân, số proton, số nơtron, số electron của nguyên tử và số khối của hạt nhân nguyên tử.
II. Phương tiện dạy học
- Chuẩn bị của GV: Phiếu học tập.
- Chuẩn bị của HS: Nắm vững đặc điểm của các hạt cấu tạo nên nguyên tử.
III. Phát triển năng lực của học sinh
* Các năng lực chung
- Năng lực tự học
- Năng lực hợp tác
- Năng lực phát hiện và giải quyết vấn đề
- Năng lực giao tiếp
- Năng lực sử dụng ngôn ngữ
* Các năng lực chuyên biệt
- Năng lực nhận thức hóa học
- Năng lực tính toán
- Năng lực tìm hiểu thế giới tự nhiên dưới góc độ hóa học
- Năng lực vận dụng kiến thức kỹ năng đã học
IV. Phương pháp
1. Phương pháp dạy học: Phương pháp dạy học nhóm, dạy học nêu vấn đề.
2. Các kĩ thuật dạy học
- Hỏi đáp tích cực.
- Khăn trải bàn.
- Nhóm nhỏ.
V. Trọng tâm
Đặc trưng của nguyên tố là điện tích hạt nhân (số p) → nếu có cùng điện tích hạt nhân (số p) thì các nguyên tử đều thuộc cùng một nguyên tố hóa học, khi số n khác nhau sẽ tồn tại các đồng vị.
VI. Tiến trình dạy học
|
HOẠT ĐỘNG CỦA GIÁO VIÊN |
HOẠT ĐỘNG CỦA HỌC SINH |
|
|
Tiết 4: A. HOẠT ĐỘNG KHỞI ĐỘNG |
||
|
HĐ nhóm: - GV chia lớp thành 4 nhóm, phát phiếu học tập, giấy cỡ lớn và bút cho từng nhóm. Phiếu học tập số 1 Câu 1: a) Chọn từ thích hợp điền vào chỗ trống: Thành phần nguyên tử gồm…(1).. và..(2)… …(3)…nguyên tử là phần mang điện dương nằm chính giữa nguyên tử và có cấu tạo gồm các hạt ..(4)…và…(5)…. b) Phiếu học tập số 2: Nhóm 1, 3:a) Cho nguyên tử Cl có 17p, 18n và 17e. Tính khối lượng nguyên tử và khối lượng hạt nhân của Cl theo đơn vị u. So sánh khối lượng nguyên tử và khối lượng hạt nhân của Cl. Nhóm 2, 4:b) Cho nguyên tử Cl có 17p, 20n và 17e. Tính khối lượng nguyên tử và khối lượng hạt nhân của Cl theo đơn vị u. So sánh khối lượng nguyên tử và khối lượng hạt nhân của Cl. 2/ Thực hiện nhiệm vụ học tập - Các nhóm phân công nhiệm vụ cho từng thành viên: tiến hành hoàn thành yêu cầu của các phiếu học tập bằng các kiến thức đã học. 3/Báo cáo kết quả và thảo luận HĐ chung cả lớp: Phiếu học tập số 1: GV mời một nhóm báo cáo kết quả, các nhóm khác góp ý, bổ sung. Phiếu học tập số 2: Giáo viên mời nhóm 1 và nhóm 3 trình bày kết quả lên bảng, các nhóm 2, nhóm 4 góp ý, bổ sung. 4/ Đánh giá kết quả thực hiện nhiệm vụ học tập. Qua phiếu học tập số 1, HS nhớ lại và vận dụng kiến thức đã học về thành phần nguyên tử vào giải quyết yêu cầu đặt ra. Từ những kiến thức cũ này học sinh sẽ dễ dàng nghiên cứu và tiếp thu được kiến thức của bài mới. Qua phiếu học tập số 2, GV sử dụng kết quả của các bài toán này để giúp học sinh tìm hiểu các khái niệm số khối và nguyên tử khối trong bài mới. + Dự kiến một số khó khăn, vướng mắc của HS: Vì sao đều là nguyên tử của cùng một nguyên tố clo nhưng có khối lượng nguyên tử và khối lượng hạt nhân khác nhau. Mâu thuẫn đó sẽ được giải quyết khi tìm hiểu khái niệm về nguyên tố hóa học và đồng vị. - GV chuyển sang hoạt động tiếp theo: HĐ hình thành kiến thức. |
a) Phiếu học tập số 1
(1), (2): vỏ nguyên tử, hạt nhân. (3) hạt nhân. (4) proton (5) nơtron Phiếu học tập số 2: a) mnguyên tử = mp + mn + me = 35,00935(u) mhạt nhân = mp + mn = 35(u) so sánh: \[\frac{{{m_{ng/t}}}}{{{m_{hn}}}}\] ≈1 hay mnguyên tử ≈ mhạt nhân b) mnguyên tử = mp + mn + me = 37,00935(u) mhạt nhân = mp + mn = 37(u) so sánh: \[\frac{{{m_{ng/t}}}}{{{m_{hn}}}}\] ≈1 hay mnguyên tử ≈ mhạt nhân |
|









