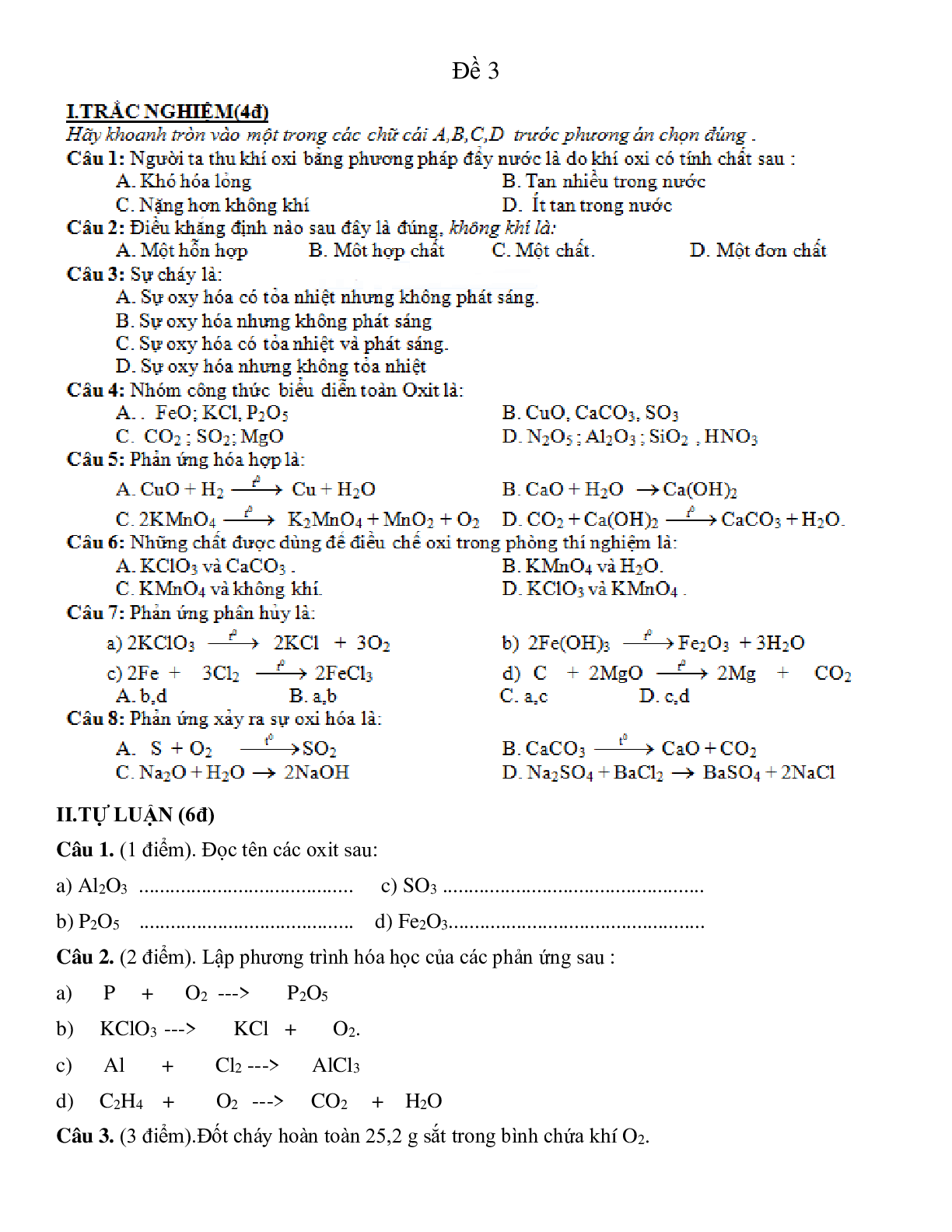Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu 3 đề kiểm tra giữa học kì 2 Hóa học lớp 8 năm 2020 chọn lọc, tài liệu bao gồm 8 trang, tuyển chọn 3 đề kiểm tra 1 tiết Hóa học lớp 8. Đề thi được tổng hợp từ các trường THCS trên cả nước giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi kiểm tra 1 tiết môn Hóa học lớp 8 sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
ĐỀ KIỂM TRA CHƯƠNG: OXI – KHÔNG KHÍ
Đề số 1
A. TRẮC NGHIÊM .
Hãy khoanh tròn vào câu trả lời đúng nhất.
Câu 1 : Nhóm công thức nào sau đây biểu diễn toàn Oxit
A. CuO, CaCO3, SO3 C. FeO; KCl, P2O5
B. N2O5 ; Al2O3 ; SiO2 D. CO2 ; H¬2SO4 ; MgO
Câu 2. Người ta thu khí oxi bằng phương pháp đẩy nước là do khí oxi có tính chất sau :
A. Nặng hơn không khí B. Tan nhiều trong nước
C. Ít tan trong nước D. Khó hóa lỏng
Câu 3. Khi phân hủy có xúc tác 122,5g Kaliclorat (KClO3) thể tích khí oxi thu được là :
A.48,0 (l) B. 24,5 (l) C. 67,2 (l) D. 33,6(l)
Câu 4 : Sự Oxi hóa chậm là :
A. Sự oxi hóa mà không tỏa nhiệt; B. Sự oxi hóa mà không phát sáng
C. Sự tự bốc cháy ; D. Sự ôxi hóa tỏa nhiệt mà không phát sáng
Câu 5. Số gam Kalipemanganat (KMnO4) cần dùng để điều chế được 5.6 lít khí oxi (đktc) là :
A. 49,25 g ; B. 21,75 g ; C. 79,0 g ; D. 39.5 g
Câu 6. Những chất được dùng để điều chế oxi trong phòng thí nghiệm là:
A. KClO3 và KMnO4 . B. KMnO4 và H2O.
C. KClO3 và CaCO3 . D. KMnO4 và không khí.
Câu 7. Phản ứng nào dưới đây là phản ứng hóa hợp
A. CuO + H2 Cu + H2O .
B. CaO + H2O Ca(OH)2 .
C. 2KMnO4 K2MnO4 + MnO2 + O2 .
D. CO2 + Ca(OH)2 CaCO3 + H2O.
Câu 8. Dùng hết 5 kg than ( chứa 90% C, và 10% tạp chất không cháy) để đun nấu.
Biết Vkk = 5. Hỏi thể tích không khí (ở đktc) đã dùng là bao nhiêu lít.
A. 4000lít B. 4200lít C. 4250lít D. 4500lít
B. TỰ LUẬN
Câu 1 : Điền công thức hoá học hoặc tên gọi vào ô thích hợp trong bảng sau:
Nguyên tố K S(VI) C(IV) Fe(II) P(V) Al
CTHH của oxit
Tên gọi
Câu 2: Hãy so sánh sự cháy với sự oxi hoá chậm?
Câu 3 : Cho 13,5g kim loại nhôm tác dụng với 8,96l khí oxi ở đktc.
a. Viết PTHH xảy ra?
b. Tính khối lượng các chất sau khi phản ứng kết thúc?
ĐỀ 02
I/ Trắc nghiệm :
Khoanh tròn vào đáp án đúng :
Câu 1: Cho các hiện tượng:
1. Hòa tan muối ăn vào nước được nước muối.
2. Khi đánh diêm có lửa bắt cháy.
3. Thanh đồng được kéo thành sợi nhỏ để làm dây điện.
4. Thuỷ tinh được đun nóng chảy ở to cao rồi thổi thành bóng đèn, lọ hoa, cốc …
5. Cho 1 mẫu đá vôi vào giấm ăn thấy có bọt khí thoát ra.
Hiện tượng hóa học là
A. 1, 3 và 4
B. 1 và 2
C. 2 và 5
D. 2 và 3
Câu 2: Phát biểu sai là
A. trong 1 PƯHH, tổng khối lượng các chất sản phẩm bằng tổng khối lượng các chất tham gia.
B. trong 1 PƯHH, số nguyên tử của mỗi nguyên tố được bảo toàn.
C. trong 1 PƯHH, số phân tử của các chất được bảo toàn
D. trong 1 PƯHH có n chất nếu biết khối lượng của (n-1) chất thì tính được khối lượng của chất còn lại.
Câu 3: Khí Nitơ N2 và khí Hidro H2 tác dụng với nhau tạo ra Amoniac (NH3). PTHH viết đúng là
A. N2 + 3H2 2NH3 B. N2 + H2 NH3
C. N2 + H2 2NH3 D. N + 3H2 2NH3
Câu 4: PTHH cho biết chính xác
A. số nguyên tử, phân tử của các chất tham gia phản ứng.
B. tỉ lệ số phân tử (nguyên tử) của các chất trong phản ứng.
C. khối lượng của các chất phản ứng.
D. nguyên tố nào tạo ra chất.
Câu 5: Trong phản ứng hóa học, phân tử này biến đổi thành phân tử khác là do
A. các nguyên tử tác dụng với nhau.
B. các nguyên tố tác dụng với nhau.
C. liên kết giữa các nguyên tử thay đổi.
D. liên kết giữa các nguyên tử không bị thay đổi.
Câu 6: Phương trình hóa học dùng để
A. biểu diễn PƯHH bằng chữ.
B. biểu diễn ngắn gọn PƯHH bằng công thức hoá học.
C. biểu diễn sự biến đổi của từng chất riêng rẽ.
D. biểu diễn sự biến đổi của các nguyên tử trong phân tử.
Câu 7 : Sự tác dụng của oxi với một chất gọi là :
A . sự oxi hóa B . sự cháy
C . sự đốt nhiên liệu D . sự thở
Câu 8: Hai lĩnh vực ứng dụng quan trọng nhất của khí oxi là dùng cho :
A . Sự hô hấp và quang hợp của cây xanh.
B . Sự hô hấp và sự đốt nhiên liệu.
C . Sự hô hấp và sự cháy
D . Sự cháy và đốt nhiên liệu
Câu 9 : Một oxit của photpho có thành phần phần trăm của P bằng 43,66%. Biết phân tử khối của oxit bằng 142 đvC . Công thức hóa học của oxit là :
A . P2O3 B . P2O5
C.PO2 D . P2O4
Câu 10 : Sự cháy khác sự oxi hóa chậm là :
A . có phát sáng B . không phát sáng
C . có tỏa nhiệt D . không tỏa nhiệt
Câu 11: Thành phần theo thể tích của khí nitơ , oxi , các khí khác trong không khí lần lượt là:
A . 78% , 20% , 2% B . 78% , 21% , 1%
C . 50% , 40% , 10% D . 68% , 31% , 1%
Câu 12: Chất dùng để điều chế khí oxi trong phòng thí nghiệm là :
A . Nước B . Không khí C . KMnO4 D . CaCO3
II/ TỰ LUẬN :
Câu 1 : Các oxit sau thuộc loại oxit axit hay oxit bazơ . Gọi tên các oxit đó ?
Na2O , CaO , CO2 , SO3
Câu 2 : Hãy cho biết các phản ứng sau thuộc phản ứng nào ? . Vì sao ?
Câu 3: Đốt cháy 6,2g phot pho trong khí oxi thu được điphotphopentaoxit ( P2O5 ) .
a) Tính khối lượng sản phẩm tạo thành sau khi đốt cháy .
b) Tính thể tích khí oxi ( đktc) cần dùng .
c) Nếu lấy lượng khí oxi dùng để đốt cháy lượng photpho trên cho phản ứng với khí metan (CH4) thì thể tích khí cacbonđioxit (đktc) thu được là bao nhiêu ?
( P = 31 O =16 C =12 H = 1 )
Đề 3
II.TỰ LUẬN (6đ)
Câu 1. (1 điểm). Đọc tên các oxit sau:
a) Al2O3 ......................................... c) SO3 ..................................................
b) P2O5 ......................................... d) Fe2O3.................................................
Câu 2. (2 điểm). Lập phương trình hóa học của các phản ứng sau :
a) P + O2 ---> P2O5
b) KClO3 ---> KCl + O2.
c) Al + Cl2 ---> AlCl3
d) C2H4 + O2 ---> CO2 + H2O
Câu 3. (3 điểm).Đốt cháy hoàn toàn 25,2 g sắt trong bình chứa khí O2.
a) Hãy viết phương trình phản ứng xảy ra.
b) Tính thể tích khí O2 (ở đktc) đã tham gia phản ứng trên.
c) Tính khối lượng KClO3 cần dùng để khi phân huỷ thì thu được một thể tích khí O2 (ở đktc) bằng với thể tích khí O2 đã sử dụng ở phản ứng trên.
(Cho : Fe = 56; K = 39; O = 16; Cl = 35,5)