Tỉ khối hơi cuả chất X so với hiđro bằng 44. Phân tử khối của X là
A. 44
B. 46
C. 22
D. 88.
 Giải bởi Vietjack
Giải bởi Vietjack
Đáp án D
Lý thuyết Nguyên tố hóa học
I. Nguyên tố hóa học
Nguyên tố hóa học là tập hợp các nguyên tử có cùng số đơn vị điện tích hạt nhân. Trong nguyên tử, số đơn vị điện tích hạt nhân bằng số electron ở vỏ nguyên tử. Các electron trong nguyên tử quyết định tính chất hóa học của nguyên tử, nên các nguyên tử của cùng một nguyên tố hóa học có tính chất hóa học giống nhau.
Ví dụ 1: Tất cả nguyên tử có cùng số đơn vị điện tích hạt nhân là 6 đều thuộc nguyên tố carbon dù chúng có thể có số neutron khác nhau.
Ví dụ 2: Cho các nguyên tử sau: B (Z = 8, A = 16), D (Z = 7, A = 14), E (Z = 9, A = 19), F (Z = 8, A = 18).
Trong các nguyên tử trên, nguyên tử B và F thuộc cùng một nguyên tố hóa học vì có cùng số đơn vị điện tích hạt nhân (Z = 8).
II. Kí hiệu nguyên tử
Số đơn vị điện tích hạt nhân nguyên tử của một nguyên tố hóa học (còn được gọi là số hiệu nguyên tử (Z) của nguyên tố đó) và số khối (A) là những đặc trưng cơ bản của một nguyên tử.
Khi viết kí hiệu nguyên tử, đặt hai chỉ số đặc trưng ở bên trái kí hiệu nguyên tố, trong đó số hiệu nguyên tử Z ở phía dưới và số khối A ở phía trên.
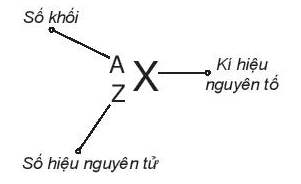
Ví dụ 1: Kí hiệu nguyên tử helium là . Cho biết:
+ Nguyên tử helium có kí hiệu là He.
+ Số hiệu nguyên tử helium là Z = 2 = số proton = số electron.
+ Số khối của nguyên tử helium là A = 4.
A = Z + N Số neutron = N = A – Z = 4 – 2 = 2.
Ví dụ 2: Nguyên tử nitrogen có 7 proton và 7 neutron.
Ta có:
+ Số hiệu nguyên tử Z = số proton = 7.
+ Số khối của nguyên tử nitrogen là A = Z + N = 7 + 7 = 14.
Kí hiệu nguyên tử nitrogen là .
III. Đồng vị
Đồng vị là những nguyên tử có cùng số đơn vị điện tích hạt nhân (cùng số proton) nhưng có số neutron khác nhau.
Ví dụ 1: Mô hình cấu tạo nguyên tử các đồng vị của nguyên tố hydrogen.
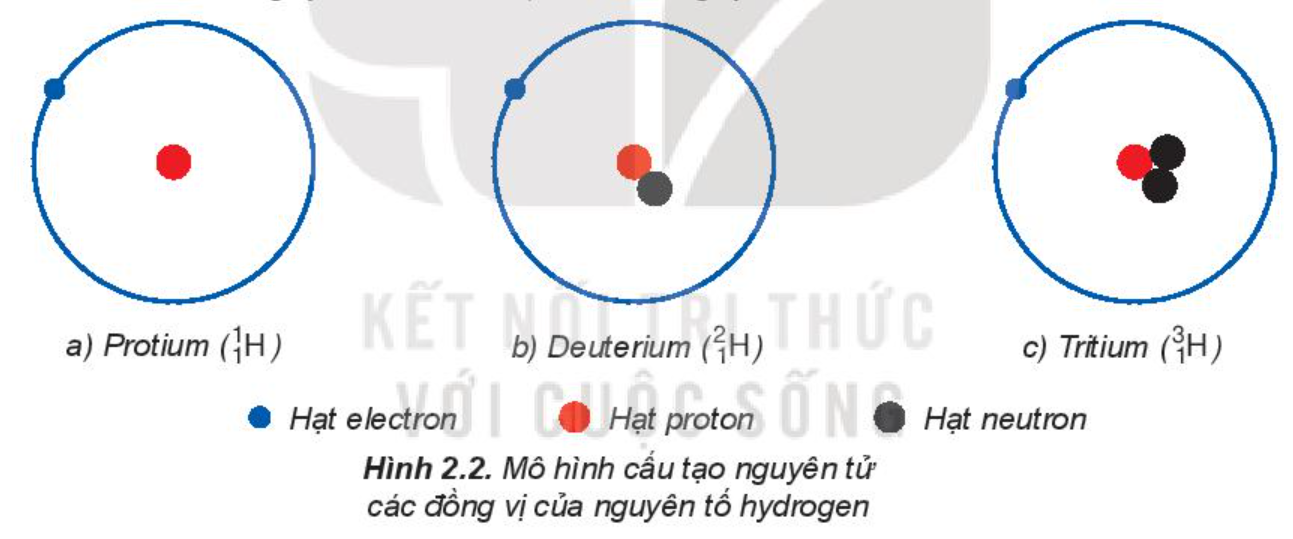 Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
Các đồng vị khác nhau về số neutron nên khác nhau về khối lượng của hạt nhân nguyên tử, đồng thời khác nhau về một số tính chất vật lí.
Ví dụ 2: Ở dạng đơn chất, đồng vị có tỉ khối lớn hơn, nhiệt độ nóng chảy và nhiệt độ sôi cao hơn đồng vị .
IV. Nguyên tử khối
1. Nguyên tử khối
Nguyên tử khối là khối lượng của nguyên tử, cho biết khối lượng của nguyên tử đó nặng gấp bao nhiêu lần đơn vị khối lượng nguyên tử. Do khối lượng proton và neutron đều xấp xỉ 1,0 amu, còn khối lượng electron nhỏ hơn rất nhiều (0,00055 amu), nên có thể coi khối lượng nguyên tử xấp xỉ số khối.
Ví dụ: Nguyên tử của nguyên tố potassium có 19 proton và 20 neutron.
Nguyên tử khối của potassium là A = 19 + 20 = 39.
2. Nguyên tử khối trung bình
Nguyên tử khối của một nguyên tố là nguyên tử khối trung bình (kí hiệu ) của hỗn hợp các đồng vị của nguyên tố đó.
Biểu thức tổng quát tính nguyên tử khối trung bình ():
Trong đó, là nguyên tử khối trung bình; X và Y, … lần lượt là nguyên tử khối của các đồng vị X và Y, …; a và b, … lần lượt là % số nguyên tử của các đồng vị X và Y, …
Ví dụ 1: Trong tự nhiên, nguyên tố chlorine có hai đồng vị bền là (chiếm 75,77%) và (chiếm 24,23% số nguyên tử).
Nguyên tử khối trung bình của chlorine: .
Ví dụ 2: Nguyên tử khối trung bình của copper bằng 63,546. Copper tồn tại trong tự nhiên dưới hai dạng đồng vị và . Tính phần trăm số nguyên tử của đồng vị tồn tại trong tự nhiên.
Hướng dẫn:
Gọi phần trăm số nguyên tử của đồng vị và lần lượt là x (%) và y (%).
Ta có: x + y = 100 (*).
Nguyên tử khối trung bình của copper: (**).
Từ (*) và (**), suy ra: x = 72,7 và y = 27,3.
Sơ đồ tư duy Lý thuyết Nguyên tố hóa học
Xem thêm một số kiến thức liên quan:
Lý thuyết Nguyên tố hóa học (Chân trời sáng tạo) hay, chi tiết | Hóa học 10
20 câu Trắc nghiệm Nguyên tố hóa học (Chân trời sáng tạo) có đáp án – Hóa học lớp 10
Hợp chất X có công thức đơn giản nhất là . tỉ khối hơi của X so với hiđro bằng 30. Công thức phân tử của X là
Kết quả phân tích nguyên tố hợp chất X cho biết % = 54,54% ; % = 9,09% còn lại là oxi. Tỉ khối hơi của X so với bằng 2. Công thức phân tử của X là
Đốt cháy hoàn toàn 7,4 gam hợp chất hữu cơ X ( C, H, O ) thu được 6,72 lít (đktc) và 5,4 gam . Khi hóa hơi 1,85 gam X, thu được thể tích bằng với thể tích của 0,7 gam cùng nhiệt độ, áp suất. Xác định công thức phân tử của X
Thể tích của 1,5 gam chất X bằng thể tích của 0,8 gam khí oxi (đktc cùng điều kiện nhiệt độ, áp suất). Phân tử khối của X là
Khi đốt 1 lít khí X cần 6 lít thu dược 4 lít và 5 lít hơi (có thể tích khí đo ở cùng điều kiện nhiệt độ, áp suất). Công thức phân tử của X là
Một hiđrocabon X ở thể khí có tỉ khối hơi so với hiđro là 15. Công thức phân tử của X là:
Phân tích chất hữu cơ X chứa C, H, O ta có:
: : = 2,24 : 0,357 : 2. Công thức đơn giản nhất của X là
Đốt cháy hoàn toàn 100ml hơi chất A, cần dùng 250ml , chỉ tạo ra 200ml và 200ml hơi nước( các thể tích đo cùng điều kiện). Công thức phân tử của A là:
Oxi hóa hoàn toàn 4,92g một hợp chất A chứa C, H, O, N rồi cho sản phẩm lần lượt qua bình chứa đậm đặc, bình chứa KOH thì thấy khối lượng bình chứa đặc tăng thêm 1,81g, bình chứa KOH tăng thêm 10,56g. Ở thí nghiệm khác, khi nung 6,15g hợp chất A với CuO thì thu được 0,55l (đktc) khí . Hàm lượng phần trăm của Oxi trong A là bao nhiêu?
Vitamin A (retinol) có công thức phân tử , công thức đơn giản nhất của vitamin A là:
Đốt cháy 3,7g chất hữu cơ X ( C, H,O) dùng vừa đủ 6,72 lít oxi (đktc) và thu được 0,25 mol . Công thức phân tử của X là: (biết 70 < < 83)
Hợp chất A chứa các nguyên tố C, H, O. Khi đốt A cần dùng một lượng oxi bằng 8 lần lượng oxi của nó và thu được lượng khí và theo tỉ lệ khối lượng so với khối lượng nước = 22/9. Công thức đơn giản nhất của A là
Đốt cháy hoàn toàn 4,4 gam hợp chất hữu cơ X (C, H, O) thu được 4,48 lít (đktc) và 3,6 gam . Biết tỉ khối của X so với bằng 2. Công thức phân tử của X là
Hợp chất hữu cơ X ( C, H, O N) có công thức trùng với công thức đơn giản nhất, đốt cháy hoàn toàn 7,5 gam X, thu được 4,48 lít ; 1,12 lít (các khí đều đo (đktc)) và 4,5 gam . Số nguyên tử hiđro trong một phân tử X là