Một bình kín có dung tích là 0,5 L chứa 1,5 mol H2 và 0,5 mol N2 ở nhiệt độ xác định, ở trạng thái cân bằng có 0,2 mol NH3 tạo thành. Tính hằng số cân bằng Kc của phản ứng xảy ra trong bình.
 Giải bởi Vietjack
Giải bởi Vietjack
Nồng độ của N2 ban đầu là = 1 (M).
Nồng độ của H2 ban đầu là .
N2 (g) + 3H2 (g) 2NH3(g)
Ban đầu: 1 3 (M)
Phản ứng: 0,2 0,6 0,4 (M)
Cân bằng: 0,8 2,4 0,4 (M)
b) Tại sao nitrogen phản ứng được với nhiều kim loại, nhưng trong vỏ Trái Đất không gặp một nitride (N3-) kim loại nào cả?
Tại sao ở điều kiện thường (25 °C, 1 bar), nitrogen tồn tại ở dạng phân tử N2 trong khi đó phosphorus lại tồn tại ở dạng P4 mà không xảy ra trường hợp ngược lại? Biết:
- Năng lượng liên kết ba N ≡ N là 941 kJ/mol.
- Năng lượng liên kết ba P ≡ P là 490 kJ/mol.
- Năng lượng liên kết đơn N-N là 160 kJ/mol.
- Năng lượng liên kết đơn P-P là 209 kJ/mol.
a) Tại sao nitrogen là phi kim mạnh lại tồn tại được trong tự nhiên dưới dạng tự do?
Viết phản ứng chứng minh nitrogen hoạt động hoá học ở nhiệt độ cao.
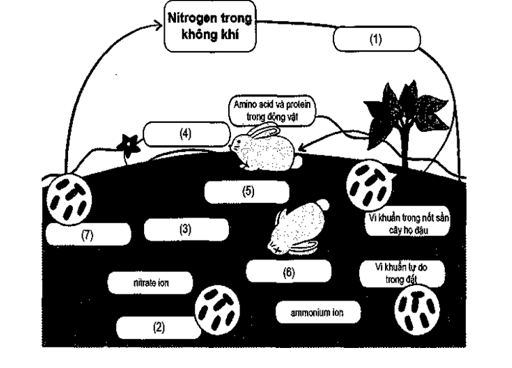
Xác định cụm từ phù hợp trong các ô từ (1) đến (7) để hoàn thành chu trình của nitrogen trong tự nhiên.