Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Lý thuyết, bài tập về Rượu etylic có đáp án môn Hóa học lớp 9, tài liệu bao gồm 6 trang, đầy đủ lý thuyết, phương pháp giải chi tiết và bài tập có đáp án (có lời giải), giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi môn Hóa học sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
Hóa học 9 Bài 44: Rượu etylic
A. Lý thuyết Rượu etylic
– Công thức phân tử: C2H5OH
– Nguyên tử khối: 46
I. Tính chất vật lý
1) Khái niệm
– Rượu etylic(ancol etylic hoặc etanol) là chất lỏng không màu, sôi ở 78,3oC
– Nhẹ hơn nước và tan vô hạn trong nước. Rượu etylic hòa tan được nhiều chất như iot, benzen, …
2) Độ rượu và cách tính độ rượu
– Độ rượu là số ml rượu etylic nguyên chất có trong 100 ml hỗn hợp rượu etylic với nước.
- Công thức: Độ rượu =
V là thể tích đo bằng ml hoặc lít
- Vd: 100ml rượu 450 chứa 45ml rượu nguyên chất
- mC2H5OH=VC2H5OH. DC2H5OH
Trong đó:
VC2H5OHlà thể tích dung dịch C2H5OH nguyên chất, đơn vị: ml
Vdd (C2H5OH+H2O) là thể tích dung dịch rượu (gồm C2H5OH và H2O), đơn vị: ml
D là khối lượng riêng, thường có đơn vị là g/ml.
- mH2O=VH2O.DH2O=VH2O.1 (vì DH2O≈1g/ml)
* Khi cho hỗn hợp ancol và nước phản ứng với kim loại kiềm thì nước phản ứng trước.
II. Cấu tạo phân tử
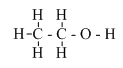
– Công thức cấu tạo thu gọn: CH3 – CH2 – OH (C2H5-OH)
- CT tổng quan của ancol CnH2n+1OH
– Trong phân tử, rượu etylic có một nguyên tử H không kiên kết với nguyên tử C mà liên kết với nguyên tử oxi tạo ra nhóm –OH. Chính nhóm –OH này làm cho rượu có tính chất hóa học đặc trưng.
III. Tính chất hóa học
1) Phản ứng cháy
– Rượu etylic cháy với ngọn lửa màu xanh, tỏa nhiều nhiệt
C2H5OH + 3O2 → 2CO2 + 3H2O
2) Tác dụng với kim loại mạnh như K, Na
–Thả mẩu natri vào cốc đựng rượu etylic, mẩu natri tan dần và có bọt khí thoát ra
2C2H5OH + 2Na → 2C2H5ONa + H2↑
n H2 = ½ nancol
3) Phản ứng với axit axetic
– Đổ rượu etylic vào cốc đựng axit axetic với xúc tác H2SO4 đặc, tạo thành dung dịch đồng nhất. Đun nóng hỗn hợp một thời gian, trong ống nghiệm xuất hiện chất lỏng không màu, mùi thơm, không tan trong nước, nổi trên mặt nước.
C2H5OH+CH3COOH → CH3COOC2H5 + H2O
etylic axit axetic etylaxetat (este)
IV. Ứng dụng
– Rượu etylic được dùng làm nhiên liệu cho động cơ ô tô, cho đèn cồn trong phòng thí nghiệm.
– Làm nguyên liệu sản xuất axit axetic, dược phẩm, cao su tổng hợp.
– Dùng để pha chế các loại rượu uống.
V. Điều chế
– Phương pháp 1: Điều chế rượu làm đồ uống
Tinh bột hoặc đường glucozơ rượu etylic
PTHH: C6H12O6 → 2CO2 + 2C2H5OH
– Phương pháp 2: Sản xuất rượu phục vụ ngành công nghiệp
Cho etilen cộng hợp với nước có axit làm xúc tác
CH2=CH2 + H2O → C2H5OH
4. 450, 180, 120
a, giải thích ý nghĩa.
b, tính số ml rượu có trong 500ml rượu 450
c. có thể pha được bn lít rượu 250 từ 500ml rượu 450
100 ml có 45 ml rượu
500ml có 45*500/100 = 225ml rượu
ml ruwouj có 225 ml rượu nguyên chất
100 ml có 25 ml nguyên chất
225*100/25 =900 ml
B. Trắc nghiệm Rượu etylic
Câu 1: Độ rượu là
A. số mol rượu etylic có trong 100ml hỗn hợp rượu với nước.
C. số ml rượu etylic có trong 1000ml hỗn hợp rượu với nước
B. số l rượu etylic có trong 100ml hỗn hợp rượu với nước.
D. số ml rượu etylic có trong 100ml hỗn hợp rượu với nước.
Câu 2: Công thức cấu tạo thu gọn của rượu etylic là:
A. CH3-CH2-OH B. CH3-O-CH3
C. CH3OH D. CH3-O-C2H5
Câu 3: Số ml rượu etylic có trong 500 ml rượu 400 là:
A. 20ml B. 200ml
C. 2ml D. 0,2ml
Gọi số ml rượu nguyên chất là x
40 = àx= 200ml
Câu 4: Đun nóng axit axetic với rượu etylic có axit sunfuric làm xúc tác thì người ta thu được một chất lỏng không màu, mùi thơm, không tan trong nước và nổi trên mặt nước. Sản phẩm đó là
A. đimetyl ete B. etyl axetat
C. rượu etylic D. metan
Câu 5: Cho 18 gam một ancol (X) thuộc dãy đồng đẳng của ancol etylic tác dụng với natri dư thu được 3.36 dm3 khí H2 (đktc). Công thức phân tử của (X) là:
A. CH4O B. C2H6O C. C3H8O D. C4H10O
nancol = 2nH2 = 2*0,15= 0,3 mol
M = 18/0,3 = 60
Câu 6: Ancol etylic phản ứng được với natri vì?
A. Trong phân tử có nguyên tử oxi
B. Trong phân tử có nguyên tử hidro và nguyên tử oxi
C. Trong phân tử có nguyên tử cacbon, hidro và oxi
D. Trong phân tử có nhóm -OH
Câu 7: Ancol etylic có khả năng tan tốt trong nước là do:
A. Ancol etylic tạo được liên kết hidro với nước
B. Ancol etylic uống được
C. Ancol etylic là chất lỏng
D. Ancol etylic chứa cacbon và hidro
Câu 8: Ancol etylic được điều chế từ nguồn nào sau đây?
A. Tinh bột B. Glucozo C. Etilen D. Cả ba đáp án trên
Câu 9: Trên nhãn chai ancol có ghi số 40. Ý nghĩa của con số ghi trên là:
A. Trong 100gam Ancol có 40 gam Ancol etylic nguyên chất
B. Nhiệt độ sôi của Ancol etylic là 40 độ C
C. Trong 100ml Ancol có 40 ml Ancol etylic nguyên chất
D. Nhiệt độ đông đặc của Ancol etylic à 40 độ C
Câu 10: Ancol etylic có lẫn một ít nước, có thể dùng chất nào sau đây để làm khan ancol?
A. CaO B. H2SO4 đặc C. CuSO4 khan D. Cả ba đáp án trên
Câu 11: Từ Ancol etylic người ta có thể điều chế được sản phẩm nào sau đây?
A. Axit axetic B. Cao su tổng hợp
C. Etyl axetat D. Cả ba đáp án trên đều đúng
Câu 12: Ancol etylic cháy theo phương trình phản ứng:
C2H6O + O2 → CO2 + H2O
Hệ số cân bằng của phương trình lần lượt là:
A. 2, 3, 4, 5 B. 2, 3, 2, 3
C. 1, 3, 2, 3 D. 1, 3, 3, 3
Câu 13: CTPT của ancol dạng C4H10O có bao nhiêu CTCT khác nhau?
A. 1 B. 2 C. 3 D. 4
CH3 – CH2 –CH2 – CH2 –O-H
CH3 - CH- CH2 -CH3
OH
CH3 - CH – CH2 - OH
CH3
OH
CH3 – C- CH3
CH3
Câu 14: Để đốt cháy hoàn toàn 0,1 mol ancol có công thức CnH2n+1OH thì cần 10,08 lít khí oxi (đktc). CTPT của ancol là:
A. CH3OH B. C2H5OH
C. C3H7OH D. C4H9OH
Câu 15: Hòa tan 84 gam Ancol etylic vào nước để được 300 ml dung dịch ancol. Biết Dancol = 0,8 g/cm3, Dnước = 1g/cm3 và thể tích không khí không hao hụt khi pha trộn/ Nồng độ phần trăm và độ ancol của dung dịch thu được là:
A. 30,11% và 35∘ B. 35,11% và 35∘
C. 40,11% và 30∘ D. 45,11% và 40∘
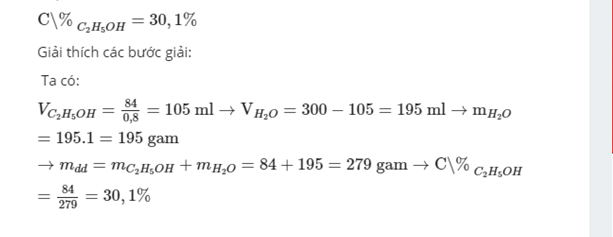
Độ cồn = 105/300 *100%= 35%