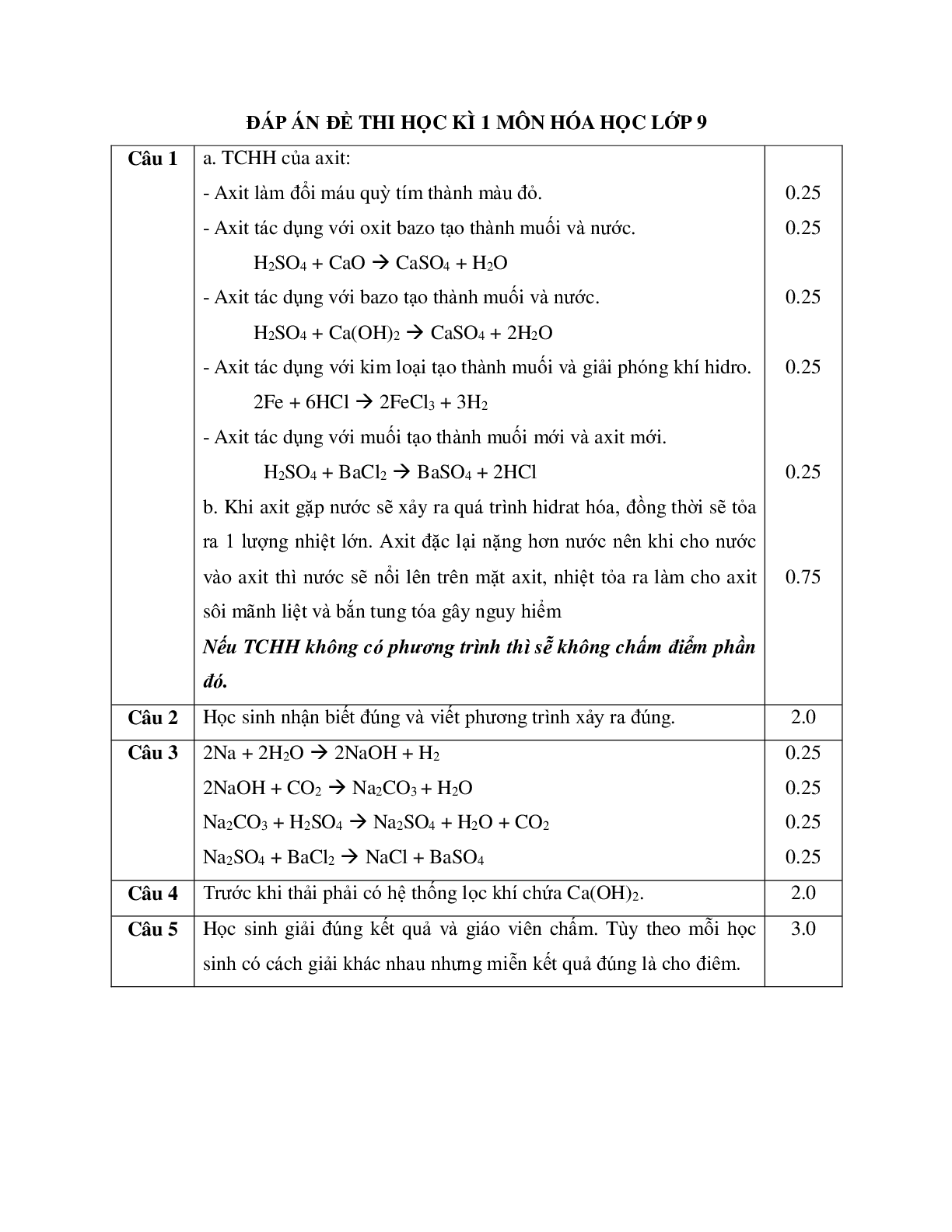
Tailieumoi.vn xin giới thiệu đến các quý thầy cô, các em học sinh đang trong quá trình ôn tập tài liệu Bộ 5 đề thi Học kì 1 Hóa học lớp 9 có đáp án, tài liệu bao gồm 21 trang, tuyển chọn 5 đề thi Hóa học lớp 9 Học kì 1. Tài liệu giúp các em học sinh có thêm tài liệu tham khảo trong quá trình ôn tập, củng cố kiến thức và chuẩn bị cho bài thi Học kì 1 môn Hóa lớp 9 sắp tới. Chúc các em học sinh ôn tập thật hiệu quả và đạt được kết quả như mong đợi.
Mời các quý thầy cô và các em học sinh cùng tham khảo và tải về chi tiết tài liệu dưới đây:
BỘ ĐỀ THI HỌC KÌ 1 MÔN HÓA HỌC LỚP 9 NĂM HỌC 2016 - 2017
ĐỀ SỐ 1
PHÒNG GIÁO DỤC VÀ ĐÀO TẠO CHÂU THÀNH
ĐỀ THI HỌC KÌ 1 NĂM HỌC 2016 - 2017
MÔN: HÓA HỌC LỚP 9
Thời gian làm bài: 45 phút
Câu 1: (2.0 điểm)
a. Trình bày tính chất hóa học của axit. Viết phương trình hóa học minh họa.
b. Hãy giải thích vì sao trong bất cứ hoàn cảnh nào cũng không được cho axit đậm đặc vào nước.
Câu 2: (2.0 điểm)
Phân biệt các dung dịch sau bằng phương pháp hóa học:
a. HNO3, HCl, BaCl2, NaOH
b. Al, Fe, Cu
Câu 3: (1.0 điểm)
Hoàn thành chuỗi phản ứng sau:
Na -> NaOH -> Na2CO3 -> Na2SO4 -> NaCl
Câu 4: (2.0 điểm)
Sau một lần đi tham quan nhà máy, khi về lớp làm bài tập tường trình thầy giáo có đặt ra một câu hỏi thực tế: “Khí SO2 và CO2 do nhà máy thải ra gây ô nhiễm không khí rất nặng. Vậy em hãy nêu lên cách để loại bỏ bớt lượng khí trên trước khi thải ra môi trường”. Bạn Ân cảm thấy rất khó và không biết cách trả lời em hãy hỗ trợ bạn ấy để giải quyết câu hỏi này.
Câu 5: (3.0 điểm)
Biết 2,24 lít khí Cacbonic (đktc) tác dụng hết với 200 ml dung dịch Ba(OH)2, sản phẩm thu được là muối trung hòa và nước.
a. Viết phương trình xảy ra.
b. Tính nồng độ mol của dung dịch Ba(OH)2 cần dùng.
c. Tính khối lượng kết tủa thu được.
ĐỀ KIỂM TRA HỌC KỲ I NĂM HỌC 2016 - 2017
Môn: Hóa học - Lớp 9
Thời gian làm bài: 45 phút (không kể thời gian giao đề)
Cho biết nguyên tử khối (theo đvC) của các nguyên tố:
Fe = 56; Cu = 64; S = 32; H = 1; O = 16; Zn = 65; Ag = 108; N = 14; Ba = 137; Cl = 35,5
I. Trắc nghiệm (2,0 điểm). Chọn đáp án đúng nhất trong các phương án trả lời sau.
Câu 1. Phương trình hóa học nào sau đây không đúng?
A. 2Fe + 3Cl2 -> 2FeCl3 B. 2CO2 + Ca(OH)2 -> Ca(HCO3)2
C. 2NaCl + H2SO4 -> Na2SO4 + 2HCl D. Fe + CuSO4 -> FeSO4 + Cu
Câu 2. Ngâm một lá Zn dư vào 200 ml dung dịch AgNO3 1M. Khi phản ứng kết thúc khối lượng Ag thu được là:
A. 6,5 gam. B. 10,8 gam. C. 13 gam. D. 21,6 gam.
Câu 3. Có các chất đựng riêng biệt trong mỗi ống nghiệm sau đây: Al, Fe, CuO, CO2, FeSO4, H2SO4. Lần lượt cho dung dịch NaOH vào mỗi ống nghiệm trên. Dung dịch NaOH phản ứng với:
A. Al, CO2, FeSO4, H2SO4 B. Fe, CO2, FeSO4, H2SO4
C. Al, Fe, CuO, FeSO4 D. Al, Fe, CO2, H2SO4
Câu 4. Kim loại X có những tính chất hóa học sau:
- Phản ứng với oxit khi nung nóng.
- Phản ứng với dung dịch AgNO3.
- Phản ứng với dung dịch H2SO4 loãng giải phóng khí H2 và muối của kim loại hóa trị II. Kim loại X là:
A. Cu. B. Fe. C. Al. D. Na.
II. Tự luận (8,0 điểm).
Câu 5. Viết phương trình hóa học hoàn thành chuỗi biến hóa sau, ghi rõ điều kiện (nếu
có).
Al ->Fe ->FeCl3 ->Fe(OH)3 ->Fe2O3.
Câu 6. Bằng phương pháp hóa học nhận biết các dung dịch sau: NaOH, H2SO4, Na2SO4, HCl. Viết phương trình hóa học (nếu có).
Câu 7. Cho m gam hỗn hợp X gồm Fe và Cu vào dung dịch H2SO4 loãng, dư thu được 4,48 lít khí (đktc) và thấy còn 8,8 gam chất rắn không tan. Lấy phần chất rắn không tan ra thu được 250 ml dung dịch Y.
a) Xác định phần trăm về khối lượng các chất trong X.
b) Dung dịch Y tác dụng vừa đủ với BaCl2 thu được 69,9 gam kết tủa. Tính nồng độ mol các chất trong Y.
c) Nếu cho 12 gam X vào 300 ml dung dịch AgNO3 0,8M. Sau một thời gian thu được 28 gam chất rắn Z. Tính khối lượng của Ag có trong Z?
ĐỀ SỐ 3
|
PHÒNG GD&ĐT CHÂU THÀNH |
ĐỀ THI HỌC KÌ 1 NĂM HỌC 2016 - 2017 MÔN: HÓA HỌC LỚP 9 Thời gian làm bài: 45 phút |
Câu 1: Cho 1,84g hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lít CO2 ở đktc và dung dịch X. khối lượng muối trong dung dịch X là:
A. 1,17(g) B. 2,17(g) C. 3,17(g) D. 4,17(g)
Câu 2: Trong tự nhiên muối natri clorua có nhiều trong:
A. Nước giếng. B. Nước mưa. C. Nước sông. D. Nước biển. Câu 3: Trộn dung dịch có chứa 0,1mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
A. 4 g B. 8 g C. 6 g D. 12 g
Câu 4: Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là:
A. 141,18 g. B. 94,12 g. C. 100g. D. 90g.
Câu 5: Muốn pha loãng axit sunfuric đặc ta phải:
A. Rót nhanh axit đặc vào nước. B. Rót từ từ axit đặc vào nước.
C. Rót từ từ nước vào axit đặc. D. Rót nước vào axit đặc.
Câu 6: Khử hoàn toàn 6,4 gam hỗn hợp CuO và Fe2O3 bằng khí hiđro ở nhiệt độ cao, thấy tạo thành 1,8 gam nước. Khối lượng hỗn hợp kim loại thu được là
A. 4,5 gam. B. 4,8 gam. C. 4,9 gam. D. 5,2 gam.
Câu 7: Khối lượng quặng hematit chứa 90% Fe2O3 cần thiết để sản xuất được 1 tấn gang chứa 95% Fe. Biết hiệu suất của quá trình là 80% là:
A. 1884,92 Kg B. 1357,41 kg C. 1696,425Kg D. 2000 kg
Câu 8: Cho 3,2 gam hỗn hợp CuO và Fe2O3 tác dụng hết với dung dịch HCl thu được 2 muối có tỉ lệ số mol là 1: 1. Số mol HCl đã tham gia phản ứng là:
A. 0,1 mol B. 0,25 mol C. 0,2 mol D. 0,15 mol
Câu 9: Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng:
A. Dung dịch BaCl2. B. Dung dịch Pb(NO3)2.
C. Dung dịch HCl. D. Dung dịch AgNO3.
Câu 10: Nhóm bazơ vừa tác dụng được với dung dịch HCl, vừa tác dụng được với dung dịch KOH.
A. Ba(OH)2 và NaOH B. NaOH và Cu(OH)2
C. Al(OH)3 và Zn(OH)2 D. Zn(OH)2 và Mg(OH)2
Câu 11: Trong các chất sau đây chất nào chứa hàm lượng sắt nhiều nhất?
A. FeO B. FeS2 C. Fe2O3 D. Fe3O4
Câu 12: Có ba lọ không nhãn, mỗi lọ đựng một dung dịch các chất sau: NaOH, Ba(OH)2, NaCl. Thuốc thử để nhận biết cả ba chất là:
A. Quỳ tím và dung dịch HCl B. Phenolphtalein và dung dịch BaCl2
C. Quỳ tím và dung dịch K2CO3 D. Quỳ tím và dung dịch NaCl
Câu 13: Cho 5,6 gam sắt tác dụng với 5,6 lít khí Cl2 (đktc). Sau phản ứng thu được một lượng muối clorua là:
A. 16,20 g. B. 15,25 g. C. 17,25 g. D. 16,25 g.
Câu 14: Nung nóng 16,5 gam hỗn hợp hai bazơ không tan là Mg(OH)2 và Fe(OH)3 đến khối lượng không đổi, chất rắn còn lại có khối lượng 12 gam. Thành phần phần trăm mỗi bazơ trong hỗn hợp lần lượt là:
A. 35,15% ; 64,85%. B. 34,15% ; 65,85%. C. 64,85% ; 35,15 %. D. 65,85% ;
34,15%.
Câu 15: Cho 0,2 mol Canxi oxit tác dụng với 500ml dung dịch HCl 1M. Khối lượng muối thu được là:
A. 2,22 g B. 22,2 g C. 22,3 g D. 23,2 g
Câu 16: Cho 8,1g một kim loại (hoá trị III) tác dụng với khí clo có dư thu được 40,05g muối. Xác định kim loại đem phản ứng:
A. Au B. Cr C. Al D. Fe
Câu 17: Trong các kim loại sau đây, kim loại có độ cứng lớn nhất là:
A. Crom (Cr) B. Nhôm ( Al ) C. Sắt ( Fe ) D. Natri (Na )
Câu 18: Nhóm chất tác dụng với dung dịch H2SO4 loãng sinh ra chất kết tủa màu trắng:
A. CuO, BaCl2 B. Ba(OH)2, ZnO C. BaCl2, Ba(NO3)2 D. ZnO, BaCl2
Câu 19: Trong các loại phân bón sau, loại phân bón nào có lượng đạm cao nhất?
A. NH4Cl B. NH4NO3 C. (NH4)2SO4 D. (NH2)2CO Câu 20: Cho 2,24 lít khí CO2 ( đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch Ca(OH)2, chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là:
A. 0,5M B. 0,25M C. 0,1M D. 0,05M
Câu 21: Cho sơ đồ sau:
![]()
![]() X
X
![]() Z Y
Z Y
Thứ tự X, Y, Z phù hợp với dãy chất:
A. Cu(OH)2, CuO, CuCl2 B. CuO, Cu(OH)2, CuCl2
C. Cu(NO3)2, CuCl2, Cu(OH)2 D. Cu(OH)2, CuCO3, CuCl2
Câu 22: Có thể dùng dung dịch HCl để nhận biết các dung dịch không màu sau đây:
A. KOH, AgNO3, NaCl B. NaOH, Na2CO3, NaCl
C. Na2CO3, Na2SO4, KNO3 D. NaOH, Na2CO3, AgNO3
Câu 23: Để làm sạch một mẫu kim loại đồng có lẫn sắt và kẽm kim loại, có thể ngâm mẫu đồng này vào dung dịch:
A. FeCl2 dư. B. AlCl3 dư. C. ZnCl2 dư. D. CuCl2 dư.
Câu 24: 0,5mol CuO tác dụng vừa đủ với:
A. 0,25mol HCl. B. 0,5mol HCl. C. 0,1mol H2SO4. D. 0,5mol H2SO4.
Câu 25: Khi đốt cháy các chất có phải luôn luôn tạo thành oxit không?
A. Không phải luôn luôn B. Chỉ khi đốt cháy đơn chất
C. Luôn luôn. D. Chỉ khi đốt cháy hợp chất
Câu 26: Trong các oxit sau: SO2; CuO; P2O5; N2O5, oxit bazơ là:
A. SO2 B. P2O5 C. CuO D. N2O5
Câu 27: Nhôm được sản xuất theo phương trình nào sau đây:
A. Al2O3 + 3CO
¾ t¾0 ® 2Al + 3CO B. Al O + 3H
¾t¾0 ® 2Al + 3H O
|
|
|
Câu 28: Một oxit của photpho có thành phần phần trăm của P bằng 43,66%. Biết phân tử
khối của oxit bằng 142đvC. Công thức hoá học của oxit là:
A. PO2. B. P2O5. C. P2O4. D. P2O3.
Câu 29: Kim loại được dùng làm vật liệu chế tạo vỏ máy bay do có tính bền và nhẹ, đó là kim loại:
A. Na B. Zn C. Al D. K
Câu 30: Đun nóng 6,.4 g lưu huỳnh và 1,3 g kẽm. Sau phản ứng thu được các chất với khối lượng là:
A. 2,17g Zn và 0,89 g S B. 5,76 g S và 1,94 g ZnS
C. 2,12 g ZnS D. 7,7 g ZnS
Câu 31: Cho sơ đồ sau: Cacbon -> X1 -> X2 -> X3 -> Ca(OH)2. Trong đó X1, X2, X3 lần lượt là:
A. CO2, Ca(HCO3)2, CaCO3 B. CO2, CaCO3, CaO
C. CO, CO2, CaCl2 D. CO2, CaO, CaCl2
Câu 32: Dãy kim loại tác dụng được với dung dịch Cu(NO3)2 tạo thành Cu kim loại:
A. Al, Zn, Fe B. Zn, Pb, Au C. Mg, Fe, Ag D. Na, Mg, Al
Câu 33: Giấy qùi tím chuyển sang màu đỏ khi nhúng vào dung dịch được tạo thành từ:
A. 1,5 mol Ca(OH)2 và 1,5 mol HCl B. 1 mol HCl và 1 mol KOH
C. 1 mol H2SO4 và 1,7 mol NaOH D. 0,5 mol H2SO4 và 1,5 mol NaOH
Câu 34: Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat. Hiện tượng xảy ra là:
A. Không có hiện tượng gì cả.
B. Bạc được giải phóng, nhưng sắt không biến đổi.
C. Không có chất nào sinh ra, chỉ có sắt bị hoà tan.
D. Sắt bị hoà tan một phần, bạc được giải phóng.
Câu 35: Cặp oxit phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ là:
A. Al2O3, CuO. B. K2O, Fe2O3. C. ZnO, MgO. D. Na2O, K2O. Câu 36: Hấp thụ hoàn toàn 11,2 lít khí CO2 (đktc) bằng một dung dịch chứa 20 g NaOH. Muối được tạo thành là:
A. Hỗn hợp Na2CO3 và NaHCO3. B. NaHCO3.
C. Na2CO3. D. Na(HCO3)2.
Câu 37: Nhôm phản ứng được với:
A. Oxit bazơ, Khí hidrô, dung dịch bazơ, dung dịch axit
B. Oxit axit, Khí clo, dung dịch bazơ, dung dịch axit
C. Khí oxi, Khí hidrô, dung dịch bazơ, dung dịch axit
D. Khí oxi, Khí clo, dung dịch bazơ, dung dịch axit
Câu 38: Đốt cháy hoàn toàn 2,4 g cacbon, cho toàn bộ khí CO2 thu được vào dung dịch Ca(OH)2 dư thì khối lượng dung dịch Ca(OH)2
A. Tăng 8,8 g B. Giảm 20 g
C. Không đổi D. Giảm 11,2 g
Câu 39: Từ 80 tấn quặng pirit sắt (FeS2) chứa 40% lưu huỳnh, sản xuất được 92 tấn axit sunfuric. Hiệu suất của quá trình sản xuất là:
A. 100% B. 95,88% C. 93,88% D. 88,88%.
Câu 40: Để điều chế dung dịch Ba(OH)2, người ta cho:
A. BaO tác dụng với dung dịch HCl
B. BaCl2 tác dụng với dung dịch Na2CO3
C. BaO tác dụng với dung dịch H2O
D. Ba(NO3)2 tác dụng với dung dịch Na2SO4
|
Câu |
Đáp án |
Câu |
Đáp án |
Câu |
Đáp án |
Câu |
Đáp án |
|
1 |
B |
11 |
A |
21 |
A |
31 |
B |
|
2 |
D |
12 |
C |
22 |
D |
32 |
A |
|
3 |
B |
13 |
D |
23 |
D |
33 |
C |
|
4 |
B |
14 |
A |
24 |
D |
34 |
D |
|
5 |
B |
15 |
B |
25 |
A |
35 |
D |
|
6 |
B |
16 |
C |
26 |
C |
36 |
B |
|
7 |
A |
17 |
A |
27 |
C |
37 |
D |
|
8 |
A |
18 |
C |
28 |
B |
38 |
D |
|
9 |
A |
19 |
D |
29 |
C |
39 |
C |
|
10 |
C |
20 |
A |
30 |
B |
40 |
C |
ĐỀ SỐ 4
![]()
|
UBND THÀNH PHỐ MÓNG CÁI PHÒNG GIÁO DỤC VÀ ĐÀO TẠO |
ĐỀ KIỂM TRA HỌC KÌ I NĂM HỌC 2016 - 2017 MÔN: HOÁ HỌC 9 Thời gian làm bài: 45 phút |
1. Dãy các kim loại nào sau đây được sắp xếp theo chiều hoạt động hóa học giảm dần?
A. Cu, Ag, Fe, Al, Mg, K B. K, Mg, Al, Fe, Cu, Ag.
C. Ag, Cu, Fe, Al, Mg, K. D. K, Mg, Al, Cu, Ag, Fe.
2. Chỉ dùng một thuốc thử nào sau đây có thể phân biệt đồng thời các chất khí để riêng biệt: Oxi, Clo, Hiđro chorua?
A. Dung dịch axit clohiđric. B. Dung dịch bạc nitrat.
C. Dung dịch bari clorua. D. Quỳ tím ẩm.
3. Cặp chất nào sau đây phản ứng tạo ra dung dịch có màu vàng nâu?
A. Fe và dung dịch HCl. B. CuO và dung dịch HNO3.
C. Fe(OH)3 và dung dịch H2SO4. D. Fe(OH)2 và dung dịch H2SO4.
4. Khí CO được dùng làm chất đốt trong công nghiệp bị lẫn các tạp chất là các khí CO2, SO2, Cl2, HCl. Để làm sạch khí CO người ta dùng .....
A. dung dịch Ca(OH)2 dư. B. dung dịch NaCl dư.
C. dung dịch HCl dư. D. nước dư.
5. Cho từ từ dung dịch NaOH vào dd FeCl3, lọc lấy kết tủa nung trong không khí đến khối lượng không đổi thu được chất rắn A. Chất rắn A là:
A. Fe(OH)2 B. Fe2O3 C. FeO D. Fe3O4
6. Dung dịch nhôm clorua bị lẫn tạp chất là dung dịch CuCl2 và ZnCl2. Dùng chất nào sau đây để làm sạch dung dịch nhôm clorua?
A. Fe. B. Cu. C. Ag. D. Al.
Câu 2 (2,5 điểm).
Viết các phương trình hoá học thực hiện những chuyển đổi hoá học sau:
Cu ¾¾(1)®
CuO
¾¾( 2)® CuSO4 ¾¾(3)® CuCl2
¾¾( 4)®
Cu(NO3)2 ¾¾(5)®
Cu(OH)2
Câu 3 (4,0 điểm).
Cho 23,5 gam K2O vào nước để thu được 500 ml dung dịch bazơ.
a) Tính nồng độ mol của dung dịch bazơ thu được.
b) Tính khối lượng dung dịch H2SO4 20% cần để trung hòa dung dịch bazơ nói trên.
c) Nếu cho 100 ml dung dịch CuCl2 1M vào dung dịch bazơ nói trên thì thu được bao nhiêu gam kết tủa?
Câu 4 (0,5 điểm).
Tại sao không nên dùng những đồ vật bằng nhôm để đựng vôi tôi, vữa xây dựng? (Cho: K = 39, H = 1, Cu = 64, Cl = 35,5, S = 32, O = 16)
|
Câu |
Sơ lược đáp án |
Điểm |
|
|
1 - B |
0,5 x 6 |
|
|
2 - D |
|
|
1 |
3 - C |
|
|
|
4 - A |
|
|
|
5 - B |
|
|
|
6 - D |
|
|
2 |
to 1. 2 Cu + O2 ¾¾t ® 2 CuO 2. CuO + H2SO4 ® CuSO4 + H2O 3. CuSO4 + BaCl2 ® CuCl2 + BaSO4 4. CuCl2 + 2AgNO3 ® Cu(NO3)2 + 2 AgCl 5. Cu(NO3)2 + 2NaOH ® Cu(OH)2 + 2 NaNO3 |
0,5 x 5 |
|
|
a) nK O = 23,5/94 = 0,25 mol 2 |
0,25 |
|
|
PTHH: K2O + H2O ® 2 KOH (1) |
0,5 |
|
|
0,25 0,5 (mol) |
0,25 |
|
|
=> CM(NaOH) = 0,5/0,5 = 1M |
0,25 |
|
|
b) PTHH: 2 KOH + H2SO4 ® K2SO4 + 2 H2O (2) |
0,5 |
|
|
0,5 ® 0,25 (mol) |
0,25 |
|
3 |
m H SO = 0,25 . 98 = 24,5 g 2 4
mdd H SO = 24,5 . 100/20 = 122,5 g |
0,25 0,25 |
|
|
2 4 |
|
|
|
c) nCuCl = 0,1 . 1 = 0,1 mol 2
PTHH: CuCl2 + 2KOH ® Cu(OH)2 + 2 KCl (3) Ta có: nCuCl2 = 0,1 = 0,1 < nKOH = 0, 5 = 0, 25 1 1 2 2 => KOH dư, tính theo CuCl2. nCu(OH) = nCuCl = 0,1 mol 2 2
=> mCu(OH) = 0,1 . 98 = 9,8 g 2 |
0,25 |
|
|
0,5 |
|
|
|
0,25 |
|
|
|
0,25 |
|
|
|
0,25 |
![]()
![]()
![]()
![]()
|
4 |
Vì nhôm có thể phản ứng với Ca(OH)2 có trong vôi tôi, vữa xây dựng. |
0,5 |
Các chú ý khi chấm:
1. Hướng dẫn chấm này chỉ trình bày sơ lược một cách giải. Bài làm của học sinh phải chi tiết, lập luận chặt chẽ, tính toán chính xác mới được điểm tối đa.
2. Các cách giải khác nếu đúng vẫn cho điểm. Tổ chấm trao đổi và thống nhất điểm chi tiết nhưng không được vượt quá số điểm dành cho câu hoặc phần đó.
|
Trường ...................... Lớp ........................... Họ và tên ................. |
ĐỀ THI HỌC KÌ 1 NĂM HỌC 2016 - 2017 MÔN: HÓA HỌC LỚP 9 Thời gian làm bài 60 phút |
I. Phần trắc nghiệm: (4,0 điểm) Câu 1: Các chất nào sau đây là bazơ:
|
A) NaOH; BaO; KOH; Ca(OH)2 |
C) KOH, Cu(OH)2; Ca(OH)2 |
|
B) Ba(OH)2; MgCl2; Al(OH)3 |
D) HCl; H2SO4, HNO3 |
Câu 2: Các chất nào sau đây tan trong nước:
|
A) CuCl2; H2SO4; AgNO3 |
C) BaSO4; NaOH; K2SO3 |
|
B) S; NaNO3; KCl |
D) HBr; H2SiO3; K2CO3 |
Câu 3: Để phân biệt dung dịch Na2SO4và Na2CO3 ta dùng thuốc thử nào?
|
A) Dung dịch BaCl2 |
C) Dung dịch BaCO3 |
|
B) Dung dịch HCl |
D) Khí CO2 |
Câu 4: Cặp chất nào sau đây xảy ra phản ứng hoá học
|
A) CuCl2 và Na2SO4 |
C) BaCO3 và Cu(OH)2 |
|
B) HCl và BaSO4 |
D) Ca(OH)2 và K2CO3 |
Câu 5: Axit H2SO4 loãng phản ứng được với tất cả các chất nào sau đây:
|
A) Ag; CuO, KOH, Na2CO3 |
C) Mg, BaCl2, Al(OH)3, CuO |
|
B) Al, Fe3O4, Cu(OH)2; K2SO4 |
D) Na; P2O5, Mg(OH)2, CaSO3 |
Câu 6: Để nhận biết các chất rắn: Na2SO4; Ba(OH)2; NaOH cần ít nhất mấy hoá chất:
|
A) 1 |
B) 2 |
C) 3 |
D) 4 |
Câu 7: Các chất nào sau đây gồm cả oxit, axit, bazơ, muối:
|
A) P2O5; KMnO4; H2SO4; KCl |
B) CuO; HNO3; NaOH; CuS |
|
C) CuSO4; MnO2; H2S; H3PO4 |
D) CuCl2; O2; H2SO4; KOH |
Câu 8: Các chất nào sau đây phản ứng được với nước ở điều kiện thường:
|
A) P2O5; HCl; CaO; CO2 |
B) NaCl; KOH; Na2O; FeO |
|
C) BaO; K2O; CuO; SO2 |
D) CaO; Na2O; P2O5; SO3 |
Câu 9: Cặp chất nào sau đây có thể tồn tại đồng thời trong dung dịch:
|
A) NaNO3 và H2SO4 |
B) Na2CO3 và HCl |
|
C) H2SO4 và Na2SO3 |
D) BaCl2 và Na2SO4 |
Câu 10: Các chất nào sau đây có thể tác dụng được với dung dịch axit HCl:
|
A) Fe2O3; Cu; Mg(OH)2; AgNO3 |
B) Fe(OH)3; Na2SO4; K; MnO2 |
|
C) CuO; CaCO3; Ba; Al(OH)3 |
D) P2O5; KOH; Fe; K2CO3 |
Câu 11: Chất nào sau đây làm quỳ tím chuyển thành màu đỏ:
|
A) Dung dịch axit HCl |
B) Axit H2SiO3 |
|
C) Dung dịch NaOH |
D) Các đáp án A và B |
Câu 12: Chất nào có thể dùng để nhận biết axit sunfuric và cả muối sunfat
|
A) NaCl |
B) BaCl2 |
C) BaCO3 |
D) Cả B và C |
Câu 13: Dãy chất nào sau sắp xếp theo thứ tự: oxit, axit, bazơ, muối:
|
A) Na2O, HCl, Cu(OH)2, BaO |
B) P2O5; H2SO4, KOH, KMnO4 |
|
C) HNO3, CO2, Mg(OH)2, CuS |
D) CaCl2, H2S, NaOH, CuSO4 |
Câu 14: Cặp chất nào sau đây có thể phản ứng với nhau:
|
A) HCl và Na2SO4 |
B) NaOH và BaCl2 |
|
C) AgCl và NaNO3 |
D) H2SO4 và BaCO3 |
Câu 15: Có những khí sau: CO2, H2, O2, SO2. Khí nào làm đục nước vôi trong:
|
A) CO2, O2 |
B) CO2, H2, SO2 |
|
C) CO2, SO2 |
D) CO2, O2, H2 |
Câu 16: Để hòa tan hoàn toàn 5,1 gam oxit một kim loại hóa trị III người ta phải dùng 43,8 g dung dịch HCl 25%. Đó là oxit của kim loại:
|
A) Fe |
B) Al |
|
C) Kim loại khác |
D) Không xác định được |
Câu 17: Cho 1,84 hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lit CO2 (đktc) và dung dịch X. Khối lượng muối trong dung dịch X là:
|
A) 1,17g |
B) 3,17g |
C) 2,17g |
D) 4,17g |
Câu 18: Trộn 300 ml dung dịch HCl 0,5M với 200 ml dung dịch Ba(OH)2 nồng độ a M thì thu được 500 ml dung dịch trong đó nồng độ của axit HCl là 0,02M. Kết quả a có giá trị là (mol/lit):
|
A) 0,35 |
B) 1 |
C) 0,5 |
D) 1,2 |
Câu 19: Có 4 lọ không nhãn đựng một trong các dung dịch sau: MgCl2, BaCl2, HCl, H2SO4. Thuốc thử có thể nhận biết được cả 4 chất trên là:
|
A) H2O |
B) CO2 |
C) Na2SO4 |
D) Quỳ tím |
Câu 20: Cho 400g dung dịch BaCl2 5,2% vào dung dịch H2SO4 dư. Khối lượng chất kết tủa tạo thành sau phản ứng là:
|
A) 32,7g |
B) 11,2g |
C) 29,2g |
D) 23,3g |
Câu 1: Nêu hiện tượng xảy ra trong các trường hợp sau:
a) Cho đinh sắt vào dung dịch đồng (II) sunfat.
b) Cho dung dịch BaCl2 vào dung dịch H2SO4 loãng.
c) Cho vài giọt phenolphtalein vào dung dịch NaOH sau đó thêm dung dịch axit HCl dư.
Câu 2: Viết phương trình thực hiện chuyển đổi hoá học sau
Cu ¾(¾1)® CuO ¾(¾2)® CuCl2 ¾(¾3)® Cu(NO3)2 ¾(¾4)® Cu(OH)2 ¾(¾5)® CuO ¾(¾6)® Cu Câu 3: Hòa tan 25,9g hỗn hợp hai muối khan gồm NaCl và Na2SO4 vào nước thì thu đ- ược 200g dung dịch A. Cho dung dịch A vào dung dịch Ba(OH)2 20% vừa đủ, thấy xuất hiện 23,3g kết tủa, lọc bỏ kết tủa thu được dung dịch B.
a) Viết các phương trình hóa học.
b) Tính khối lượng mỗi muối khan trong hỗn hợp ban đầu.
c) Tính nồng độ phần trăm các chất có trong dung dịch B
Câu 4: Cho 8,3g hỗn hợp Al và Fe tác dụng hết với bình đựng dung dịch HCl. Sau phản ứng khối lượng bình dung dịch tăng lên 7,8g. Khối lượng muối tạo ra trong dung dịch là bao nhiêu?
Phần trắc nghiệm: 4,0 điểm: Mỗi ý đúng cho 0,2 điểm
|
Câu |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
8 |
9 |
10 |
|
Đáp án |
C |
A |
B |
D |
C |
B |
B |
D |
A |
C |
|
Câu |
11 |
12 |
13 |
14 |
15 |
16 |
17 |
18 |
19 |
20 |
|
Đáp án |
A |
B |
B |
D |
C |
B |
C |
A |
D |
D |
Câu 1: 1,5 điểm, mỗi câu đúng cho 0,5 điểm.
a) Đinh sắt bị hòa tan một phần, kim loại đồng màu đỏ bám ngoài đinh sắt, dung dịch nhạt màu dần:
PTHH: Fe + CuSO4 ® FeSO4 + Cu¯
b) Xuất hiện kết tủa trắng
PTHH: BaCl2 + H2SO4 ® BaSO4¯ + 2HCl
c) Dung dịch chuyển màu hồng sau đó trở lại không màu PTHH: HCl + NaOH ® NaCl + H2O
(1) Cu + O2
¾ t¾0 ® CuO
(2) CuO + HCl ® CuCl2 + H2O
(3) CuCl + AgNO3 ® AgCl¯ + Cu(NO3)2
(4) Cu(NO3)2 + NaOH ® Cu(OH)2¯ + NaNO3
(5)
|
(6) CuO + H2
¾t¾0 ® Cu + H O
|
|
a) Phương trình phản ứng Na2SO4 + Ba(OH)2 ® BaSO4¯ + NaOH |
0,25 điểm |
|
b) 1,5 điểm: n = 23,3 = 0,1 (mol) BaSO 4 233 |
0,25 điểm |
|
Theo phương trình phản ứng nNa SO = nBaSO = 0,1 (mol ) 2 4 4 |
0,25 điểm |
|
mNa SO = 0,1 . 142 = 14,2(mol ) 2 4 |
0,25 điểm |
|
mNaCl = 25,9 - 14,2 = 11,7 (g) |
0,25 điểm |
|
c) 2 điểm: mdd Ba(OH) = 85,5 (g) 2 |
0,25 điểm |
|
mdd B = mdd A + mdd Ba(OH) - mBaSO (ĐLBTKL) 2 4
mdd B = 200 + 85,5- 23,3 = 262,2 (g) |
0,25 điểm |
|
C% NaCl = 4,46%; C%NaOH = 3,05% |
0,25 điểm |
![]() Câu 4: 1,0 điểm
Câu 4: 1,0 điểm
|
Phương trình phản ứng: 2Al + 6HCl ® 2AlCl3 + 3H2 Fe+ 2HCl ® FeCl2 + H2 |
0,25 điểm |
|
mH = 8,3 - 7.8 = 0,5 (g) 2
n = 0,5 = 0,25 (mol) H2 2 nHCl = 2nH = 2 . 0,25 = 0,5 (mol ) 2 |
0,25 điểm |
|
Theo định luật bảo toàn khối lượng mhỗn hợp kim loại + maxit = mmuối + mkhí |
0,25 điểm |
|
mmuối = 8,3 + 0,5 . 36,5 - 0,5 = 26,05 (g) |
0,25 điểm |