Tài liệu Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2023 tổng hợp từ đề thi môn Hóa học 9 của các trường THCS trên cả nước đã được biên soạn chi tiết giúp học sinh ôn luyện để đạt điểm cao trong bài thi giữa học kì 2 Hóa học lớp 9. Mời các bạn cùng đón xem:
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 1
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 1)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái
A. lỏng và khí.
B. rắn và lỏng.
C. rắn và khí.
D. rắn, lỏng, khí.
Câu 2: Đốt cháy hoàn toàn 2,8 gam hỗn hợp cacbon và lưu huỳnh cần 3,36 lít O2 (đktc). Khối lượng mỗi chất trong hỗn hợp lần lượt là
A. 0,2 gam và 0,8 gam.
B. 1,2 gam và 1,6 gam.
C. 1,3 gam và 1,5 gam.
D. 1,0 gam và 1,8 gam.
Câu 3: Nước clo là dung dịch hỗn hợp các chất
A. HCl; HClO; H2O.
B. HCl; HClO2; Cl2; H2O.
C. NaCl; NaClO.
D. HCl; HClO; Cl2; H2O.
Câu 4: Cho 11,2 gam bột sắt tác dụng với khí clo dư. Sau phản ứng thu được 32,5 gam muối sắt. Khối lượng khí clo tham gia phản ứng là
A. 21,3 gam.
B. 20,50 gam.
C. 10,55 gam.
D. 10,65 gam.
Câu 5: Do có tính hấp phụ, nên cacbon vô định hình được dùng làm
A. điện cực, chất khử.
B. trắng đường, mặt nạ phòng hơi độc.
C. ruột bút chì, chất bôi trơn.
D. mũi khoan, dao cắt kính.
Câu 6: Cho 1 mol Ba(OH)2 phản ứng với 1 mol CO2. Muối tạo thành là
A. BaCO3.
B. Ba(HCO3)2.
C. BaCO3 và Ba(HCO3)2.
D. BaCO3 và Ba(OH)2 dư.
Câu 7: Dãy gồm các chất bị phân hủy bởi nhiệt là
A. Na2CO3, Mg(OH)2, Ca(HCO3)2, BaCO3.
B. MgCO3, BaCO3, Ca(HCO3)2, NaHCO3.
C. K2CO3, KOH, MgCO3, Ca(HCO3)2.
D. NaHCO3, KHCO3, Na2CO3, K2CO3.
Câu 8: Nhận định nào sau đây về tính chất của silic là sai?
A. Silic là phi kim hoạt động hóa học yếu hơn cacbon, clo.
B. Ở nhiệt độ cao, silic phản ứng với oxi tạo thành silic đioxit
C. Silic là chất rắn, màu xám.
D. Silic dẫn điện tốt nên được dùng làm pin mặt trời.
Câu 9: Dãy các kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần?
A. K, Na, Li, Rb.
B. Li, K, Rb, Na.
C. Na, Li, Rb, K.
D. Li, Na, K, Rb.
Câu 10: Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 7 electron. Vị trí và tính chất cơ bản của nguyên tố X là
A. thuộc chu kỳ 3, nhóm VII là kim loại mạnh.
B. thuộc chu kỳ 7, nhóm III là kim loại yếu.
C. thuộc chu kỳ 3, nhóm VII là phi kim mạnh.
D. thuộc chu kỳ 3, nhóm VII là phi kim yếu.
Câu 11: Nguyên tử cacbon có thể liên kết trực tiếp với nhau tạo thành các dạng mạch cacbon là
A. mạch vòng.
B. mạch thẳng, mạch nhánh.
C. mạch vòng, mạch thẳng, mạch nhánh.
D. mạch nhánh.
Câu 12: Phản ứng hóa học đặc trưng của metan là
A. phản ứng cộng.
B. phản ứng thế.
C. phản ứng tách.
D. phản ứng trùng hợp.
Câu 13: Đốt cháy hoàn toàn 5,6 lít khí etilen ở đktc cần dùng lượng oxi (ở đktc) là
A. 11,2 lít.
B. 16,8 lít.
C. 22,4 lít.
D. 33,6 lít.
Câu 14: Dãy các chất nào sau đây đều làm mất màu dung dịch brom?
A. CH4; C6H6.
B. CH4; C2H6.
C. CH4; C2H4.
D. C2H4; C2H2.
Câu 15: Phản ứng đặc trưng của benzen là
A. phản ứng cháy.
B. phản ứng trùng hợp.
C. phản ứng thế với brom (có bột sắt xúc tác).
D. phản ứng hóa hợp với brom (có bột sắt xúc tác).
Câu 16: Để dập tắt đám cháy nhỏ do xăng, dầu người ta dùng biện pháp
A. phun nước vào ngọn lửa.
B. phủ cát vào ngọn lửa.
C. thổi oxi vào ngọn lửa.
D. phun dung dịch muối ăn vào ngọn lửa.
Câu 17: Thành phần chủ yếu của khí thiên nhiên là
A. hiđro. B. metan.
C. etilen. D. axetilen.
Câu 18: Khí nào sau đây khi cháy không gây ô nhiễm môi trường?
A. CH4. B. H2.
C. C4H10. D. CO.
Câu 19: Thể tích khí oxi (ở đktc) cần dùng để đốt cháy hoàn toàn 1 kg than có chứa 4% tạp chất không cháy là
A. 1,792 m3.
B. 4,48 m3.
C. 3,36 m3.
D. 6,72 m3.
Câu 20: Khí tham gia phản ứng trùng hợp là
A. CH4. B. C2H4.
C. C3H8. D. C2H6.
Câu 21: Trùng hợp 14 gam etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam. B. 14 gam.
C. 28 gam. D. 56 gam.
Câu 22: Từ bột Fe và một hoá chất X có thể điều chế trực tiếp được FeCl3. Vậy X là
A. Dung dịch HCl.
B. Dung dịch CuCl2.
C. Khí clo.
D. Cả A, B, C đều được.
Câu 23: Khối lượng C cần dùng để khử hoàn toàn 8 gam CuO thành kim loại là
A. 3,6 gam. B. 1,2 gam.
C. 2,4 gam. D. 0,6 gam.
Câu 24: Khí CO dùng làm chất đốt trong công nghiệp có lẫn tạp chất là CO2 và SO2. Có thể làm sạch CO bằng
A. CuSO4 khan.
B. H2SO4 đặc.
C. dung dịch BaCl2.
D. dung dịch nước vôi trong.
Câu 25: Nhận xét nào sau đây không đúng?
A. Hợp chất hữu cơ có ở xung quanh ta.
B. Hợp chất hữu cơ là hợp chất của cacbon.
C. Khi đốt cháy các hợp chất hữu cơ đều thấy tạo ra CO2.
D. Đốt cháy hợp chất hữu cơ luôn thu được CO2 và H2O.
Câu 26: Cho 0,56 lít (đktc) hỗn hợp khí metan và axetilen tác dụng với dung dịch brom dư, lượng brom đã tham gia phản ứng là 5,6 gam. Thành phần phần trăm về thể tích của axetilen trong hỗn hợp ban đầu lần lượt là
A. 20%. B. 70%.
C. 40%. D. 60%.
Câu 27: Số liên kết đơn trong phân tử C4H10 là
A. 10. B. 13.
C. 14. D. 12.
Câu 28: Axetilen tham gia phản ứng cộng H2O (xúc tác H2SO4) thu được sản phẩm là
A. C2H5OH
B. CH3COOH
C. CH3CHO
D. C2H4(OH)2
Câu 29: Khử hoàn toàn 2,4 gam đồng (II) oxit bằng khí CO. Thể tích khí CO cần dùng (đktc) là
A. 0,224 lít
B. 0,672 lít
C. 0,448 lít
D. 0,560 lít
Câu 30: Tính khối lượng benzen cần dùng để điều chế 15,7 gam brombenzen, biết hiệu suất phản ứng đạt 80%.
A. 7,80 gam
B. 8,80 gam
C. 9,75 gam
D. 10,08 gam
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 1
|
1D |
2B |
3D |
4A |
5B |
6A |
7B |
8D |
9D |
10C |
|
11C |
12B |
13B |
14D |
15C |
16B |
17B |
18B |
19A |
20B |
|
21B |
22C |
23D |
24D |
25D |
26B |
27B |
28C |
29B |
30C |
Câu 1:
Đáp án D
Ở điều kiện thường phi kim tồn tại ở cả ba trạng thái:
- Rắn: lưu huỳnh, photpho, cacbon,…
- Lỏng: brom
- Khí: oxi, clo, hiđro, nitơ
Câu 2:
Đáp án B
\({n_{{O_2}}} = \frac{{3,36}}{{22,4}}\) = 0,15 mol
Theo bài ra ta có hệ phương trình:
\(\left\{ \begin{array}{l}12x + 32y = 2,8\\x + y = 0,15\end{array} \right.\)⇒ \(\left\{ \begin{array}{l}x = 0,1\\y = 0,05\end{array} \right.\)
⇒ mC = 0,1.12 = 1,2 gam
mS = 0,05.32 = 1,6 gam
Câu 3:
Đáp án D
Clo phản ứng với nước theo phương trình:
Cl2 + H2O ⇄ HCl + HClO
Nước clo là dung dịch hỗn hợp các chất: HCl; HClO; Cl2; H2O.
Câu 4:
Đáp án A
Áp dụng định luật bảo toàn khối lượng:
mFe + \({m_{C{l_2}}}\) = m muối sắt
⇒ \({m_{C{l_2}}}\)= 32,5 – 11,2 = 21,3 gam
Câu 5:
Đáp án B
Cacbon vô định hình (than gỗ, than xương,…) có tính hấp phụ (giữ trên bề mặt của chúng các chất khí, chất hơi, chất tan trong dung dịch). Nhờ tính chất này mà cacbon vô định hình được dùng để làm trắng đường, chế tạo mặt nạ phòng độc.
Câu 6:
Đáp án A
Phản ứng theo tỉ lệ 1 : 1
Ba(OH)2 + CO2 → BaCO3 + H2O
Câu 7:
Đáp án B
Lưu ý: Muối cacbonat dễ bị phân hủy bởi nhiệt (trừ muối cacbonat trung hòa của kim loại kiềm)
Dãy gồm các chất bị phân hủy bởi nhiệt là: MgCO3, BaCO3, Ca(HCO3)2, NaHCO3.
Câu 8:
Đáp án D
Silic dẫn điện kém. Tinh thể silic tinh khiết là chất bán dẫn nên silic được dùng làm vật liệu bán dẫn trong kỹ thuật điện tử và chế tạo pin mặt trời.
Câu 9:
Đáp án D
Trong một nhóm A, khi đi từ trên xuống dưới theo chiều tăng của điện tích hạt nhân tính kim loại của các nguyên tố tăng dần.
Trong nhóm IA, sắp xếp theo chiều tính kim loại tăng dần là: Li, Na, K, Rb
Câu 10:
Đáp án C
X có 3 lớp electron ⇒ thuộc chu kì 3
X có 7 electron lớp ngoài cùng ⇒ thuộc nhóm VII là phi kim mạnh.
Câu 11:
Đáp án C
Có ba dạng mạch cacbon là: mạch vòng, mạch thẳng, mạch nhánh.
Câu 12:
Đáp án B
Phản ứng hóa học đặc trưng của metan là phản ứng thế.
Metan không có phản ứng cộng, phản ứng tách và phản ứng trùng hợp.
Câu 13:
Đáp án B
Ta có: netilen = \(\frac{{5,6}}{{22,4}} = 0,25\,\,mol\)
⇒ \({V_{{O_2}}}\)= 0,75.22,4 = 16,8 lít
Câu 14:
Đáp án D
Etilen (C2H4) và axetilen (C2H2) đều làm mất màu dung dịch brom.
Metan (CH4) không làm mất màu dung dịch brom
Câu 15:
Đáp án C
Tính chất hóa học đặc trưng của benzen là dễ thế, khó cộng.
Benzen tham gia phản ứng thế với brom theo phương trình:
C6H6 + Br2 C6H5Br + HBr
Câu 16:
Đáp án B
Để dập tắt đám cháy nhỏ do xăng, dầu người ta dùng biện pháp: phủ cát vào ngọn lửa
Mục địch là để ngăn cách ngọn lửa với oxi trong không khí.
Câu 17:
Đáp án B
Thành phần chủ yếu của khí thiên nhiên là metan (CH4)
Câu 18:
Đáp án B
Khí H2 khi cháy không gây ô nhiễm môi trường
2H2 + O2 2H2O
Các khí còn lại cháy đều tạo CO2 là khí gây hiệu ứng nhà kính.
Câu 19:
Đáp án A
Khối lượng cacbon có trong 1kg than trên là:
mC = 1.\(\frac{{(100 - 4)}}{{100}}\) = 0,96 kg = 960 gam
⇒ nC = \(\frac{{960}}{{12}}\) = 80 mol
C + O2 CO2
Theo phương trình: \({n_{{O_2}}} = {n_C}\)= 80 mol
⇒ \({V_{{O_2}}}\)= 80.22,4 = 1792 lít = 1,792 m3
Câu 20:
Đáp án B
Khí tham gia phản ứng trùng hợp là etilen (C2H4)
nCH2=CH2 (-CH2-CH2-)n
Câu 21:
Đáp án B
nCH2=CH2 (-CH2-CH2-)n
Bảo toàn khối lượng có:
mtrước = msau
⇒ mpoli etilen = metilen = 14 gam.
Câu 22:
Đáp án C
X là khí clo (Cl2)
2Fe + 3Cl2 2FeCl3
Câu 23:
Đáp án D
nCuO = \(\frac{8}{{80}}\) = 0,1 mol
2CuO + C 2Cu + CO2
Theo phương trình: nC = \(\frac{1}{2}\)nCuO = 0,05 mol
→ mC = 0,05.12 = 0,6 gam.
Câu 24:
Đáp án D
Cho hỗn hợp khí qua lượng dư nước vôi trong; CO2 và SO2 phản ứng với nước vôi trong bị giữ lại; CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
CO2 + Ca(OH)2 (dư) → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 (dư) → CaSO3 ↓ + H2O
Câu 25:
Đáp án D
Nhận xét không đúng: Đốt cháy hợp chất hữu cơ luôn thu được CO2 và H2O.
Giải thích: Hợp chất hữu cơ chắc chắn có cacbon nên đốt cháy luôn thu được CO2. Hợp chất hữu cơ có thể không có H (ví dụ như: CCl4, NaOOC-COONa)
Câu 26
Đáp án B
\({n_{B{r_2}}}\)phản ứng = \(\frac{{5,6}}{{160}}\) = 0,035 mol
Cho hỗn hợp khí qua dung dịch brom dư chỉ có axetilen phản ứng
%Vaxetilen = \(\frac{{0,0175.22,4}}{{0,56}}.100\% = 70\% \)
Câu 27:
Đáp án B
Có 13 liên kết đơn trong phân tử C4H10. \(H - \mathop C\limits_{\mathop H\limits^{\left| {} \right.} }^{\mathop H\limits_{\left| {} \right.} } - \mathop C\limits_{\mathop H\limits^{\left| {} \right.} }^{\mathop H\limits_{\left| {} \right.} } - \mathop C\limits_{\mathop H\limits^{\left| {} \right.} }^{\mathop H\limits_{\left| {} \right.} } - \mathop C\limits_{\mathop H\limits^{\left| {} \right.} }^{\mathop H\limits_{\left| {} \right.} } - H\)
Câu 28:
Đáp án C
Phương trình phản ứng:
C2H2 + H2O CH3CHO
Câu 29:
Đáp án B
Số mol CuO là: nCuO = 0,03 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: nCO = 0,03 mol
Thể tích khí CO cần dùng (đktc) là: VCO = 0,03.22,4 = 0,672 lít.
Câu 30:
Đáp án C
Số mol C6H5Br là: \[{n_{{C_6}{H_5}Br}} = \frac{{15,7}}{{157}}\] = 0,1 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \[{n_{{C_6}{H_6}}}\]= 0,1 mol
Khối lượng benzen theo lý thuyết là: \[{m_{{C_6}{H_6}(lt)}}\]= 0,1.78 = 7,8 gam
Vì hiệu suất đạt 80% suy ra khối lượng benzen cần dùng là:
\[{m_{{C_6}{H_6}}}\]= \[\frac{{7,8}}{{80\% }}\] = 9,75 gam.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 2
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 2)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Hai phi kim tác dụng với nhau tạo sản phẩm không làm đổi màu giấy quỳ ẩm là
A. Hiđro và clo
B. Photpho và oxi
C. Lưu huỳnh và oxi
D. Hiđro và oxi
Câu 2: Phi kim có mức hoạt động hóa học yếu nhất là
A. Flo B. Oxi
C. Clo D. Silic
Câu 3: Khí clo không tác dụng với
A. Dung dịch NaOH
B. Khí O2
C. Dung dịch Ca(OH)2
D. H2O
Câu 4: Đốt cháy cacbon bởi O2, nếu dư thừa oxi thì sau phản ứng thu được khí nào?
A. CO2
B. O2
C. CO2 và CO dư
D. CO2 và O2 dư
Câu 5: Khử hoàn toàn 2,4 gam đồng (II) oxit bằng khí CO. Thể tích khí CO cần dùng (đktc) là
A. 0,224 lít
B. 0,672 lít
C. 0,448 lít
D. 0,560 lít
Câu 6: Khí CO không khử được oxit nào sau đây ở nhiệt độ cao?
A. CuO B. ZnO
C. PbO D. CaO
Câu 7: Ứng dụng của CO2 được dùng để
A. Chữa cháy
B. Bảo quản thực phẩm
C. Dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm, …
D. A, B, C đều đúng
Câu 8: Điều nào sau đây không đúng cho phản ứng của CO và O2
A. Phản ứng tỏa nhiệt
B. Phản ứng thu nhiệt
C. Phản ứng không xảy ra ở điều kiện thường
D. Phản ứng kèm theo sự giảm thể tích
Câu 9: Chọn đáp án đúng nhất. Tất cả muối cacbonat đều
A. Không tan trong nước
B. Tan trong nước
C. Bị nhiệt phân tạo ra oxit kim loại và cacbon đioxit
D. Bị nhiệt phân trừ muối cacbonat của kim loại kiềm
Câu 10: Khối lượng kết tủa tạo ra, khi cho 5,3 gam Na2CO3 tác dụng vừa đủ với dung dịch Ca(OH)2 là
A. 4 gam B. 5 gam
C. 6 gam D. 7 gam
Câu 11: Dung dịch H2CO3 làm quỳ tím chuyển thành màu gì?
A. Đỏ B. Xanh
C. Tím D. Vàng
Câu 12: Công nghiệp silicat gồm
A. sản xuất đồ gốm
B. sản xuất thủy tinh
C. sản xuất xi măng
D. Cả A, B, C đều đúng
Câu 13: Thể tích của dung dịch KOH 1M ở điều kiện thường cần dùng để tác dụng hoàn toàn với 2,24 lít khí Cl2 (đktc) là
A. 0,2 lít B. 0,3 lít
C. 0,4 lít D. 0,5 lít
Câu 14: Trong một chu kỳ, theo chiều tăng dần của điện tích hạt nhân
A. Tính phi kim giảm dần
B. Tính kim loại không đổi
C. Tính phi kim tăng dần
D. Tính kim loại tăng dần
Câu 15: Nhiệt phân hoàn toàn 50 gam CaCO3 thu được V lít khí ở đktc. Biết hiệu suất phản ứng là H = 80%. Giá trị của V là
A. 7,89 lít B. 8,96 lít
C. 9,06 lít D. 10,01 lít
Câu 16: Hợp chất hữu cơ được chia thành mấy loại?
A. 1 B. 2
C. 3 D. 4
Câu 17: Hợp chất vô cơ và hợp chất hữu cơ khác nhau ở điểm nào?
A. Hợp chất hữu cơ kém bền hơn hợp chất vô cơ
B. Hợp chất hữu cơ thường có số lượng nhiều hơn hợp chất vô cơ
C. Hợp chất hữu cơ thường chứa C, H và có thể có O, Cl, …
D. Cả A, B, C đều đúng
Câu 18: Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố
A. Nitơ B. Oxi
C. Hiđro D. Cacbon
Câu 19: Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết
A. Ion B. Hiđro
C. Kim loại D. Cộng hóa trị
Câu 20: Một hợp chất X chứa 2 nguyên tố C, H có tỉ lệ khối lượng là mC : mH = 6 : 1. Hợp chất X có khối lượng mol phân tử là 56. Công thức phân tử của hợp chất X là
A. C5H10 B. C3H6
C. C5H9 D. C4H8
Câu 21: Một hợp chất hữu cơ có công thức C3H7Cl, có số công thức cấu tạo là
A. 1 B. 2
C. 3 D. 4
Câu 22: Công thức cấu tạo dưới đây là của hợp chất nào?
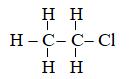
A. C2H5Cl B. C3H6Cl
C. C4H8Cl D. C2H6Cl
Câu 23: Thành phần phần trăm về khối lượng của các nguyên tố cacbon và hiđro trong CH4 lần lượt là
A. 40% và 60%
B. 80% và 20%
C. 75% và 25%
D. 50% và 50%
Câu 24: Đốt cháy 8,4 gam etilen bằng oxi, sau phản ứng thu được V lít khí CO2 ở đktc. Giá trị của V là
A. 10,08 lít B. 13,44 lít
C. 11,56 lít D. 12,56 lít
Câu 25: Cho 14 gam etilen vào dung dịch brom thấy dung dịch vừa đủ mất màu, khối lượng brom tham gia phản ứng là
A. 80 gam B. 40 gam
C. 60 gam D. 50 gam
Câu 26: Trong phòng thí nghiệm người ta thu khí axetilen bằng phương pháp nào là tốt nhất trong các phương pháp sau
A. Đẩy không khí
B. Đẩy nước
C. Đẩy nước brom
D. Cả A, B đều đúng
Câu 27: Tính thể tích dung dịch brom 2M cần để tác dụng với 0,448 lít khí axetilen?
A. 0,01 lít B. 0,04 lít
C. 0,03 lít D. 0,02 lít
Câu 28: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại đó là
A. Etan B. Axetilen
C. Etilen D. Metan
Câu 29: Đốt cháy benzene trong không khí tạo ra CO2 và H2O có tỉ lệ là
A. 1 : 2 B. 1 : 3
C. 3 : 1 D. 2 : 1
Câu 30: Đun nóng brom với 3,9 gam benzen (có bột sắt), người ta thu được 4,71 gam brombenzen. Hiệu suất của phản ứng là
A. 60% B. 70%
C. 80% D. 90%
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 2
|
1D |
2D |
3B |
4D |
5B |
6D |
7D |
8B |
9D |
10B |
|
11A |
12D |
13A |
14C |
15B |
16B |
17D |
18D |
19D |
20D |
|
21B |
22A |
23C |
24B |
25A |
26D |
27D |
28B |
29D |
30A |
Câu 1:
Đáp án D
Phương trình phản ứng:
2H2 + O2 2H2O
Nước là môi trường trung tính nên không làm quỳ đổi màu.
Câu 2:
Đáp án D
Theo bảng tuần hoàn các nguyên tố hóa học thì thứ tự của các phi kim này là:
F > Cl > O > Si
Câu 3:
Đáp án B
Khí clo không tác dụng với khí O2
Khí clo tác dụng với: dung dịch NaOH, Ca(OH)2, H2O
Phương trình phản ứng:
Cl2 + 2NaOH → NaCl + NaClO + H2O
Cl2 + Ca(OH)2 → CaOCl2 + H2O
\[C{l_2} + {\rm{ }}{H_2}O{\rm{ }} \mathbin{\lower.3ex\hbox{$\buildrel\textstyle\rightarrow\over{\smash{\leftarrow}\vphantom{_{\vbox to.5ex{\vss}}}}$}} {\rm{ }}HCl{\rm{ }} + {\rm{ }}HClO\]
Câu 4:
Đáp án D
Đốt cháy cacbon bởi O2, nếu dư thừa oxi thì sau phản ứng thu được hỗn hợp khí là
CO2 và O2 dư
Câu 5:
Đáp án B
Số mol CuO là: nCuO = 0,03 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: nCO = 0,03 mol
Thể tích khí CO cần dùng (đktc) là: VCO = 0,03.22,4 = 0,672 lít.
Câu 6:
Đáp án D
Ở nhiệt độ cao, khí CO không khử được oxit là: CaO
CO chỉ khử được những oxit của kim loại đứng sau Al trong dãy hoạt động hóa học.
Câu 7:
Đáp án D
Ứng dụng của CO2 được dùng để
+ Chữa cháy
+ Bảo quản thực phẩm
+ Dùng trong sản xuất nước giải khát có gas, sản xuất sođa, phân đạm, …
Câu 8:
Đáp án B
Điều không đúng cho phản ứng của CO và O2 là: Phản ứng thu nhiệt.
Câu 9:
Đáp án D
Tất cả muối cacbonat đều bị nhiệt phân trừ muối cacbonat của kim loại kiềm.
Câu 10:
Đáp án B
Số mol của Na2CO3 là: \[{n_{N{a_2}C{O_3}}} = \frac{{5,3}}{{106}}\] = 0,05 mol
Phương trình phản ứng:
Số mol của CaCO3 là: \[{n_{CaC{O_3}}}\]= 0,05 mol
Khối lượng CaCO3 là: \[{m_{CaC{O_3}}}\]= 0,05.100 = 5 gam
Câu 11:
Đáp án A
Dung dịch axit H2CO3 làm quỳ tím chuyển thành màu đỏ.
Câu 12:
Đáp án D
Công nghiệp silicat gồm
+ sản xuất đồ gốm
+ sản xuất thủy tinh
+ sản xuất xi măng
Công nghiệp silicat gồm sản xuất đồ gốm, thủy tinh, xi măng.
Câu 13:
Đáp án A
Số mol Cl2 là: \[{n_{C{l_2}}} = \frac{{2,24}}{{22,4}}\] = 0,1 mol
Phương trình phản ứng:
\[\begin{array}{l}C{l_2} + 2KOH \to KCl + KClO + {H_2}O\\0,1{\rm{ 0,2 (mol)}}\end{array}\]
Thể tích của dung dịch KOH 1M là: VKOH = \[\frac{{0,2}}{1}\] = 0,2 lít.
Câu 14:
Đáp án C
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân thì năng lượng ion hóa, độ âm điện tăng dần đồng thời bán kính nguyên tử giảm dần làm cho khả năng nhận electron tăng nên tính phi kim tăng.
Câu 15:
Đáp án B
Số mol của CaCO3 phản ứng là:
\[{n_{CaC{O_3}}} = \frac{{50}}{{100}}.\frac{{80}}{{100}}\] = 0,4 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \[{n_{C{O_2}}}\]= 0,4 mol
Vậy thể tích khí CO2 là: V = 0,4.22,4 = 8,96 lít.
Câu 16:
Đáp án B
Hợp chất hữu cơ được chia thành 2 loại:
+ Hiđrocacbon: phân tử chỉ có 2 nguyên tố là cacbon và hiđro (CH4, C2H4, …)
+ Dẫn xuất của hiđrocacbon: ngoài cacbon và hiđro, trong phân tử còn có các nguyên tố khác như oxi, clo, … (C2H6O, CH3Cl, …)
Câu 17:
Đáp án D
Hợp chất vô cơ và hợp chất hữu cơ khác nhau ở điểm:
+ Hợp chất hữu cơ kém bền hơn hợp chất vô cơ
+ Hợp chất hữu cơ thường có số lượng nhiều hơn hợp chất vô cơ
+ Hợp chất hữu cơ thường chứa C, H và có thể có O, Cl, …
Câu 18:
Đáp án D
Trong thành phần phân tử hợp chất hữu cơ nhất thiết phải có nguyên tố cacbon.
Câu 19:
Đáp án D
Liên kết hóa học trong phân tử chất hữu cơ chủ yếu là liên kết cộng hóa trị.
Câu 20:
Đáp án D
Gọi công thức phân tử của hợp chất X là: CxHy
Ta có \(x:y = \frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1} = \frac{6}{{12}}:\frac{1}{1} = 0,5:1 = 1:2\)
Suy ra công thức đơn giản của hợp chất X là: CH2
Công thức phân tử của hợp chất X có dạng \({(C{H_2})_n}\)
MX = 56 = n.(12 + 2), suy ra n = 4
Vậy công thức phân tử của hợp chất X là: C4H8
Câu 21:
Đáp án B
Có hai công thức cấu tạo là:
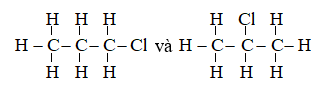
Câu 22:
Đáp án A
Công thức cấu tạo trên là của hợp chất: C2H5Cl
Câu 23:
Đáp án C
Ta có: %mC = \(\frac{{12}}{{16}}.100\% \) = 75%
%mH = 100% - 75% = 25%
Câu 24:
Đáp án B
Số mol của C2H4 là: \({n_{{C_2}{H_4}}} = \frac{{8,4}}{{28}}\) = 0,3 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \({n_{C{O_2}}}\)= 0,6 mol
Vậy thể tích khí CO2 thu được là: V = 0,6.22,4 = 13,44 lít.
Câu 25:
Đáp án A
Số mol của C2H4 là: \({n_{{C_2}{H_4}}} = \frac{{14}}{{28}}\) = 0,5 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \[{n_{B{r_2}}}\] = 0,5 mol
Vậy khối lượng brom tham gia phản ứng là: \[{m_{B{r_2}}}\]= 0,5.160 = 80 gam.
Câu 26:
Đáp án D
Trong phòng thí nghiệm người ta thu khí axetilen bằng phương pháp nào là tốt nhất trong các phương pháp sau
+ Đẩy không khí
+ Đẩy nước
Câu 27:
Đáp án D
Số mol C2H2 là: \[{n_{{C_2}{H_2}}} = \frac{{0,448}}{{22,4}}\] = 0,02 mol
Phương trình phản ứng:
\[\begin{array}{l}{C_2}{H_2} + 2B{r_2} \to {C_2}{H_2}B{r_4}\\0,02{\rm{ 0,04 (mol)}}\end{array}\]
Theo phương trình phản ứng ta có \[{n_{B{r_2}}}\]= 0,04 mol
Vậy thể tích dung dịch brom cần dùng là:
V = \[\frac{n}{{{C_M}}} = \frac{{0,04}}{2}\] = 0,02 lít.
Câu 28:
Đáp án B
Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại đó là: Axetilen
Câu 29:
Đáp án D
Phương trình phản ứng:
2C6H6 + 15O2 12CO2 + 6H2O
Theo phương trình phản ứng ta có tỉ lệ CO2 : H2O = 12 : 6 = 2 : 1
Câu 30:
Đáp án A
Số mol của C6H6 là: \[{n_{{C_6}{H_6}}} = \frac{{3,9}}{{78}}\] = 0,05 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \[{n_{{C_6}{H_5}Br}}\] = 0,05 mol
Khối lượng C6H5Br trên lý thuyết là: \[{m_{{C_6}{H_5}Br}}\] = 0,05.157 = 7,85 gam
Hiệu suất của phản ứng là: H = \[\frac{{4,71}}{{7,85}}.100\% \] = 60%
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 3
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 3)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Dãy gồm các nguyên tố phi kim là
A. C, Mg, P, Ca
B. S, Fe, Na, N
C. P, C, S, Si
D. Cu, Fe, Cl, I
Câu 2: Ở điều kiện thường, phi kim nào sau đây tồn tại ở thể khí?
A. Lưu huỳnh B. Clo
C. Cacbon D. Photpho
Câu 3: Trong công nghiệp, clo được điều chế bằng phương pháp gì?
A. Điện phân nóng chảy
B. Nhiệt phân
C. Thủy phân
D. Điện phân dung dịch
Câu 4: Chất được dùng để làm khô khí clo ẩm là
A. NaOH khan
B. CaO
C. Na2SO3 khan
D. Dung dịch H2SO4 đặc
Câu 5: Ứng dụng của Cacbon là
A. Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì…
B. Kim cương được dùng làm đồ trang sức quý hiếm, mũi khoan, dao cắt kính...
C. Cacbon vô định hình dùng làm mặt nạ phòng độc, chất khử mùi…
D. A, B, C đều đúng
Câu 6: CO có tính chất
A. Oxit axit, chất khí độc, có tính khử mạnh
B. Chất khí không màu, rất độc, oxit bazơ
C. Chất khí không màu, rất độc, oxit trung tính, có tính khử mạnh
D. Chất khí, không màu, không mùi, có tính oxi hóa mạnh
Câu 7: Cho m gam than (C) tác dụng với dung dịch HNO3 đặc, nóng, dư. Sau phản ứng thu được 13,44 lít hỗn hợp hai khí ở đktc. Giá trị của m là
A. 1,12 gam B. 1,44 gam
C. 2,11 gam D. 2,34 gam
Câu 8: Hòa tan hoàn toàn 34,8 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 (đktc)?
A. 8,96 lít B. 13,44 lít
C. 9,60 lít D. 10,04 lít
Câu 9: Cho 5,4 gam bột nhôm tác dụng với khí clo dư thì thu được m gam muối. Giá trị của m là
A. 49,6 gam B. 24, 8 gam
C. 26,7 gam D. 53,4 gam
Câu 10: Đốt cháy 6,2 gam photpho bình chứa khí oxi, thu được m gam điphotpho pentaoxit. Giá trị của m là
A. 11,8 gam B. 12,6 gam
C. 13,4 gam D. 14,2 gam
Câu 11: Khử hoàn toàn 6,4 gam Fe2O3 bằng khí CO dư. Sản phẩm khí thu được cho vào bình đựng nước vôi trong dư thu được m gam kết tủa màu trắng. Giá trị của m là
A. 10 gam B. 11 gam
C. 12 gam D. 14 gam
Câu 12: Nhận xét nào sau đây đúng?
A. CO và CO2 đều là oxit axit
B. CO không phải oxit axit, CO2 là oxit axit
C. CO là chất có tính khử, CO2 là oxit axit
D. CO là oxit axit, CO2 không tạo muối
Câu 13: Dẫn luồng khí CO qua hồn hợp Al2O3, CuO, Fe2O3, ZnO (nung nóng). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al, Cu, Fe, Zn
B. Al, Cu, Fe, ZnO
C. Al2O3, Cu, Fe, Zn
D. Al2O3, Cu, Fe, ZnO
Câu 14: Nung hoàn toàn hỗn hợp 2 muối CaCO3 và MgCO3 thu được 3,8 gam hai oxit và 1,68 lít CO2 (đktc). Khối lượng hỗn hợp muối ban đầu là
A. 8,2 gam B. 5,9 gam
C. 6,8 gam D. 7,1 gam
Câu 15: Trong các muối sau, muối nào là muối hiđrocacbonat?
A. NaHSO3 B. MgCO3
C. Na2CO3 D. Ca(HCO3)2
Câu 16: Công nghiệp silicat gồm
A. sản xuất đồ gốm
B. sản xuất thủy tinh
C. sản xuất xi măng
D. Cả A, B, C đều đúng
Câu 17: Đại lượng nào của nguyên tố hóa học biến thiên tuần hoàn?
A. Số lớp electron và số electron ở lớp ngoài cùng của nguyên tử
B. Nguyên tử khối
C. Điện tích hạt nhân và số electron của nguyên tử
D. Số electron ở lớp ngoài cùng của nguyên tử
Câu 18: Nguyên tố X có điện tích hạt nhân là 11+, nguyên tử X có 3 lớp electron, lớp ngoài cùng có 1 electron, ta xác định được
A. Nguyên tử X có điện tích hạt nhân là 11+ suy ra X ở ô 11
B. Nguyên tử X có 3 lớp electron nên X ở chu kỳ 3
C. Nguyên tử X có 1e ở lớp ngoài cùng nên X ở nhóm IA
D. Cả A, B, C đều đúng
Câu 19: Ô nguyên tố cho biết
A. Số hiệu nguyên tử
B. Tên nguyên tố, kí hiệu hóa học
C. Nguyên tử khối
D. Cả A, B, C đều đúng
Câu 20: Thành phần phần trăm về khối lượng của nguyên tố C trong CH3Cl là
A. 23,76% B. 24,57%
C. 25,60% D. 26,70%
Câu 21: Dãy nào sau đây là dẫn xuất của hiđrocacbon?
A. CH3NO2, CaCO3, C6H6
B. C2H6O, C6H6, CH3NO2
C. CH3NO2, C2H6O, C2H3O2Na
D. C2H6O, C6H6, CaCO3
Câu 22: Phân loại mạch cacbon gồm
A. Mạch không phân nhánh (mạch thẳng)
B. Mạch nhánh
C. Mạch vòng
D. Cả A, B, C đều đúng
Câu 23: Trong các hợp chất hữu cơ, cacbon luôn có hoá trị là
A. I B. II
C. III D. IV
Câu 24: Một hợp chất A chứa 3 nguyên tố C, H, O có tỉ lệ khối lượng là mC : mH : mO = 18 : 3 : 16. Hợp chất A có công thức đơn giản nhất trùng với công thức phân tử. Công thức của hợp chất A là
A. C4H8O2 B. C4H8O
C. C3H6O2 D. C3H6O
Câu 25: Ứng dụng của metan là
A. Metan cháy tỏa nhiều nhiệt nên được đùng làm nhiên liệu trong đời sống và trong sản xuất
B. Metan là nguyên liệu dùng điều chế hiđro
C. Metan còn được dùng để điều chế bột than và nhiều chất khác
D. Cả A, B, C đều đúng
Câu 26: Điều kiện để xảy ra phản ứng giữa metan và khí clo là
A. Có ánh sáng
B. Có axit làm xúc tác
C. Có sắt làm xúc tác
D. Có nhiệt độ
Câu 27: Đốt cháy hoàn toàn m gam khí metan thu được 13,44 lít khí CO2 ở đktc. Giá trị của m là
A. 10,2 gam B. 7,8 gam
C. 8,8 gam D. 9,6 gam
Câu 28: Cho 14 gam etilen vào dung dịch brom thấy dung dịch vừa đủ mất màu, khối lượng brom tham gia phản ứng là
A. 80 gam B. 40 gam
C. 60 gam D. 50 gam
Câu 29: Sản phẩm trùng hợp etilen là
A. Poli etilen
B. Poli vinyl clorua
C. Poli epilen
D. Poli propilen
Câu 30: Cấu tạo phân tử axetilen gồm
A. 2 liên kết đôi và 1 liên kết 3
B. 1 liên kết đôi và 1 liên kết 3
C. 2 liên kết đơn và 1 liên kết đôi
D. 2 liên kết đơn và 1 liên kết 3
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 3
|
1C |
2B |
3D |
4D |
5D |
6C |
7B |
8A |
9C |
10D |
|
11C |
12B |
13C |
14D |
15D |
16D |
17D |
18D |
19D |
20A |
|
21C |
22D |
23D |
24C |
25D |
26A |
27D |
28A |
29A |
30D |
Câu 1:
Đáp án C
Dãy gồm các nguyên tố phi kim là: P, C, S, Si.
Các nguyên tố: Mg, Ca, Fe, Na, Cu là các nguyên tố kim loại.
Câu 2:
Đáp án B
+ Photpho, cacbon, lưu huỳnh là các phi kim tồn tại trạng thái rắn ở điều kiện thường
+ Clo là phi kim tồn tại trạng thái khí ở điều kiện thường.
Câu 3:
Đáp án D
Trong công nghiệp, clo được điều chế bằng phương pháp điện phân dung dịch NaCl bão hòa, có màng ngăn xốp.
2NaCl(dd) + 2H2O(l) Cl2(k) + H2(k) + 2NaOH(dd)
Câu 4:
Đáp án D
Chất được dùng để làm khô khí clo ẩm là dung dịch H2SO4 đặc, vì Cl2 và H2SO4 đặc đều là những chất oxi hóa mạnh nên không phản ứng với nhau.
Câu 5:
Đáp án D
Tùy thuộc vào tính chất của mỗi dạng thù hình, người ta sử dụng cacbon trong đời sống, sản xuất và trong kĩ thuật, ví dụ:
+ Than chì được dùng làm điện cực, chất bôi trơn, ruột bút chì…
+ Kim cương được dùng làm đồ trang sức quý hiếm, mũi khoan, dao cắt kính...
+ Cacbon vô định hình dùng làm mặt nạ phòng độc, chất khử mùi…
Câu 6:
Đáp án C
CO có tính chất là chất khí không màu, rất độc, oxit trung tính, có tính khử mạnh.
Câu 7:
Đáp án B
Gọi số mol của C là x mol
Số mol của hỗn hợp hai khí là: n = 0,6 mol
Phương trình phản ứng:
Theo phương trình phản ứng, ta có x + 4x = 0,6 suy ra x = 0,12 mol
Vậy khối lượng của C là: m = 0,12.12 = 1,44 gam.
Câu 8:
Đáp án A
Số mol của MnO2 là: \[{n_{Mn{O_2}}}\]= 0,4 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \[{n_{C{l_2}}}\]= 0,4 mol
Thể tích khí Cl2 ở đktc là: \[{V_{C{l_2}}}\]= 0,4.22,4 = 8,96 lít.
Câu 9:
Đáp án C
Số mol của nhôm là: nAl = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có \[{n_{AlC{l_3}}}\]= 0,2 mol
Vậy khối lượng AlCl3 thu được là: m = 0,2.133,5 = 26,7 gam.
Câu 10:
Đáp án D
Số mol của P là: nP = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \({n_{{P_2}{O_5}}}\) = 0,1 mol
Vậy khối lượng của P2O5 là: m = 0,1.142 = 14,2 gam.
Câu 11:
Đáp án C
Số mol của Fe2O3 là: \[{n_{F{e_2}{O_3}}}\]= 0,04 mol
Phương trình phản ứng:
\[\begin{array}{l}C{O_2} + Ca{(OH)_2} \to CaC{O_3} + {H_2}O\\0,12{\rm{ 0,12 (mol)}}\end{array}\]
Số mol của CaCO3 là: \[{n_{CaC{O_3}}}\]= 0,12 mol
Vậy khối lượng CaCO3 là: m = 0,12.100 = 12 gam.
Câu 12:
Đáp án B
CO là oxit trung tính (oxit không tạo muối)
CO2 là oxit axit.
Câu 13:
Đáp án C
Khí CO chỉ khử được các oxit kim loại đứng sau Al vậy nên khử được CuO, Fe2O3, ZnO.
Câu 14:
Đáp án D
Số mol của khí CO2 là: \[{n_{C{O_2}}} = \frac{{1,68}}{{22,4}}\] = 0,075 mol
Khối lượng của CO2 là: \[{m_{C{O_2}}}\]= 0,075.44 = 3,3 gam
Phương trình phản ứng:
CaCO3 CaO + CO2
MgCO3 MgO + CO2
Áp dụng định luật bảo toàn khối lượng ta có: mmuối = moxit + \[{m_{C{O_2}}}\]
suy ra mmuối = 3,8 + 3,3 = 7,1 gam.
Câu 15:
Đáp án D
Muối hiđrocacbonat là Ca(HCO3)2
Muối hiđrocacbonat có công thức dạng M(HCO3)n
Câu 16:
Đáp án D
Công nghiệp silicat gồm
+ sản xuất đồ gốm
+ sản xuất thủy tinh
+ sản xuất xi măng
Công nghiệp silicat gồm sản xuất đồ gốm, thủy tinh, xi măng.
Câu 17:
Đáp án D
Đại lượng của nguyên tố hóa học biến thiên tuần hoàn là: số electron ở lớp ngoài cùng của nguyên tử.
Câu 18:
Đáp án D
Nguyên tố X có điện tích hạt nhân là 11+, nguyên tử X có 3 lớp electron, lớp ngoài cùng có 1 electron, ta xác định được:
+ Nguyên tử X có điện tích hạt nhân là 11+ suy ra X ở ô 11
+ Nguyên tử X có 3 lớp electron nên X ở chu kỳ 3
+ Nguyên tử X có 1e ở lớp ngoài cùng nên X ở nhóm IA
Câu 19:
Đáp án D
Ô nguyên tố cho biết: Số hiệu nguyên tử, kí hiệu hóa học, tên nguyên tố, nguyên tử khối của nguyên tố đó.
Câu 20:
Đáp án A
Thành phần phần trăm về khối lượng của nguyên tố C trong CH3Cl là
\[\% {m_C} = \frac{{12.1}}{{12 + 3 + 35,5}}.100\% \] = 23,76%
Câu 21:
Đáp án C
+ Dẫn xuất của hiđrocacbon: ngoài cacbon và hiđro, trong phân tử còn có các nguyên tố khác như oxi, clo, … (C2H6O, CH3Cl, …)
+ Dãy chất là dẫn xuất của hiđrocacbon là CH3NO2, C2H6O, C2H3O2Na
Câu 22:
Đáp án D
Có 3 loại mạch cacbon: mạch không phân nhánh (mạch thẳng), mạch nhánh và mạch vòng.
Câu 23:
Đáp án D
Trong các hợp chất hữu cơ, cacbon luôn có hoá trị là IV.
Câu 24:
Đáp án C
Gọi công thức phân tử của A là: CxHyOz
Ta có \(x:y:z = \frac{{{m_C}}}{{12}}:\frac{{{m_H}}}{1}:\frac{{{m_O}}}{{16}} = \frac{{18}}{{12}}:\frac{3}{1}:\frac{{16}}{{16}} = 1,5:3:1\) = 3 : 6 : 2
Vậy công thức của hợp chất A là: C3H6O2
Câu 25:
Đáp án D
Ứng dụng của metan là
+ Metan cháy tỏa nhiều nhiệt nên được đùng làm nhiên liệu trong đời sống và trong sản xuất
+ Metan là nguyên liệu dùng điều chế hiđro
+ Metan còn được dùng để điều chế bột than và nhiều chất khác
Câu 26:
Đáp án A
Điều kiện để xảy ra phản ứng giữa metan và khí clo là có ánh sáng
Phương trình phản ứng:
Câu 27:
Đáp án D
Số mol của CO2 là: \({n_{C{O_2}}} = \frac{{13,44}}{{22,4}}\) = 0,6 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \({n_{C{H_4}}}\)= 0,6 mol
Vậy khối lượng của CH4 là: m = 0,6.16 = 9,6 gam.
Câu 28:
Đáp án A
Số mol của C2H4 là: \({n_{{C_2}{H_4}}} = \frac{{14}}{{28}}\) = 0,5 mol
Phương trình phản ứng:
\[\begin{array}{l}{C_2}{H_4}\; + {\rm{ }}B{r_2}\; \to {\rm{ }}{C_2}{H_4}B{r_2}\\0,5{\rm{ 0,5 (mol)}}\end{array}\]
Theo phương trình phản ứng ta có: \[{n_{B{r_2}}}\] = 0,5 mol
Vậy khối lượng brom tham gia phản ứng là: \[{m_{B{r_2}}}\]= 0,5.160 = 80 gam.
Câu 29:
Đáp án A
Sản phẩm trùng hợp etilen là: Poli etilen
Ở điều kiện thích hợp (nhiệt độ, áp suất, xúc tác) các phân tử etilen kết hợp với nhau tạo ra chất có kích thước và khối lượng rất lớn gọi là poli etilen (PE).
Phương trình phản ứng:
Câu 30:
Đáp án D
Cấu tạo phân tử axetilen gồm: 2 liên kết đơn và 1 liên kết 3
Axetien có công thức cấu tạo: H – C ≡ C– H
Trong phân tử axetilen có một liên kết ba giữa hai nguyên tử cacbon.
Trong liên kết ba, có hai liên kết kém bền, dễ đứt lần lượt trong các phản ứng hóa học.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 4
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 60 phút
(không kể thời gian phát đề)
(Đề số 4)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Mức độ hoạt động hóa học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với
A. Kim loại và hiđro
B. Oxi và kim loại
C. Hiđro và oxi
D. Cả oxi, kim loại và hiđro
Câu 2: Cho 19,5 gam kim loại M hóa trị II tác dụng với khí clo dư thì thu được 40,8 gam muối. Kim loại M là
A. Zn B. Fe
C. Mg D. Cu
Câu 3: Tính chất hóa học của clo là
A. Tác dung với hầu hết kim loại
B. Tác dụng với hiđro
C. Tác dụng với nước, với dung dịch kiềm
D. A, B, C đều đúng
Câu 4: Nguyên liệu được dùng để điều chế khí clo trong phòng thí nghiệm là
A. H2SO3 B. HNO3
C. HCl đặc D. H2SO4
Câu 5: Đốt cháy hoàn toàn 20,4 gam hỗn hợp X gồm Al, Zn trong khí clo dư, thu được 41,7 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 6,72 lít B. 4,48 lít
C. 5,60 lít D. 3,36 lít
Câu 6: Hòa tan hoàn toàn 34,8 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 (đktc)?
A. 8,96 lít B. 13,44 lít
C. 9,60 lít D. 10,04 lít
Câu 7: Khử hoàn toàn 4,46 gam PbO bằng C dư ở nhiệt độ cao, thu được khối lượng Pb là
A. 2,56 gam B. 3,36 gam
C. 4,14 gam D. 5,15 gam
Câu 8: Kim cương và than chì là 2 dạng thù hình của cacbon vì
A. Đều do nguyên tố cacbon tạo nên
B. Đều có cấu tạo tinh thể như nhau
C. Đều có tính chất vật lí tương tự nhau
D. Cả A và B đều đúng
Câu 9: Nhận xét nào sau đây đúng?
A. CO và CO2 đều là oxit axit
B. CO không phải oxit axit, CO2 là oxit axit
C. CO là chất có tính khử, CO2 là oxit axit
D. CO là oxit axit, CO2 không tạo muối
Câu 10: Cho dung dịch K2CO3 tác dụng với dung dịch Ca(OH)2 hiện tượng của phản ứng là
A. Sủi bọt khí
B. Kết tủa trắng
C. Không có hiện tượng
D. Dung dịch chuyển sang màu xanh
Câu 11: Phương trình hóa học nào sau đây đúng?
A. 2NaHCO3 Na2CO3 + CO2 + H2O
B. 2NaHCO3 Na2CO3 + H2O
C. NaHCO3 Na2CO3 + O2 + H2O
D. 2NaHCO3 NaOH + CO2 + H2O
Câu 12: Khối lượng kết tủa tạo ra, khi cho 5,3 gam Na2CO3 tác dụng vừa đủ với dung dịch Ca(OH)2 là
A. 4 gam B. 5 gam
C. 6 gam D. 7 gam
Câu 13: Trong công nghiệp, Si được điều chế bằng cách nào?
A. Nung hỗn hợp gồm Mg và cát nghiền mịn
B. Dùng than cốc khử silic đioxit trong lò điện
C. Nung monosilan (SiH4) ở khoảng \[400 - 1000{}^ \circ C\]
D. Nung SiH4 với Na ở khoảng \[500{}^ \circ C\]
Câu 14: Trong một chu kì tuần hoàn, khi đi từ trái qua phải thì
A. Độ âm điện giảm dần
B. Ái lực điện tử giảm dần
C. Năng lượng ion giảm dần
D. Bán kính nguyên tử giảm dần
Câu 15: Cho các nguyên tố sau: O, N, P hãy cho biết thứ tự sắp sếp đúng theo chiều tính phi kim tăng dần
A. O, N, P B. P, N, O
C. N, P, O D. O, P, N
Câu 16: Hợp chất hữu cơ là
A. Hợp chất khó tan trong nước
B. Hợp chất của cacbon và một số nguyên tố khác trừ N, Cl, O
C. Hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat kim loại, muối xianua, cacbua, …
D. Hợp chất có nhiệt độ sôi cao
Câu 17: Chất nào sau đây không thuộc loại chất hữu cơ?
A. CH4 B. CH3Cl
C. CH3COONa D. CO2
Câu 18: Thành phần phần trăm về khối lượng của nguyên tố C trong CH3Cl là
A. 23,76% B. 24,57%
C. 25,60% D. 26,70%
Câu 19: Cho phân tử chất hữu cơ A có hai nguyên tố C và H, biết tỉ khối hơi của A so với H2 là 28. Công thức phân tử chất hữu cơ A là
A. C6H6 B. C5H10
C. C3H6 D. C4H8
Câu 20: Một hợp chất hữu cơ có công thức C3H7Cl, có số công thức cấu tạo là
A. 1 B. 2
C. 3 D. 4
Câu 21: Cho các phát biểu sau:
(1) Trong các hợp chất hữu cơ, cacbon luôn có hóa trị IV, hiđro có hóa trị I, oxi có hóa trị II.
(2) Những nguyên tử cacbon trong phân tử hợp chất hữu cơ có thể liên kết trực tiếp với nhau tạo thành mạch cacbon.
(3) Công thức cấu tạo cho biết thành phần của phân tử và trật tự liên kết giữa các nguyên tử trong phân tử.
(4) Có 2 loại mạch cacbon: mạch không phân nhánh (mạch thẳng), mạch nhánh.
Số phát biểu đúng là
A. 1 B. 2
C. 3 D. 4
Câu 22: Phân tử metan CH4 có cấu tạo
A. Dạng đường thẳng
B. Hình chóp tứ diện
C. Dạng tam giác phẳng
D. Dạng hình vuông phẳng
Câu 23: Đốt cháy 4,8 gam metan trong oxi, sau phản ứng thu được V lít khí CO2. Giá trị của V là
A. 3,36 lít B. 4,48 lít
C. 5,60 lít D. 6,72 lít
Câu 24: Ứng dụng nào sau đây không phải là ứng dụng của etilen
A. Điều chế P.E
B. Điều chế rượu etylic và axit axetic
C. Dùng để ý trái cây mau chín
D. Điều chế khí gas
Câu 25: Đốt cháy hoàn toàn 4,48 lít khí etilen ở đktc cần dùng V lít khí oxi ở đktc. Giá trị của V là
A. 11,20 lít B. 12,56 lít
C. 13,44 lít D. 14,65 lít
Câu 26: Khí X có tỉ khối đối với hiđro là 13. Khí X là
A. CH4 B. C2H4
C. C2H2 D. C2H6
Câu 27: Tính thể tích dung dịch brom 2M cần để tác dụng với 0,448 lít khí axetilen?
A. 0,01 lít B. 0,04 lít
C. 0,03 lít D. 0,02 lít
Câu 28: Chất nào sau đây làm mất màu dung dịch brom
A. CH4
B. C2H2
C. C2H4
D. Cả B và C đều đúng
Câu 29: Tính chất vật lý của benzen là
A. Benzen là chất lỏng, không màu
B. Benzen độc
C. Benzen không tan trong nước
D. Cả A, B, C đều đúng
Câu 30: Đun nóng brom với 3,9 gam benzen (có bột sắt), người ta thu được 4,71 gam brombenzen. Hiệu suất của phản ứng là
A. 60% B. 70%
C. 80% D. 90%
ĐÁP ÁN VÀ HƯỚNG DẪN GIẢI ĐỀ 4
|
1D |
2A |
3D |
4C |
5A |
6A |
7C |
8A |
9B |
10B |
|
11A |
12B |
13B |
14D |
15B |
16C |
17D |
18A |
19D |
20B |
|
21C |
22B |
23D |
24D |
25C |
26C |
27D |
28D |
29D |
30A |
Câu 1:
Đáp án D
Mức độ hoạt động mạnh hay yếu của phi kim căn cứ vào khả năng của phi kim đó phản ứng với cả oxi, kim loại và hiđro.
Câu 2:
Đáp án A
Phương trình phản ứng:
M + Cl2 MCl2
Theo phương trình phản ứng ta có: nM = \({n_{MC{l_2}}}\)
Suy ra \(\frac{{19,5}}{M} = \frac{{40,8}}{{M + 2.35,5}}\) suy ra M = 65
Vậy M là Zn.
Câu 3:
Đáp án D
Tính chất hóa học của clo là:
+ Tác dụng với hầu hết kim loại
+ Tác dụng với hiđro
+ Tác dụng với nước
+ Tác dụng với dung dịch kiềm
Câu 4:
Đáp án C
Nguyên liệu được dùng để điều chế khí clo trong phòng thí nghiệm là HCl đặc
MnO2(r) + 4HClđặc MnCl2 + Cl2(k) + 2H2O
Câu 5:
Đáp án A
Áp dụng định luật bảo toàn khối lượng ta có: mX + mClo = mmuối
Suy ra \({m_{C{l_2}}}\)= mmuối – mX = 41,7 – 20,4 = 21,3 gam
Số mol của Cl2 là: \({n_{C{l_2}}}\)= \(\frac{{21,3}}{{71}}\) = 0,3 mol
Vậy thể tích khí clo ở đktc là: \({V_{C{l_2}}}\)= 0,3.22,4 = 6,72 lít.\[\]
Câu 6:
Đáp án A
Số mol của MnO2 là: \[{n_{Mn{O_2}}}\]= 0,4 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \[{n_{C{l_2}}}\]= 0,4 mol
Thể tích khí Cl2 ở đktc là: \[{V_{C{l_2}}}\]= 0,4.22,4 = 8,96 lít.
Câu 7:
Đáp án C
Số mol của PbO là: \[{n_{PbO}} = \frac{{4,46}}{{223}}\] = 0,02 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: nPb = 0,02 mol
Vậy khối lượng Pb thu được là: mPb = 0,02.207 = 4,14 gam
Câu 8:
Đáp án A
Kim cương và than chì là 2 dạng thù hình của cacbon vì đều do nguyên tố cacbon tạo nên.
Câu 9:
Đáp án B
CO là oxit trung tính (oxit không tạo muối)
CO2 là oxit axit.
Câu 10:
Đáp án B
Cho dung dịch K2CO3 tác dụng với dung dịch Ca(OH)2 hiện tượng của phản ứng là xuất hiện kết tủa trắng (CaCO3)
Phương trình phản ứng:
K2CO3 + Ca(OH)2 → CaCO3↓ trắng + 2KOH
Câu 11:
Đáp án A
Phương trình phản ứng đúng:
2NaHCO3 Na2CO3 + CO2 + H2O
Câu 12:
Đáp án B
Số mol của Na2CO3 là: \[{n_{N{a_2}C{O_3}}} = \frac{{5,3}}{{106}}\] = 0,05 mol
Phương trình phản ứng:
\[{n_{CaC{O_3}}}\]= 0,05 mol
⇒ \[{m_{CaC{O_3}}}\]= 0,05.100 = 5 gam
Câu 13:
Đáp án B
Trong công nghiệp, Si được điều chế bằng cách dùng than cốc khử silic đioxit trong lò điện.
Câu 14:
Đáp án D
Trong một chu kì tuần hoàn, khi đi từ trái qua phải thì bán kính nguyên tử giảm dần.
Câu 15:
Đáp án B
Ta có:
+ P và N cùng thuộc nhóm VA.
Theo quy luật biến đổi xác định được tính phi kim của P < N
+ O và N cùng thuộc chu kỳ 2.
Theo quy luật biến đổi xác định được tính phi kim của N < O
Vậy chiều tăng dần tính phi kim là: P < N < O.
Câu 16:
Đáp án C
Hợp chất hữu cơ là hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat kim loại, muối xianua, cacbua, …
Câu 17:
Đáp án D
Hợp chất hữu cơ là hợp chất của cacbon trừ CO, CO2, H2CO3, muối cacbonat kim loại, muối xianua, cacbua, …
⇒ Chất không thuộc loại chất hữu cơ là CO2
Câu 18:
Đáp án A
Thành phần phần trăm về khối lượng của nguyên tố C trong CH3Cl là
\[\% {m_C} = \frac{{12.1}}{{12 + 3 + 35,5}}.100\% \] = 23,76%
Câu 19:
Đáp án D
Ta có MA = 28.\[{M_{{H_2}}}\]= 28.2 = 56 g/mol
Vậy công thức phân tử chất hữu cơ A là C4H8.
Câu 20:
Đáp án B
Có hai công thức cấu tạo là:
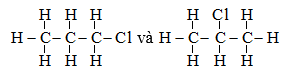
Câu 21:
Đáp án C
Số phát biểu đúng là (1), (2), (3)
Phát biểu (4) sai vì có 3 loại mạch cacbon: mạch không phân nhánh (mạch thẳng), mạch nhánh và mạch vòng.
Câu 22:
Đáp án B
Phân tử metan CH4 có cấu tạo chóp tứ điện.
Câu 23:
Đáp án D
Số mol CH4 là: \({n_{C{H_4}}} = \frac{{4,8}}{{16}}\) = 0,3 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \({n_{C{O_2}}}\)= 0,3 mol
Vậy thể tích CO2 thu được là: V = 0,3.22,4 = 6,72 lít.
Câu 24:
Đáp án D
Ứng dụng của etilen là:
+ Etilen dùng để điều chế axit axetic, rượu etylic, đicloetan, polime (PE, PVC), …
+ Etilen dùng kích thích quả mau chín.
Câu 25:
Đáp án C
Số mol của C2H4 là: \({n_{{C_2}{H_4}}} = \frac{{4,48}}{{22,4}}\) = 0,2 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có \({n_{{O_2}}}\)= 0,6 mol
Vậy thể tích O2 cần dùng là: V = 0,6.22,4 = 13,44 lít.
Câu 26:
Đáp án C
Ta có: MX = 13. \[{M_{{H_2}}}\]= 13.2 = 26
Vậy X là C2H2 (\[{M_{{C_2}{H_2}}}\]= 26 g/mol)
Câu 27:
Đáp án D
Số mol C2H2 là: \[{n_{{C_2}{H_2}}} = \frac{{0,448}}{{22,4}}\] = 0,02 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có \[{n_{B{r_2}}}\]= 0,04 mol
Vậy thể tích dung dịch brom cần dùng là:
V = \[\frac{n}{{{C_M}}} = \frac{{0,04}}{2}\] = 0,02 lít.
Câu 28:
Đáp án D
Metan không làm mất màu dung dịch brom.
C2H2 và C2H4 làm mất màu dung dịch brom.
Câu 29:
Đáp án D
Tính chất vật lý của benzen là
+ Benzen là chất lỏng, không màu
+ Benzen độc
+ Benzen không tan trong nước
Câu 30:
Đáp án A
Số mol của C6H6 là: \[{n_{{C_6}{H_6}}} = \frac{{3,9}}{{78}}\] = 0,05 mol
Phương trình phản ứng:
Theo phương trình phản ứng ta có: \[{n_{{C_6}{H_5}Br}}\] = 0,05 mol
Khối lượng C6H5Br trên lý thuyết là: \[{m_{{C_6}{H_5}Br}}\] = 0,05.157 = 7,85 gam
Hiệu suất của phản ứng là: H = \[\frac{{4,71}}{{7,85}}.100\% \] = 60%
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 5
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 5)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Dẫn khí Cl2 vào dung dịch KOH, tạo thành
A. dung dịch chỉ gồm một muối.
B. dung dịch hai muối.
C. dung dịch chỉ gồm một axit.
D. dung dịch gồm một axit và một muối.
Câu 2: Đốt cháy hoàn toàn 1,08 gam một kim loại hoá trị III trong khí clo. Sau phản ứng thu được 5,34 gam muối clorua. Kim loại đem đốt cháy là
A. Au. B. Al.
C. Fe. D. Ga.
Câu 3: Kim cương, than chì, cacbon vô định hình là các dạng thù hình của nguyên tố
A. photpho B. silic
C. cacbon D. lưu huỳnh
Câu 4: Đốt cháy hoàn toàn 1,2 gam C thì thể tích tối đa của khí CO2 thu được ở đktc là
A. 1,12 lít. B. 11,2 lít.
C. 2,24 lít. D. 22,4 lít.
Câu 5: Khối lượng C cần dùng để khử 8 gam CuO tạo thành CO2 là
A. 0,6 gam. B. 1,2 gam
C. 2,4 gam. D. 3,6 gam.
Câu 6: Khi dẫn khí CO qua ống nghiệm đựng Fe2O3 nung nóng có thể xảy ra phản ứng nào sau đây. Chọn đáp án đúng nhất.
A. 8CO + 3Fe2O3 6Fe + 8CO2
B. 2CO + Fe2O3 2FeCO3
C. 3CO + Fe2O3 2Fe + 3CO2
D. 3CO + Fe2O3 3FeO + 3CO
Câu 7: Quá trình nào sau đây làm giảm CO2 trong khí quyển?
A. Sự hô hấp của động vật và con người.
B. Cây xanh quang hợp.
C. Đốt than và khí đốt.
D. Quá trình nung vôi.
Câu 8: Khí CO dùng làm chất đốt trong công nghiệp có lẫn tạp chất là CO2 và SO2. Có thể làm sạch CO bằng
A. dung dịch nước vôi trong.
B. H2SO4 đặc.
C. dung dịch BaCl2.
D. CuSO4 khan.
Câu 9: Dãy gồm các chất đều phản ứng với dung dịch HCl là
A. Na2CO3, CaCO3.
B. K2SO4, Na2CO3.
C. Na2SO4, MgCO3.
D. Na2SO3, KNO3.
Câu 10: Cặp chất nào sau đây có thể tác dụng được với nhau ?
A. HCl và KHCO3.
B. Na2CO3 và K2CO3.
C. K2CO3 và NaCl.
D. CaCO3 và NaHCO3.
Câu 11: Thí nghiệm nào sau đây có hiện tượng sinh ra kết tủa trắng và bọt khí thoát ra khỏi dung dịch ?
A. Nhỏ từng giọt dung dịch NaOH vào ống nghiệm đựng dung dịch CuCl2.
B. Nhỏ từ từ dung dịch H2SO4 vào ống nghiệm có sẵn một mẫu BaCO3.
C. Nhỏ từ từ dung dịch BaCl2 vào ống nghiệm đựng dung dịch AgNO3.
D. Nhỏ từ từ dung dịch HCl vào ống nghiệm đựng dung dịch Na2CO3.
Câu 12: Cho phương trình hóa học sau: X + NaOH ® Na2CO3 + H2O. X là
A. CO. B. NaHCO3.
C. CO2. D. KHCO3.
Câu 13: Dãy các kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần ?
A. K, Ba, Mg, Fe, Cu.
B. Ba, K, Fe, Cu, Mg.
C. Cu, Fe, Mg, Ba, K.
D. Fe, Cu, Ba, Mg, K.
Câu 14: Công nghiệp silicat là công nghiệp sản xuất
A. đá vôi, đất sét, thủy tinh.
B. đồ gốm, thủy tinh, xi măng.
C. hiđrocacbon, thạch anh, thủy tinh.
D. thạch anh, đất sét, đồ gốm.
Câu 15: Chất khí nào sau đây có thể gây chết người vì ngăn cản sự vận chuyển oxi trong máu?
A. CO B. CO2
C. SO2 D. NO
Câu 16: Phương trình hóa học điều chế nước Gia - ven là
A. Cl2 + NaOH NaCl + HClO
B. Cl2 + NaOH NaClO + HCl
C. Cl2 + H2O HCl + HClO
D. Cl2 + 2NaOH NaCl + NaClO + H2O
Câu 17: Nung 150 kg CaCO3 thu được 67,2 kg CaO. Hiệu suất phản ứng là
A. 60%. B. 40%.
C. 80%. D. 50%.
Câu 18: Dãy các chất nào sau đây đều là dẫn xuất của hiđrocacbon ?
A. C2H6O, CH4, C2H2.
B. C2H4, C3H7Cl, CH4.
C. C2H6O, C3H7Cl, C2H5Cl.
D. C2H6O, C3H8, C2H2.
Câu 19: Trong công thức nào sau đây có chứa liên kết ba ?
A. C2H4 (etilen). B. CH4 (metan).
C. C2H2 (axetilen). D. C6H6 (benzen).
Câu 20: Chất có phần trăm khối lượng cacbon lớn nhất là
A. CH4. B. CH3Cl.
C. CH2Cl2. D. CHCl3.
Câu 21: Trong phân tử etilen có
A. 4 liên kết đơn C–H.
B. 1 liên kết đôi C=C và 4 liên kết đơn C–H.
C. 2 liên kết đơn C – H và 2 liên kết đôi C = H.
D. 1 liên kết đôi C=C và 3 liên kết đôi C = H.
Câu 22: Hoá chất nào sau đây dùng để phân biệt 2 chất CH4 và C2H4?
A. Dung dịch brom.
B. Dung dịch phenolphtalein.
C. Quì tím.
D. Dung dịch bari clorua.
Câu 23: Đốt cháy hoàn toàn 11,2 lít hỗn hợp khí gồm CH4 và H2 (đktc) thu được 16,2 gam nước. Thành phần phần trăm theo thể tích của khí CH4 và H2 trong hỗn hợp lần lượt là chương
A. 60% và 40%.
B. 80% và 20%.
C. 50% và 50%.
D. 30% và 70%.
Câu 24: Tính chất vật lý của khí etilen
A. là chất khí không màu, không mùi, tan trong nước, nhẹ hơn không khí.
B. là chất khí, không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. là chất khí màu vàng lục, không mùi, ít tan trong nước, nặng hơn không khí.
D. là chất khí không màu, mùi hắc, ít tan trong nước, nặng hơn không khí.
Câu 25: Axetilen có tính chất vật lý
A. là chất khí không màu, không mùi, ít tan trong nước, nặng hơn không khí.
B. là chất khí không màu, không mùi, ít tan trong nước, nhẹ hơn không khí.
C. là chất khí không màu, không mùi, tan trong nước, nhẹ hơn không khí .
D. là chất khí không màu, mùi hắc, ít tan trong nước, nặng hơn không khí.
Câu 26:
Liên kết CC trong phân tử axetilen có đặc điểm
A. một liên kết kém bền dễ đứt ra trong các phản ứng hóa học.
B. hai liên kết kém bền nhưng chỉ có một liên kết bị đứt ra trong phản ứng hóa học.
C. hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
D. ba liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
Câu 27: Tính khối lượng benzen cần dùng để điều chế được 31,4 gam brombenzen? Biết hiệu suất phản ứng là 85%
A. 15,6 gam.
B. 13,26 gam.
C. 18,353 gam.
D. 32 gam.
Câu 28: Dẫn 2,8 lít hỗn hợp khí metan và etilen (đktc) qua bình đựng dung dịch brom đã làm mất màu một dung dịch có chứa 4 gam brom. Thể tích khí metan có trong hỗn hợp đó là:
A. 2,24 lít B. 2,42 lít
C. 4,22 lít D. 5.6 lít
Câu 29: Thành phần chính trong bình khí biogas là:
A. C2H2. B. CH4.
C. C2H4. D. C2H4O.
Câu 30: Hợp chất hữu cơ A có thành phần khối lượng các nguyên tố như sau: 85,7% C và 14,3% H. Biết phân tử khối của A là 28 đvC. Công thức hóa học của A là:
A. CH4. B. C6H6.
C. C2H2. D. C2H4.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 6
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 6)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Khi dẫn khí clo vào nước xảy ra hiện tượng
A. vật lí.
B. hoá học.
C. vật lí và hoá học.
D. không xảy ra hiện tượng vật lí và hóa học.
Câu 2: Nước clo có tính tẩy màu vì
A. clo tác dụng với nước tạo nên axit HCl có tính tẩy màu.
B. clo hấp phụ được màu.
C. clo tác dụng nước tạo nên axit HClO có tính tẩy màu.
D. khi dẫn khí clo vào nước không xảy ra phản ứng hoá học.
Câu 3: Cho dung dịch axit có chứa 7,3 gam HCl tác dụng với MnO2 dư. Thể tích khí clo sinh ra (đktc) là
A. 1,12 lít. B. 2,24 lít.
C. 11,2 lít. D. 22,4 lít.
Câu 4: Khí CO dùng làm chất đốt trong công nghiệp có lẫn tạp chất là CO2 và SO2. Có thể làm sạch CO bằng
A. dung dịch nước vôi trong.
B. H2SO4 đặc.
C. dung dịch BaCl2.
D. CuSO4 khan.
Câu 5: Tính khối lượng của Fe thu được khi cho một lượng CO dư khử 32 gam Fe2O3. Biết rằng hiệu suất phản ứng là 80%.
A. 8,96 gam. B. 17, 92 gam.
C. 26, 88 gam. D. 25,77 gam.
Câu 6: Cặp chất nào sau đây có thể cùng tồn tại trong dung dịch?
A. HNO3 và KHCO3.
B. Ba(OH)2 và Ca(HCO3)2.
C. Na2CO3 và CaCl2.
D. K2CO3 và Na2SO4.
Câu 7: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là
A. 0,50 lít. B. 0,25 lít.
C. 0,75 lít. D. 0,15 lít.
Câu 8: Cho 100 ml dung dịch BaCl2 1M tác dụng vừa đủ 100 ml dung dịch K2CO3. Nồng độ mol của chất tan trong dung dịch thu được sau phản ứng là
A. 1M. B. 2M.
C. 0,2M. D. 0,1M.
Câu 9: Công nghiệp silicat là công nghiệp sản xuất
A. đá vôi, đất sét, thủy tinh.
B. đồ gốm, thủy tinh, xi măng.
C. hiđrocacbon, thạch anh, thủy tinh.
D. thạch anh, đất sét, đồ gốm.
Câu 10: Nung 150 kg CaCO3 thu được 67,2 kg CaO. Hiệu suất phản ứng là
A. 60%. B. 40%.
C. 80%. D. 50%.
Câu 11: Sản phẩm chủ yếu của một hợp chất hữu cơ khi cháy là
A. khí nitơ và hơi nước.
B. khí cacbonic và khí hiđro.
C. khí cacbonic và cacbon.
D. khí cacbonic và hơi nước.
Câu 12: Hoá chất nào sau đây dùng để phân biệt 2 chất CH4 và C2H4?
A. Dung dịch brom.
B. Dung dịch phenolphtalein.
C. Quì tím.
D. Dung dịch bari clorua.
Câu 13: Các trái cây, trong quá trình chín sẽ thoát ra một lượng nhỏ chất khí là
A. metan. B. etan
C. etilen. D. axetilen.
Câu 14: Cho khí metan tác dụng với khí oxi theo sơ đồ phản ứng sau:
CH4 +O2 CO2 + H2O
Tổng hệ số trong phương trình hoá học là
A. 5. B. 6.
C. 7. D. 8.
Câu 15: Đốt cháy hoàn toàn 6,4 gam khí metan, dẫn toàn bộ sản phẩm qua dung dịch nước vôi trong dư. Khối lượng kết tủa thu được là
A. 20 gam. B. 40 gam.
C. 80 gam. D. 10 gam.
Câu 16: Khí etilen cho phản ứng đặc trưng là
A. phản ứng cháy.
B. phản ứng thế.
C. phản ứng cộng.
D. phản ứng phân hủy.
Câu 17: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại, đó là
A. metan. B. etilen
C. axetilen. D. etan.
Câu 18: Cấu tạo phân tử axetilen gồm
A. hai liên kết đơn và một liên kết ba.
B. hai liên kết đơn và một liên kết đôi.
C. một liên kết ba và một liên kết đôi.
D. hai liên kết đôi và một liên kết ba.
Câu 19: Dẫn 0,1 mol khí axetilen qua dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 16,0 gam. B. 20,0 gam
C. 26,0 gam. D. 32,0 gam.
Câu 20: Một hợp chất hữu cơ A có phân tử khối là 78 đvC. Vậy A là
A. C2H2. B. C6H12.
C. C2H4. D. C6H6.
II. TỰ LUẬN (3 ĐIỂM)
Câu 1: Trình bày phương pháp hóa học để nhận biết các khí sau đây: C2H6
C2H4, H2. Viết phương trình phản ứng xảy ra nếu có?
Câu 2: Hỗn hợp A gồm metan và etilen. Đốt cháy hoàn toàn 2,24 lít hỗn hợp A (đktc) rồi cho sản phẩm đi qua bình đựng dung dịch Ba(OH)2 dư tạo ra 27,58 gam kết tủa.
a) Viết phương trình hóa học?
b) Tính thành phần, phần trăm thể tích hỗn hợp ban đầu.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 7
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 7)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Cho dung dịch Na2CO3 vào dung dịch HCl hiện tượng xảy ra là:
A. Xuất hiện kết tủa trắng.
B. Có bọt khí xãy ra trong ống nghiệm.
C. Không có hiện tượng gì.
D. Xuất hiện kết tủa trắng đồng thời có bọt khí thoát ra trong ống nghiệm.
Câu 2: Cho phát biểu đúng về hiđro clorua ở điều kiện thường:
A. Là chất khí tan nhiều trong nước
B. Là chất khí không tan trong nước
C. Là chất lỏng tan nhiều trong nước
D. Là chất lỏng không tan trong nước
Câu 3: Dãy các phi kim tác dụng với hiđro tạo thành hợp chất khí là
A. C, Br2, S, Cl2.
B. C, O2, S, Si.
C. Si, Br2, P, Cl2.
D. P, Si, Cl2, S.
Câu 4: Có một sơ đồ chuyển hoá sau:
MnO2 → X → FeCl3 → Fe(OH)3. X có thể là
A. Cl2.
B. HCl.
C. H2SO4.
D. H2.
Câu 5: Dãy oxit phản ứng với cacbon ở nhiệt độ cao tạo thành đơn chất kim loại là
A. CuO, CaO, Fe2O3.
B. PbO, CuO, ZnO.
C. Fe2O3, PbO, Al2O3.
D. Na2O, ZnO, Fe3O4.
Câu 6: Cho 1 mol Ca(OH)2 phản ứng với 1 mol CO2. Muối tạo thành là
A. CaCO3.
B. Ca(HCO3)2.
C. CaCO3 và Ca(HCO3)2.
D. CaCO3 và Ca(OH)2 dư.
Câu 7: Dãy các chất nào sau đây là muối axit?
A. KHCO3, CaCO3, Na2CO3.
B. Ba(HCO3)2, NaHCO3, Ca(HCO3)2.
C. Ca(HCO3)2, Ba(HCO3)2, BaCO3.
D. Mg(HCO3)2, Ba(HCO3)2, CaCO3.
Câu 8: Một hợp chất khí của R với hiđro có công thức RH3. Trong đó R chiếm 91,1765% theo khối lượng. Nguyên tố R thuộc chu kỳ mấy, nhóm mấy?
A. Chu kỳ 2, nhóm III.
B. Chu kỳ 3, nhóm V.
C. Chu kỳ 3, nhóm VI.
D. Chu kỳ 2, nhóm II.
Câu 9: Hàm lượng khí CO2 trong khí quyển của Trái Đất gần như không thay đổi vì:
A. CO2 không có khả năng tác dụng với các chất khí khác trong không khí.
B. Trong quá trình quang hợp cây xanh hấp thụ khí CO2, mặt khác, lượng CO2 được sinh ra do đốt nhiên liệu, sự hô hấp của người và động vật.
C. CO2 hòa tan trong nước mưa.
D. CO2 không bị phân hủy bởi nhiệt.
Câu 10: Để loại bỏ khí cacbonic trong hỗn hợp khí cacbonic và metan bằng cách sục hỗn hợp trên vào:
A. dung dịch HCl
B. dung dịch NaOH
C. Nước
D. dung dịch Ca(OH)2
Câu 11: Nguyên tử của nguyên tố X có 2 lớp electron, lớp ngoài cùng có 6 electron. Câu trả lời nào sau đây đúng?
A. X thuộc chu kì 6, nhóm 2, là một kim loại.
B. X thuộc chu kì 2, nhóm VI, là một phi kim.
C. X thuộc chu kì 6, nhóm 2, là một phi kim.
D. X thuộc chu kì 2, nhóm VI, là một kim loại.
Câu 12: Các hiđrocacbon đã học (trong chương trinh hóa lớp 9) đều có tính chất hóa học chung là:
A. Phản ứng cháy
B. Phản ứng thế
C. Phản ứng cộng
D. Phản ứng trùng hợp
Câu 13: Cặp muối nào sau đây phản ứng được với nhau:
A. Na2CO3 và K2CO3
B. K2CO3 và Ca(NO3)2
C. NaCl và CuCl2
D. NaHCO3 và FeSO4
Câu 14: Một thể tích của hợp chất A phản ứng hoàn toàn với hai thể tích oxi tạo ra một thể tích khí cacbonic. Vậy A là:
A. CH4 B. C2H4
C. C2H2 D. C3H8
Câu 15: Dãy các chất nào chỉ gồm các chất hữu cơ:
A. CH4, H2CO3, C2H6, C4H10
B. C3H6O2, C2H4Br2, C2H5ONa, C2H4O2
C. NaHCO3, CO2, C12H22O11, CH3NO2
D. C6H6, CaCO3, C2H2, C2H4O
Câu 16: Hợp chất nào sau đây vừa tham gia phản ứng cộng vừa tham gia phản ứng thế?
A. etan B. axetilen
C. benzen D. metan
Câu 17: Trong phân tử metan có
A. 4 liên kết đơn C–H.
B. 1 liên kết đôi C=H và 3 liên kết đơn C–H.
C. 2 liên kết đơn C–H và 2 liên kết đôi C=H.
D. 1 liên kết đơn C–H và 3 liên kết đôi C=H.
Câu 18: Để loại bỏ khí axetilen trong hỗn hợp với metan người ta dùng
A. nước.
B. khí hiđro.
C. dung dịch brom.
D. khí oxi.
Câu 19: Câu nào đúng nhất trong các câu sau đây?
A. Benzen là một hiđrocacbon
B. Benzen là một hiđrocacbon no
C. Benzen là một hiđrocacbon không no
D. Benzen là một hiđrocacbon thơm
Câu 20: Hãy chọn câu đúng trong những câu sau đây:
A. Chất nào làm mất màu dung dịch brom chất đó là etilen và axetilen.
B. Hiđrocacbon có liên kết đôi hoặc liên kết ba trong phân tử tương tự như etilen hoặc axetilen làm mất màu dung dịch brom.
C. Hiđrocacbon có liên kết đôi trong phân tử làm mất màu dung dịch brom.
D. Những chất có công thức cấu tạo giống metan dễ làm mất màu dung dịch brom.
III. TỰ LUẬN (3 điểm)
Câu 1: Dùng phương pháp hóa học để nhận biết các chất khí sau bị mất nhãn: Metan, etilen, cacbon đioxit.
Câu 2: Viết phương trình hóa học thực hiện dãy biến hóa
CaC2 C2H2 C2H4 C2H6 C2H5Cl
Câu 3: Đốt cháy hoàn toàn 4,48 lít khí etilen (đktc). Tính
a) Thể tích oxi cần dùng
b) Khối lượng nước tạo thành
c) Toàn bộ sản phẩm cháy dẫn vào bình đựng dung dịch nước vôi trong dư. Tính khối lương kết tủa thu được
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 8
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 8)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Chất không được đựng trong lọ thủy tinh là:
A. HCl B. HNO3
C. H2SO4 D. HF
Câu 2: Phần trăm về khối lượng của cacbon trong phân tử CH4 là:
A. 25% B. 50%
C. 100% D. 75%
Câu 3: Khi nhiệt phân muối cacbonat, khí sinh ra là:
A. SO3 B. CO2
C. O2 D. SO2
Câu 4: Nhóm chất đều là dẫn xuất của hiđrocacbon là:
A. CH3NO2; CH3Br; C2H6O
B. NaC6H5; CH4O; HNO3; C6H6
C. CH4; C2H4; C2H2; C6H6
D. FeCl3; C2H6O;CH4;NaHCO3
Câu 5: Hóa chất dùng để phân biết khí metan và khí e
A. dung dịch nước brom
B. dung dịch natrihidroxit
C. dung dịch phenolphtalein
D. dung dịch nước vôi trong.
Câu 6: Lượng oxi cần dùng để đốt cháy 4,48 lít khí etilen là
A. 4,48 lít B. 8,96 lít
C. 13,44 lít D. 6,72 lít
Câu 7: Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết:
A. Số thứ tự của nguyên tố
B. Số electron lớp ngoài cùng
C. Số hiệu nguyên tử
D. Số lớp electron.
Câu 8: Sắp xếp nào sau đây đúng theo chiều tính kim loại giảm dần:
A. Na, Mg, Al, K
B. K, Na, Mg, Al
C. Al, K, Na, Mg
D. Mg, K, Al, Na
Câu 9: Trong phân tử axetilen, giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi
C. một liên kết ba.
D. hai liên kết đôi.
Câu 10: Nguyên tố M có số hiệu nguyên tử là 13. M thuộc nhóm nào của bảng tuần hoàn?
A. IIA B. IIB
C. IIIA D. IB
Câu 11: Chất nào sau đây thuộc loại chất hữu cơ?
A. Al2C4 B. CH4
C. CO D. Na2CO3
Câu 12: Tính chất vật lí của etilen là:
A. Chất lỏng, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
B. Chất khí, không màu, không mùi, ít tan trong nước và nhẹ hơn không khí.
C. Chất khí, không màu, không mùi, ít tan trong nước và nặng hơn không khí.
D. Chất khí, không màu, không mùi, tan tốt trong nước và nhẹ hơn không khí.
Câu 13: Cặp muối nào sau đây phản ứng được với nhau:
A. Na2CO3 và K2CO3
B. K2CO3 và Ca(NO3)2
C. NaCl và CuCl2
D. NaHCO3 và FeSO4
Câu 14: Nguyên tử của nguyên tố X có 2 lớp electron, lớp ngoài cùng có 6 electron. Câu trả lời nào sau đây đúng.
A. X thuộc chu kì 6, nhóm 2, là một kim loại.
B. X thuộc chu kì 2, nhóm VI, là một phi kim.
C. X thuộc chu kì 6, nhóm 2, là một phi kim.
D. X thuộc chu kì 2, nhóm VI, là một kim loại.
Câu 15: Một thể tích của hợp chất A phản ứng hoàn toàn với hai thể tích oxi tạo ra một thể tích khí cacbonic. Vậy A là:
A. CH4 B. C2H4
C. C2H2 D. C3H8
Câu 16: Để loại bỏ khí cacbonic trong hỗn hợp khí cacbonic và metan bằng cách sục hỗn hợp trên vào
A. dung dịch HCl
B. dung dịch NaOH
C. nước
D. dung dịch Ca(OH)2
Câu 17: Dãy các chất nào chỉ gồm các chất hữu cơ:
A. CH4, H2CO3, C2H6, C4H10
B. C3H6O2, C2H4Br2, C2H5ONa, C2H4O2
C. NaHCO3, CO2, C12H22O11, CH3NO2
D. C6H6, CaCO3, C2H2, C2H4O
Câu 18: Cho dung dịch Na2CO3 vào dung dịch HCl hiện tượng xảy ra là:
A. Xuất hiện kết tủa trắng.
B. Có bọt khí xãy ra trong ống nghiệm.
C. Không có hiện tượng gì.
D. Xuất hiện kết tủa trắng đồng thời có bọt khí thoát ra trong ống nghiệm.
Câu 19: Phân tử nào sau đây có cấu tạo mạch vòng sáu cạnh đều, ba liên kết đơn đôi xen kẽ nhau?
A. axetilen B. propan C. benzen D. xiclohexan
Câu 20: Phản ứng biểu diễn đúng giữa metan và clo là
A. CH4 + Cl2 CH2Cl2 + H2.
B. CH4 + Cl2 CH3Cl + HCl.
C. CH4 + Cl2 CH2 + 2HCl.
D. 2CH4 + Cl2 2CH3Cl + H2.
II. TỰ LUẬN (3 ĐIỂM)
Câu 1: Viết phương trình hóa học theo dãy biến hóa sau:
CaC2 C2H2 CO2 CaCO3 CaO
Câu 2: Đốt cháy hoàn toàn 2,24 lít khí metan.
a) Viết phương trình hoá học của phản ứng.
b) Tính thể tích khí oxi và thể tích khí cacbonic tạo thành (ở đktc).
c) Viết công thức cấu tạo của khí CH4, C2H6, C2H4, C2H2.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 9
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 9)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Dãy gồm các nguyên tố phi kim là
A. C, S, O, Fe.
B. Cl, C, P, S.
C. P, S, Si, Ca.
D. K, N, P, Si.
Câu 2: Ở điều kiện thường, phi kim ở thể lỏng là
A. oxi. B. brom.
C. clo. D. nitơ.
Câu 3: Dãy phi kim tác dụng với oxi tạo thành oxit axit
A. S, C, P. B. S, C, Cl2.
C. C, P, Br2. D. C, Cl2, Br2.
Câu 4: X là nguyên tố phi kim có hoá trị III trong hợp chất với khí hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65 %. X là nguyên tố
A. C. B. N.
C. S. D. P.
Câu 5: Clo là chất khí có màu
A. nâu đỏ. B. vàng lục.
C. lục nhạt. D. trắng xanh.
Câu 6: Clo tác dụng với natri hiđroxit
A. tạo thành muối natri clorua và nước.
B. tạo thành nước javen.
C. tạo thành hỗn hợp các axit.
D. tạo thành muối natri hipoclorit và nước.
Câu 7: Có một sơ đồ chuyển hoá sau:
MnO2 -> X -> FeCl3 > Fe(OH)3. X có thể là
A. Cl2. B. HCl.
C. H2SO4. D. H2.
Câu 8: Cho một luồng khí clo dư tác dụng với 9,2 gam kim loại sinh ra 23,4 gam muối kim loại hoá trị I. Kim loại đó là
A. K. B. Na.
C. Li. D. Rb.
Câu 9: Dạng thù hình của một nguyên tố là
A. những đơn chất khác nhau do nguyên tố đó tạo nên.
B. những chất khác nhau do từ hai nguyên tố hoá học trở lên tạo nên.
C. những chất khác nhau được tạo nên từ cacbon với một nguyên tố hoá học khác.
D. những chất khác nhau được tạo nên từ nguyên tố kim loại với nguyên tố phi kim.
Câu 10: Trộn một ít bột than với bột đồng(II) oxit rồi cho vào đáy ống nghiệm khô, đốt nóng, khí sinh ra được dẫn qua dung dịch nước vôi trong dư. Hiện tượng quan sát được là
A. màu đen của hỗn hợp không thay đổi, dung dịch nước vôi trong vẩn đục.
B. màu đen của hỗn hợp chuyển dần sang màu đỏ, dung dịch nước vôi trong không thay đổi.
C. màu đen của hỗn hợp chuyển dần sang màu đỏ, dung dịch nước vôi trong vẩn đục.
D. màu đen của hỗn hợp chuyển dần sang màu trắng xám, dung dịch nước vôi trong vẩn đục.
Câu 11: Thể tích cacbon đioxit (đktc) thu được khi đốt cháy hoàn toàn 1 tấn than chứa 92% cacbon là
A. 1717,3 m3 B. 1715,3 m3
C. 1710,3 m3 D. 1708 m3
Câu 12: Người ta dùng 22 gam CO2 hấp thụ 20 gam NaOH. Khối lượng muối tạo thành là
A. 45 gam. B. 44 gam
C. 43 gam. D. 42 gam.
Câu 13: Dãy gồm các muối đều tan trong nước là
A. CaCO3, BaCO3, Mg(HCO3)2, K2CO3.
B. BaCO3, NaHCO3, Mg(HCO3)2, Na2CO3.
C. CaCO3, BaCO3, NaHCO3, MgCO3.
D. Na2CO3, Ca(HCO3)2, Ba(HCO3)2, K2CO3.
Câu 14: Cho phương trình hóa học sau: X + NaOH -> Na2CO3 + H2O. X là
A. CO. B. NaHCO3.
C. CO2. D. KHCO3.
Câu 15: Cho 19 gam hỗn hợp Na2CO3 và NaHCO3 tác dụng với dung dịch HCl dư, sinh ra 4,48 lít khí (đktc). Khối lượng mỗi muối trong hỗn hợp ban đầu là
A. 10,6 gam và 8,4 gam.
B. 16 gam và 3 gam.
C. 10,5 gam và 8,5 gam.
D. 16 gam và 4,8 gam.
Câu 16: Trong 1 chu kỳ (trừ chu kì 1), đi từ trái sang phải tính chất của các nguyên tố biến đổi như sau
A. tính kim loại và tính phi kim đều giảm dần.
B. tính kim loại và tính phi kim đều tăng dần.
C. tính kim loại giảm đồng thời tính phi kim tăng dần.
D. tính kim loại tăng dần đồng thời tính phi kim giảm dần.
Câu 17: Trong thực tế, người ta có thể dùng cacbon để khử oxit kim loại nào trong số các oxit kim loại dưới đây để sản xuất kim loại?
A. Al2O3 B. Na2O
C. MgO D. Fe3O4
Câu 18: Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc dư thu được bao nhiêu lít khí Cl2 (đktc)?
A. 4,48 lít. B. 6,72 lít.
C. 17,92 lít. D. 13,44 lít.
Câu 19: Công thức cấu tạo của một hợp chất cho biết
A. thành phần phân tử.
B. trật tự liên kết giữa các nguyên tử trong phân tử.
C. thành phần phân tử và trật tự liên kết giữa các nguyên tử trong phân tử.
D. thành phần phân tử và sự tham gia liên kết với các hợp chất khác.
Câu 20: Trong công thức nào sau đây có chứa liên kết ba?
A. C2H4 (etilen). B. CH4 (metan).
C. C2H2 (axetilen). D. C6H6 (benzen).
Câu 21: Trong phân tử metan có
A. 4 liên kết đơn C–H.
B. 1 liên kết đôi C=H và 3 liên kết đơn C–H.
C. 2 liên kết đơn C–H và 2 liên kết đôi C=H.
D. 1 liên kết đơn C–H và 3 liên kết đôi C=H.
Câu 22: Phản ứng đặc trưng của metan là
A. phản ứng cộng.
B. phản ứng thế.
C. phản ứng trùng hợp.
D. phản ứng cháy.
Câu 23: Khi đốt cháy hoàn toàn 0,25 mol metan người ta thu được một lượng khí CO2 (đktc) có thể tích là
A. 5,6 lít. B. 11,2 lít.
C. 16,8 lít. D. 8,96 lít.
Câu 24: Biết 0,01 mol hiđrocacbon X có thể tác dụng tối đa với 100ml dung dịch brom 0,1M. Vậy X là
A. C2H4. B. CH4
C. C2H2. D. C2H6.
Câu 25: Đốt cháy hoàn toàn 14 gam khí etilen. Thể tích khí oxi cần dùng ở đktc và khối lượng khí CO2 sinh ra là
A. 33,6 lít; 44 gam.
B. 22,4 lít; 33 gam.
C. 11,2 lít; 22 gam
D. 5,6 lít; 11 gam.
Câu 26: Phân tử nào sau đây có cấu tạo là mạch vòng sáu cạnh đều nhau ba liên kết đơn đôi xen kẻ nhau ?
A. Axetilen. B. Propan.
C. Benzen. D. Xiclohexan.
Câu 27: Crăckinh dầu mỏ để thu được
A. hỗn hợp gồm nhiều hiđrocacbon có phân tử khối nhỏ hơn.
B. hỗn hợp gồm nhiều hiđrocacbon có phân tử khối lớn hơn.
C. dầu thô.
D. hiđrocacbon nguyên chất.
Câu 28: Thành phần chính trong bình khí biogas là
A. C2H2. B. CH4.
C. C2H4. D. C2H4O.
Câu 29: Khi đốt khí H2 với O2 sẽ gây nổ. Để hỗn hợp nổ mạnh nhất thì tỉ lệ thể tích giữa H2 và O2 là
A. 2 : 1. B. 1 : 2.
C. 1 : 1. D. 3 : 1.
Câu 30: Khí tham gia phản ứng trùng hợp là
A. CH4. B. C2H4.
C. C3H8. D. C2H6.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 10
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 10)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Ứng dụng của clo là
A. Nước clo dùng khử trùng nước sinh hoạt
B. Điều chế nước Gia – ven, clorua vôi, tẩy trắng vải sợi, bột giấy
C. Điều chế nhựa PVC, chất dẻo, chất màu…
D. A, B, C đều đúng
Câu 2: Để loại khí clo có lẫn trong không khí, có thể dùng chất sau:
A. Nước.
B. Dung dịch NaOH.
C. Dung dịch H2SO4.
D. Dung dịch NaCl.
Câu 3: Nước clo là:
A. Hỗn hợp gồm các chất: Cl2, HCl, HClO.
B. Hợp chất của: Cl2, và nước, HCl, HClO.
C. Hỗn hợp gồm các chất: Cl2, nước, HCl, HClO.
D. Hỗn hợp gồm: nước, HCl, HClO.
Câu 4: Khi mở vòi nước máy, nếu chú ý một chút sẽ phát hiện mùi lạ. Đó là do nước máy còn lưu giữ vết tích của chất sát trùng. Đó chính là clo và người ta giải thích khả năng diệt khuẩn là do:
A. Clo độc nên có tính sát trùng.
B. Clo có tính oxi hoá mạnh.
C. Clo tác dụng với nước tạo HClO chất này có tính oxi hoá mạnh.
D. Một nguyên nhân khác.
Câu 5: Dung dịch nào sau đây không thể chứa trong bình thủy tinh:
A. HNO3.
B. H2SO4 đậm đặc.
C. HF.
D. HCl.
Câu 6: Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo nguyên tắc:
A. Theo chiều khối lượng nguyên tử tăng dần.
B. Theo chiều số electron lớp ngoài cùng của nguyên tử tăng dần.
C. Theo chiều điện tích hạt nhân tăng dần.
D.Theo chiều từ kim loại đến phi kim.
Câu 7: Dạng nào sau đây không phải thù hình của cacbon?
A. Khí lò cốc.
B. Kim cương.
C. Than chì.
D. Cacbon vô định hình.
Câu 8: Sục từ từ khí CO2 vào nước vôi trong hiện tượng xảy ra là
A. Nước vôi trong đục dần rồi trong trở lại.
B. Nước vôi trong không có hiện tượng gì.
C. Nước vôi trong hóa đục.
D. Nước vôi trong một lúc rồi mới hóa đục.
Câu 9: Mệnh đề nào sau đây là đúng:
A. Tất cả các nguyên tử có cùng điện tích hạt nhân đều thuộc cùng một nguyên tố hóa học
B. Nguyên tử của các nguyên tố thuộc cùng nhóm có số electron lớp ngoài cùng bằng số thứ tự của nhóm
C. Số lớp electron ngoài cùng của nguyên tử các nguyên tố biến thiên tuần hoàn khi điện tích hạt nhân tăng
D. Tất cả các mệnh đề trên đều đúng
Câu 10: Cho 2 bình đựng 2 khí: CH4 và C2H4. Nêu phương pháp nhận biết 2 khí?
A. Dùng khí H2
B. Dùng khí oxi
C. Dùng dung dịch brom
D. Dùng khí oxi và H2
Câu 11: Tủ lạnh dùng lâu sẽ có mùi hôi, có thể cho vào tủ lạnh một ít cục than hoa để khử mùi hôi này. Đó là vì:
A. Than hoa có thể hấp phụ mùi hôi
B. Than hoa tác dụng với mùi hôi để biến thành chất khác.
C. Than hoa sinh ra chất hấp phụ mùi hôi.
D. Than hoa tạo ra mùi khác để át mùi hôi.
Câu 12: Những người đau dạ dày thường có pH < 2 (thấp hơn so với mức bình thường pH từ 2 – 3). Để chữa bệnh, người bệnh thường uống trước bữa ăn một ít:
A. Nước
B. Nước mắm
C. Nước đường
D. Dung dịch NaHCO3.
Câu 13: Hấp thụ hoàn toàn V lít (đktc) CO2 vào 100 ml dung dịch NaOH 1M, phản ứng xảy ra xong thu được 6,85 gam muối. V có giá trị là:
A. 168 B. 2,24
C. 1,12 D. 3,36
Câu 14: Cặp chất nào sau đây có thể tồn tại trong cùng một dung dịch?
A. Na2SO4 và BaCl2.
B. Na2SO4 và KCl.
C. H2SO4 và KHSO3.
D. NaOH và CuCl2.
Câu 15: Cho các sơ đồ phản ứng sau:
A + Fe → B
A + NaOH → C + NaClO + H2O
D + Na2O → C + H2O
D + Fe → E + H2
A, B, C, D, E lần lượt là:
A. Cl2, FeCl2, NaCl, HCl, FeCl3.
B. Cl2, FeCl3, NaCl, HCl, FeCl2.
C. HCl, FeCl2, NaCl, Cl2, FeCl3.
D. HCl, FeCl3, NaCl, Cl2, FeCl2.
Câu 16: Thành phần phần trăm về khối lượng của các nguyên tố C, H, O trong C2H6O lần lượt là
A. 52,2%; 13%; 34,8%.
B. 52,2%; 34,8%; 13%.
C. 13%; 34,8%; 52,2%.
D. 34,8%; 13%; 52,2%.
Câu 17: Dãy các hợp chất nào sau đây là hợp chất hữu cơ?
A. CH4, C2H6, CO2.
B. C6H6, CH4, C2H5OH.
C. CH4, C2H2, CO.
D. C2H2, C2H6O, CaCO3.
Câu 18: Trong các hợp chất hữu cơ, cacbon luôn có hoá trị là
A. I. B. IV.
C. III. D. II.
Câu 19: Có các công thức cấu tạo sau:
Các công thức cấu tạo trên biểu diễn mấy chất?
A. 3 chất. B. 2 chất.
C. 1 chất. D. 4 chất.
Câu 20: Một hiđrocacbon (X) ở thể khí có phân tử khối nặng gấp đôi phân tử khối trung bình của không khí. Công thức phân tử của (X) là
A. C4H10. B. C4H8.
C. C4H6. D. C5H10.
Câu 21: Sản phẩm chủ yếu của một hợp chất hữu cơ khi cháy là
A. khí nitơ và hơi nước.
B. khí cacbonic và khí hiđro.
C. khí cacbonic và cacbon.
D. khí cacbonic và hơi nước.
Câu 22: Phản ứng biểu diễn đúng giữa metan và clo là
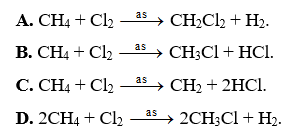
Câu 23: Đốt cháy hoàn toàn 11,2 lít hỗn hợp khí gồm CH4 và H2 (đktc) thu được 16,2 gam nước. Thành phần phần trăm theo thể tích của khí CH4 và H2 trong hỗn hợp lần lượt là
A. 60% và 40%.
B. 80% và 20%.
C. 50% và 50%.
D. 30% và 70%.
Câu 24: Một hợp chất hữu cơ X có chứa 12,8% cacbon; 2,1 % hiđro; 85,1% brom về khối lượng. Vậy X là
A. C2H4Br2. B. C2H2Br4.
C. C6H5Br. D. C6H6Br6.
Câu 25: Để tinh chế khí metan có lẫn etilen và axetilen, ta dùng
A. dung dịch nước brom dư.
B. dung dịch NaOH dư.
C. dung dịch AgNO3/NH3 dư.
D. dung dịch nước vôi trong dư.
Câu 26: Trùng hợp 2 mol etilen (với hiệu suất 100 %) ở điều kiện thích hợp thì thu được khối lượng polietilen là
A. 7 gam. B. 14 gam
C. 28 gam. D. 56 gam.
Câu 27: Trong phân tử axetilen, giữa hai nguyên tử cacbon có
A. một liên kết đơn.
B. một liên kết đôi.
C. một liên kết ba
D. hai liên kết đôi.
Câu 28: Cho 7,8 gam benzen phản ứng với brom dư (có bột sắt xúc tác) hiệu suất phản ứng là 80%. Khối lượng brombenzen thu được là
A. 12,56 gam.
B. 15,7 gam.
C. 19,625 gam.
D. 23,8 gam.
Câu 29: Người ta đang nghiên cứu để sử dụng nguồn nhiên liệu khi cháy không gây ô nhiễm môi trường là
A. CH4. B. H2.
C. C4H10. D. CO.
Câu 30: Dùng 7,84 lít khí CO (đktc) khử hoàn toàn hỗn hợp gồm CuO và Fe2O3, phản ứng kết thúc thu được 14,4 (g) hỗn hợp hai kim loại. Thành phần % về khối lượng mỗi kim loại trong hỗn hợp thu được là:
A. 20% Cu và 80% Fe.
B. 33,3% Cu và 66,7% Fe.
C. 40% Cu và 60% Fe.
D. 66,7% Cu và 33,3% Fe.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 11
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 11)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Hãy chọn câu đúng:
A. Phi kim chỉ tồn tại ở hai trạng thái rắn và khí.
B. Phi kim có ánh kim.
C. Phi kim dẫn điện, dẫn nhiệt kém.
D. Phi kim dẫn điện tốt
Câu 2: Chất nào sau đây khi cháy tạo ra oxit ở thể khí
A. Canxi. B. Silic.
C. Cacbon. D. Magie.
Câu 3: Trong các loại than dưới đây, loại than già nhất có hàm lượng cacbon trên 90% là
A. than gầy. B. than mỡ.
C. than non. D. than bùn.
Câu 4: Nhỏ từ từ dung dịch axit HCl vào cốc đựng một mẩu đá vôi nhỏ cho đến dư axit. Hiện tượng nào sau đây có thể quan sát được?
A. Sủi bọt khí, đá vôi không tan.
B. Đá vôi tan dần, không sủi bọt khí.
C. Không sủi bọt khí, đá vôi không tan.
D. Sủi bọt khí, đá vôi tan dần và tan hết.
Câu 5: Để làm khô khí CO2 cần dẫn khí này qua:
A. H2SO4 đặc B. NaOH rắn
C. CaO D. KOH rắn
Câu 6: Nhóm gồm các chất khí đều khử được CuO ở nhiệt độ cao là
A. CO, H2.
B. Cl2, CO2.
C. CO, CO2.
D. Cl2, CO.
Câu 7: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là
A. 0,50 lít. B. 0,25 lít.
C. 0,75 lít. D. 0,15 lít.
Câu 8: Nguyên tử của nguyên tố X có 2 lớp electron, lớp electron ngoài cùng có 7 electron. Vị trí và tính chất cơ bản của nguyên tố X là
A. thuộc chu kỳ 2, nhóm VII là kim loại mạnh.
B. thuộc chu kỳ 7, nhóm III là kim loại yếu.
C. thuộc chu kỳ 2, nhóm VII là phi kim mạnh.
D. thuộc chu kỳ 2, nhóm VII là phi kim yếu.
Câu 9: Hoá trị của cacbon, oxi, hiđro trong hợp chất hữu cơ lần lượt là
A. IV, II, II. B. IV, III, I.
C. II, IV, I. D. IV, II, I.
Câu 10: Dãy chất nào sau đây đều là hiđrocacbon:
A. C2H4, C3H8, C2H4O2, CH3Cl.
B. C3H8, C2H5O, CH3CH2COOH, CaCO3.
C. C2H6, C4H10, CH3NO2, C2H5Cl.
D. CH4, C4H10, C2H2, C2H6.
Câu 11: Metan có nhiều trong
A. nước ao.
B. các mỏ (khí, dầu, than).
C. nước biển.
D. khí quyển.
Câu 12: Khí metan phản ứng được với:
A. HCl, H2O. B. HCl, Cl2
C. Cl2, O2. D. O2, CO2.
Câu 13: Đốt cháy hoàn toàn 0,224 lít khí metan ở điều kiện tiêu chuẩn thu được lượng khí CO2 ở cùng điều kiện là:
A. 2,24 lít B. 0,672 lít
C. 0,224 lít. D. 0,112 lít
Câu 14: Chất dùng để kích thích cho quả mau chín là:
A. CH4. B. C2H4
C. C2H2. D. C6H6.
Câu 15: Cấu tạo phân tử axetilen gồm:
A. hai liên kết đơn và một liên kết ba.
B. hai liên kết đơn và một liên kết đôi.
C. một liên kết ba và một liên kết đôi.
D. hai liên kết đôi và một liên kết ba.
Câu 16: Đốt cháy hoàn toàn 1 mol khí axetilen thì cần bao nhiêu lít không khí (các khí đo ở đktc, biết rằng oxi chiếm 20% thể tích không khí)?
A. 300 lít. B. 280 lít.
C. 240 lít. D. 120 lít.
Câu 17: Cho 11,2 lít khí etilen (đktc) phản ứng vừa đủ với dung dịch brom 5%. Khối lượng dung dịch brom tham gia phản ứng là
A. 160 gam. B. 1600 gam.
C. 320 gam. D. 3200 gam.
Câu 18: Khí X có tỉ khối đối với oxi là 0,8125. Khí X là
A. C2H2. B. C2H4.
C. C2H6. D. CH4.
Câu 19: Thành phần chính của khí đồng hành là
A. C2H2. B. CH4.
C. C2H4. D. H2.
Câu 20: Trên mũi khoan để khai thác dầu mỏ người ta có gắn
A. thép tốt. B. đá thạch anh.
C. kim cương. D. đá hoa cương.
Câu 21: Khí CH4 và C2H4 có tính chất hóa học giống nhau là
A. tham gia phản ứng cộng với dung dịch brom.
B. tham gia phản ứng cộng với khí hiđro.
C. tham gia phản ứng trùng hợp.
D. tham gia phản ứng cháy với khí oxi sinh ra khí cacbonic và nước.
Câu 22: Phản ứng đặc trưng của các chất chứa liên kết đôi, liên kết ba là
A. Phản ứng thế với clo.
B. Phản ứng thế với brom.
C. Phản ứng trùng hợp.
D. Phản ứng cộng với brom.
Câu 23: Đốt cháy hoàn toàn 1,17g hợp chất hữu cơ A thu được 2,016 lít CO2 đktc và 0,81g H2O. Biết rằng số mol của A bằng số mol của 0,336 lít H2 (ở đktc). Công thức phân tử A là
A. CH4. B. C2H4.
C. C2H6O. D. C6H6
Câu 24: Dẫn 1 mol khí axetilen vào dung dịch chứa 2 mol brom. Hiện tượng nào sau đây đúng?
A. Không có hiện tượng gì xảy ra.
B. Màu da cam của dung dịch brom nhạt hơn so với ban đầu.
C. Màu da cam của dung dịch brom đậm hơn so với ban đầu.
D. Màu da cam của dung dịch brom chuyển thành không màu.
Câu 25: Chất làm mất màu dung dịch brom là
A. CH4.
B. CH2 = CH – CH3.
C. CH3 – CH3.
D. CH3 – CH2 – CH3.
Câu 26: Dẫn 0,1 mol khí axetilen qua dung dịch nước brom dư. Khối lượng brom tham gia phản ứng là
A. 16,0 gam. B. 20,0 gam
C. 26,0 gam. D. 32,0 gam.
Câu 27: Khí tham gia phản ứng trùng hợp là
A. CH4. B. C2H4.
C. C3H8. D. C2H6.
Câu 28: Hãy chọn câu phát biểu không đúng về tính chất vật lí của benzen.
A. Tan rất tốt trong nước
B. Là chất lỏng ở điều kiện thường
C. Hòa tan được dầu ăn
D. Nhẹ hơn nước.
Câu 29: Khối lượng C cần dùng để khử 8 gam CuO tạo thành CO2 là
A. 0,6 gam. B. 1,2 gam.
C. 2,4 gam. D. 3,6 gam.
Câu 30: Cho 69,6 gam mangan đi oxit tác dụng với HCl đặc, dư. Dẫn toàn bộ lượng khí sinh ra vào 500ml dung dịch NaOH 4M. Coi thể tích dung dịch thay đổi không đáng kể, nồng độ mol các chất trong dung dịch sau phản ứng là bao nhiêu:
A. 1,6M; 1,6M; 0,8M.
B. 1,7M; 1,7M; 0,8M.
C. 1,6M; 1,6M; 0,6M.
D. 1,6M; 1,6M; 0,7M.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 12
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 12)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
I. TRẮC NGHIỆM (7 ĐIỂM)
Câu 1: Dựa vào tính chất nào của thủy tinh để có thể tạo ra được những vật liệu có hình dạng khác nhau?
A. Thủy tinh có nhiệt độ nóng chảy cao
B. Khi đun nóng, thủy tinh mềm ra rồi mới nóng chảy.
C. Thủy tinh có nhiều màu sắc khác nhau.
D. Thủy tinh giòn, dễ vỡ.
Câu 2: Nếu lấy số mol KMnO4 và MnO2 như nhau cho tác dụng với axit HCl đặc thì chất nào cho nhiều clo hơn?
A. KMnO4
B. MnO2
C. Hai chất cho clo như nhau
D. Không xác định được
Câu 3: Dãy gồm các muối đều phản ứng được với dung dịch NaOH là
A. Na2CO3, NaHCO3, MgCO3, K2CO3.
B. NaHCO3, Ca(HCO3)2, Mg(HCO3)2, Ba(HCO3)2.
C. Ca(HCO3)2, Mg(HCO3)2, BaCO3, Ba(HCO3)2.
D. CaCO3, BaCO3, Na2CO3, MgCO3.
Câu 4: Biết A có cấu tạo nguyên tử như sau: có 3 lớp electron, lớp ngoài cùng có 6 electron. Dựa vào bảng tuần hoàn thì nguyên tố A là
A. Clo. B. Photpho.
C. Nitơ. D. Lưu huỳnh.
Câu 5: Trong một chu kì tuần hoàn, khi đi từ trái qua phải thì:
A. tính kim loại giảm, tính phi kim giảm.
B. tính kim loại tăng, tính phi kim tăng
C. tính kim loại tăng, tính phi kim giảm.
D. tính kim loại giảm, tính phi kim tăng.
Câu 6: Cấu tạo bảng tuần hoàn gồm có:
A. ô nguyên tố, chu kì
B. chu kì, nhóm
C. ô nguyên tố, chu kì, nhóm.
D. ô nguyên tố, nhóm.
Câu 7: Nguyên tố X ở chu kì 3 nhóm IA, điện tích hạt nhân của nguyên tố X là
A. Z = 13. B. Z = 10.
C. Z = 12. D. Z = 11.
Câu 8: Khi dẫn khí clo vào nước xảy ra hiện tượng
A. vật lí.
B. hoá học.
C. vật lí và hoá học.
D. không xảy ra hiện tượng vật lí và hóa học.
Câu 9: Hợp chất nào sau đây là hợp chất hữu cơ?
A. CaC2. B. KCN.
C. C4H10O. D. CO2.
Câu 10: Hợp chất hữu cơ được chia thành hai loại là
A. hiđrocacbon no và hiđrocacbon không no.
B. hiđrocacbon no và hiđrocacbon thơm.
C. hiđrocacbon và ancol.
D. hiđrocacbon và dẫn xuất hiđrocacbon.
Câu 11: Clo hóa metan (tỉ lệ mol 1 : 1) dưới điều kiện ánh sáng thu được sản phẩm hữu cơ là
A. CH2Cl2. B. CH3Cl.
C. CCl4. D. CHCl3.
Câu 12: Để nhận biết khí axetilen trong hỗn hợp khí X gồm metan, etilen và axetilen có thể sử dụng thuốc thử là
A. dung dịch brom.
B. dung dịch nước vôi trong.
C. dung dịch axit sunfuric.
D. dung dịch AgNO3/NH3.
Câu 13: V lít khí etilen (đktc) làm mất màu vừa đủ 60 gam dung dịch brom 40%. Giá trị của V là
A. 3,36. B. 1,68.
C. 2,24. D. 4,48.
Câu 14: Hiđrocacbon X có tỉ khối hơi so với khí oxi là 0,875. Phần trăm khối lượng cacbon trong X là 85,71%. Tên gọi của X là
A. metan. B. benzen.
C. etilen. D. axetilen.
Câu 15: Công thức cấu tạo của hợp chất hữu cơ X có công thức phân tử C3H6 là
A. CH3 – CH2 – CH3.
B. CH2 = CH – CH3.
C. CH2 ≡ CH – CH3.
D. CH2 = CH2 = CH2.
Câu 16: Hiđrocacbon có liên kết ba trong công thức cấu tạo là
A. benzen. B. axetilen.
C. etilen. D. metan.
Câu 17: Tính chất vật lí chung của các hiđrocacbon (metan, etilen, axetilen) là
A. đều là chất khí ở điều kiện thường.
B. đều là chất lỏng ở điều kiện thường.
C. tan nhiều trong nước.
D. đều có mùi khai.
Câu 18: Cho 7 (g) hỗn hợp X gồm hai anken đồng đẳng kế tiếp phản ứng với dung dịch Br2 dư thấy có 32 (g) brom phản ứng. Công thức phân tử của hai anken trong X là
A. C3H6 và C4H8.
B. CH4 và C2H4.
C. C2H4 và C3H6.
D. C2H2 và C3H4.
Câu 19: Benzen có thể phản ứng với dãy gồm các chất nào dưới đây (điều kiện thích hợp)?
A. Dung dịch HCl, H2O, khí O2.
B. Dung dịch Br2, dung dịch NaOH, khí Cl2.
C. Dung dịch KMnO4, dung dịch Br2, dung dịch HNO3.
D. Brom khan, khí H2, khí O2.
Câu 20: Cho 2,24 (l) khí metan phản ứng hoàn toàn với V (l) khí clo ở đktc, thu được một sản phẩm hữu cơ duy nhất X trong đó clo chiếm 92,21% về khối lượng. Công thức phân tử của X là
A. CCl4. B. CHCl3.
C. CH2Cl2. D. CH3Cl.
II. TỰ LUẬN (3 điểm)
Câu 1: (1 điểm) Hoàn thành các phương trình hóa học sau, ghi rõ điều kiện phản ứng (nếu có):
a) C2H6 + Cl2 →
b) C2H2 + 2H2 →
c) C3H6 + O2 →
d) C6H6 + Br2 →
Câu 2: (2 điểm) Dẫn 4,48 lít hỗn hợp khí metan CH4 và axetilen C2H2 (ở đktc) đi qua dung dịch brom dư, thấy có 16 gam brom phản ứng.
a) Viết phương trình phản ứng xảy ra.
b) Tính thành phần phần trăm theo thể tích các khí có trong hỗn hợp.
c) Tính thể tích khí oxi ở đktc cần dùng để đốt cháy hoàn toàn hỗn hợp trên.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 13
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 13)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Trong các loại than dưới đây, loại than trẻ nhất có hàm lượng cacbon thấp nhất là
A. than gầy. B. than mỡ.
C. than non. D. than bùn.
Câu 2: Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái
A. Lỏng và khí. B. Rắn và lỏng.
C. Rắn và khí. D. Rắn, lỏng, khí.
Câu 3: Phương trình hóa học điều chế nước Gia - ven là
A. Cl2 + NaOH → NaCl + HClO
B. Cl2 + NaOH → NaClO + HCl
C. Cl2 + H2O → HCl + HClO
D. Cl2 + 2NaOH → NaCl + NaClO + H2O
Câu 4: Chất khí nào sau đây có thể gây chết người vì ngăn cản sự vận chuyển oxi trong máu?
A. CO. B. CO2.
C. SO2. D. NO.
Câu 5: Clo tác dụng với natri hiđroxit
A. tạo thành muối natri clorua và nước.
B. tạo thành nước giaven.
C. tạo thành hỗn hợp các axit.
D. tạo muối natri hipoclorit và nước.
Câu 6: Nhóm nào sau đây gồm các chất khí đều phản ứng với dung dịch NaOH ở điều kiện thường:
A. H2, Cl2. B. CO2, Cl2.
C. CO, CO2. D. Cl2, CO.
Câu 7: Nguyên tử của nguyên tố X có 3 lớp electron, lớp ngoài cùng có 1 electron.
Câu trả lời nào sau đây đúng?
A. X thuộc chu kỳ 1, nhóm III, là một kim loại.
B. X thuộc chu kì 3, nhóm IV, là một phi kim.
C. X thuộc chu kì 3, nhóm IV, là một khí hiếm.
D. X thuộc chu kì 3, nhóm I, là một kim loại.
Câu 8: Dãy các nguyên tố được sắp xếp theo chiều tính phi kim tăng dần là:
A. Cl, Si, S, P.
B. Cl, Si, P, S.
C. Si, S, P, Cl.
D. Si, P, S, Cl.
Câu 9: Dãy hợp chất nào sau đây chỉ chứa các chất hữu cơ?
A. CH4, C2H6, CO2.
B. C6H6, CH4, C2H5OH.
C. CH4, C2H2, CO.
D. C2H2, C2H6O, CaCO3.
Câu 10: Nguyên tử cacbon có thể liên kết trực tiếp với nhau tạo thành các dạng mạch cacbon là
A. Mạch vòng.
B. Mạch thẳng, mạch nhánh.
C. Mạch vòng, mạch thẳng, mạch nhánh.
D. Mạch nhánh.
Câu 11: Hiđrocacbon A có phân tử khối là 30 đvC. Công thức phân tử của A là
A. CH4. B. C2H6.
C. C3H8. D. C2H4.
Câu 12: Hiđrocacbon nào sau đây chỉ có liên kết đơn?
A. Metan. B. Axetilen
C. Etilen. D. Etan.
Câu 13: Tính chất vật lí cơ bản của metan là
A. Chất lỏng, không màu, tan nhiều trong nước.
B. Chất khí, không màu, tan nhiều trong nước.
C. Chất khí, không màu, không mùi, nặng hơn không khí, ít tan trong nước.
D. Chất khí, không màu, không mùi, nhẹ hơn không khí, ít tan trong nước.
Câu 14: Phản ứng đặc trưng của metan là
A. Phản ứng cộng
B. Phản ứng thế.
C. Phản ứng trùng hợp
D. Phản ứng cháy
Câu 15: Trong phân tử etilen giữa hai nguyên tử cacbon có
A. Một liên kết đơn
B. Một liên kết đôi.
C. Hai liên kết đôi
D. Một liên kết ba.
Câu 16: Hoá chất nào sau đây dùng để phân biệt 2 chất CH4 và C2H4?
A. Dung dịch brom
B. Dung dịch phenolphtalein.
C. Qùy tím
D. Dung dịch bari clorua.
Câu 17: Các trái cây, trong quá trình chín sẽ thoát ra một lượng nhỏ chất khí là
A. metan. B. etan
C. etilen. D. axetilen.
Câu 18: Khí etilen không có tính chất hóa học nào sau đây?
A. Phản ứng cháy với khí oxi.
B. Phản ứng trùng hợp.
C. Phản ứng cộng với dung dịch brom.
D. Phản ứng thế với clo ngoài ánh sáng.
Câu 19: Liên kết C≡C trong phân tử axetilen có đặc điểm
A. Một liên kết kém bền dễ đứt ra trong các phản ứng hóa học.
B. Hai liên kết kém bền nhưng chỉ có một liên kết bị đứt ra trong phản ứng hóa học.
C. Hai liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
D. Ba liên kết kém bền dễ đứt lần lượt trong các phản ứng hóa học.
Câu 20: Biết 0,01 lít hiđrocacbon X có thể tác dụng tối đa với 100ml dung dịch brom 0,1M. X là:
A. CH4. B. C2H4
C. C2H2 D. C6H6
Câu 21: Hợp chất hữu cơ không có khả năng tham gia phản ứng cộng là
A. metan. B. benzen
C. etilen. D. axetilen.
Câu 22: Trong các chất sau: CH4, CO2, C2H4, Na2CO3, C2H5ONa có
A. 1 hợp chất hữu cơ và 4 hợp chất vô cơ.
B. 2 hợp chất hữu cơ và 3 hợp chất vô cơ.
C. 4 hợp chất hữu cơ và 1 hợp chất vơ cơ.
D. 3 hợp chất hữu cơ và 2 hợp chất vô cơ.
Câu 23: Khối lượng khí etilen cần dùng để phản ứng hết 8g brom trong dung dịch là
A. 14 gam
B. 0,7 gam
C. 7 gam
D. 1,4gam
Câu 24: Cho 11,2 lít etilen (đktc) tác dụng với nước có axit sunfuric (H2SO4) làm xúc tác, thu được 9,2 gam rượu etylic. Hiệu suất phản ứng là:
A. 40% B. 50%
C. 45% D. 55%
Câu 25: Đốt cháy 32g khí metan, thể tích CO2 sinh ra (ở đktc) là
A. 11,2 lít. B. 22,4 lít
C. 33,6 lít D. 44,8 lít.
Câu 26: Một hiđrocacbon (X) ở thể khí có phân tử khối nặng gấp đôi phân tử khối trung bình của không khí. Công thức phân tử của (X) là
A. C4H10. B. C4H8.
C. C4H6. D. C5H10.
Câu 27: Cho 7,8 gam benzen phản ứng với brom dư (có bột sắt xúc tác) hiệu suất phản ứng là 80%. Khối lượng brombenzen thu được là
A. 12,56 gam. B. 15,70 gam.
C. 19,62 gam. D. 23,80 gam.
Câu 28: Phản ứng nào sau đây thuộc loại phản ứng trùng hợp:
A. C2H4 + 3O2 → 2CO2 + 2H2O
B. CH2 = CH2 + Br2 → BrCH2-CH2Br
C. nCH2 = CH2 → (-CH2-CH2-)n
D. CH4 + Cl2 → CH3Cl + HCl
Câu 29: Người ta dùng 22 gam CO2 hấp thụ 20 gam NaOH. Khối lượng muối tạo thành là
A. 45 gam. B. 44 gam.
C. 43 gam. D. 42 gam.
Câu 30: Khử hoàn toàn 32 gam Fe2O3 bằng khí CO dư. Sản phẩm khí thu được cho vào bình đựng nước vôi trong dư được a gam kết tủa màu trắng. Giá trị của a là
A. 50. B. 60.
C. 40. D. 30.
Bộ 40 Đề thi Giữa kì 2 Hóa học lớp 9 có đáp án năm 2022 - Đề 14
Phòng Giáo dục và Đào tạo ...
Đề thi Giữa kì 2
Năm học 2022 - 2023
Bài thi môn: Hóa học lớp 9
Thời gian làm bài: 45 phút
(không kể thời gian phát đề)
(Đề số 14)
(Thí sinh không được sử dụng tài liệu)
Họ, tên thí sinh: .....................................................................Lớp: .............................
(Cho C = 12, O = 16, H = 1, Na = 23, K = 39, Mg = 24, Ca = 40, P = 31, Cl = 35,5,
F = 19, Si = 27, N = 14, S = 32)
Câu 1: Biết X có cấu tạo nguyên tử như sau: điện tích hạt nhân là 13+, có 3 lớp electron, lớp ngoài cùng có 3 electron. Vị trí của X trong bảng tuần hoàn là
A. chu kỳ 3, nhóm II.
B. chu kỳ 3, nhóm III.
C. chu kỳ 2, nhóm II.
D. chu kỳ 2, nhóm III.
Câu 2: Trong những chất sau, những chất nào đều là chất hữu cơ:
A. C2H6, C2H5OH, NaHCO3.
B. C3H8, C2H5O, Na2CO3.
C. C2H6, C2H5OH, CaCO3.
D. C2H6, C4H10, C2H5OH.
Câu 3: Chất có liên kết ba trong phân tử là:
A. CH4. B. C2H4.
C. C2H2. D. C2H6.
Câu 4: Hóa chất dùng để loại bỏ khí etilen có lẫn trong khí metan để thu được khí metan tinh khiết là
A. dung dịch brom.
B. dung dịch phenolphtalein.
C. dung dịch axit clohiđric.
D. dung dịch nước vôi trong.
Câu 5: Dãy chất nào sau đây đều là dẫn xuất của hiđrocacbon?
A. C2H6O, C2H4O2, C6H12O6.
B. C2H4O2, Na2CO3, C2H4.
C. CH4, C2H2, C6H6.
D. CO2, CH4, C2H4O2.
Câu 6: Chất hữu cơ nào sau đây, khi cháy tạo thành số mol khí CO2 nhỏ hơn số mol hơi nước?
A. CH4 B. C2H4
C. C2H2 D. C6H6
Câu 7: Hiđrocacbon X có thành phần phần trăm về khối lượng nguyên tố cacbon trong hợp chất là 85,7 %. X là
A. CH4. B. CH3Cl.
C. C2H4. D. C2H6.
Câu 8: Dãy các chất nào sau đây đều làm mất màu dung dịch brom?
A. CH4; C6H6
B. C2H4; CH4.
C. CH4; C2H4
D. C2H4; C2H2.
Câu 9: Trong các hiđrocacbon sau khi đốt hiđrocacbon nào sinh ra nhiều muội than?
A. C2H6 B. CH4
C. C2H4 D. C6H6
Câu 10: Dãy các chất nào sau đây đều là hiđrocacbon?
A. C2H6, C4H10, C2H4.
B. CH4, C2H2, C3H7Cl.
C. C2H4, CH4, C2H5Cl
D. C2H6O, C3H8, C2H2.
Câu 11: Một hiđrocacbon ở thể khí thường được dùng làm nhiên liệu để hàn cắt kim loại, đó là
A. metan. B. etilen.
C. axetilen. D. etan.
Câu 12: Khi đốt khí axetilen, số mol CO2 và H2O được tạo thành theo tỉ lệ là
A. 2 : 1. B. 1 : 2
C. 1 : 3. D. 1 : 1.
Câu 13: Phân tử nào sau đây có cấu tạo là mạch vòng sáu cạnh đều, có ba liên kết đơn xen kẽ ba liên kết đôi?
A. Axetilen. B. Propan.
C. Benzen. D. Xiclohexan.
Câu 14: Dãy chất gồm toàn hợp chất hữu cơ là:
A. CH4, C2H4, CaCO3, C2H6O
B. C2H2, CH3Cl, C2H6O, CH3COOH.
C. CO2, CH4, C2H5Cl, C2H6O
D. CaO, CH3Cl, CH3COOH, CO2.
Câu 15: Tính chất vật lí chung của metan, etilen, axetilen là
A. Chất khí, không màu, mùi hắc, nhẹ hơn không khí;
B. Chất khí, không màu, tan trong nước, nặng hơn không khí;
C. Chất khí, nặng hơn không khí;
D. Chất khí, không màu, ít tan trong nước, nhẹ hơn không khí.
Câu 16: Một hợp chất hiđrocacbon có chứa 85,7% C và 14,3% H theo khối lượng.
Công thức nào sau đây là phù hợp với hiđrocacbon đó?
A. CH4 B. C2H4
C. C6H6 D. C2H2
Câu 17: Sản phẩm chủ yếu của một hợp chất hữu cơ khi cháy là
A. khí nitơ và hơi nước.
B. khí cacbonic và khí hiđro.
C. khí cacbonic và cacbon.
D. khí cacbonic và hơi nước.
Câu 18: Cho các chất sau: H2O, HCl, Cl2, O2, CO2. Khí metan phản ứng được với
A. H2O, HCl. B. Cl2, O2.
C. HCl, Cl2. D. O2, CO2
Câu 19: Hiđrocacbon nào sau đây phản ứng cộng với dung dịch brom?
A. CH3CH2CH3 B. CH3CH3.
C. C2H4 D. CH4.
Câu 20: Dẫn 1,3 gam khí axetilen qua bình đựng dung dịch brom dư. Khối lượng sản phẩm thu được sau phản ứng là:
A. 34,6 gam B. 17,3 gam
C. 4,325 gam D. 8,65 gam
Câu 21 Trong các công thức hoá học sau, công thức hoá học của chất hữu cơ là
A. CO2. B. Na2CO3
C. CO D. CH4
Câu 22: Trong các hợp chất hữu cơ, cacbon luôn có hoá trị là
A. I. B. IV.
C. III. D. II.
Câu 23: Chất làm mất màu dung dịch nước brom là:
A. CH3 - CH3 B. CH3 – OH
C. CH3 – Cl D. CH2=CH2
Câu 24: Thể tích không khí (VKK = 5) cần dùng để đốt cháy hoàn toàn 1 lít khí etilen ở đktc là
A. 12 lít. B. 13 lít
C. 14 lít. D. 15 lít.
Câu 25: Trong các phản ứng sau phản ứng hóa học đúng là
A. C6H6 + Br → C6H5Br + H
B. C6H6 + Br2 C6H5Br + HBr
C. C6H6 + Br2 → C6H6Br2
D. C6H6 + 2Br C6H5Br + HBr
Câu 26: Hợp chất hữu cơ không có khả năng tham gia phản ứng cộng là
A. metan. B. benzen.
C. etilen. D. axetilen.
Câu 27: Khí axetilen không có tính chất hóa học nào sau đây?
A. Phản ứng cộng với dung dịch brom.
B. Phản ứng cháy với oxi.
C. Phản ứng cộng với hiđro.
D. Phản ứng thế với clo ngoài ánh sáng.
Câu 28: Cho sơ đồ chuyển hóa sau:
X + H2O → Y + Z
Y + O2 T + H2O
T + Ca(OH)2 → CaCO3↓ + H2O
X, Y, Z, T lần lượt là
A. CaC2, CO2, C2H2, Ca(OH)2
B. CaC2, C2H2, CO2, Ca(OH)2.
C. CaC2, C2H2, Ca(OH)2, CO2.
D. CO2, C2H2, CaC2, Ca(OH)2.
Câu 29: Đốt hoàn toàn V lít hỗn hợp khí (ở đktc) gồm CH4 và C2H4 (tỉ lệ mol 1 : 1) rồi cho toàn bộ sản phẩm cháy vào dung dịch nước vôi trong dư thấy xuất hiện 3 gam kết tủa. Giá trị của V là
A. 0,448 lít B. 4,48 lít
C. 0,672 lít D. 6,72 lít.
Câu 30: Cho 6,4 gam đất đèn chứa 80% CaC2 vào nước dư. Thể tích khí thu được (ở đktc) là
A. 0,896 lít. B. 1,12 lít.
C. 1,792 lít. D. 2,24 lít.