Tailieumoi.vn xin giới thiệu Trắc nghiệm Khoa học tự nhiên lớp 7 Bài 7: Hóa trị và công thức hóa học sách Chân trời sáng tạo. Bài viết gồm 20 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm KHTN 7. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 7: Hóa trị và công thức hóa học. Mời các bạn đón xem:
Trắc nghiệm KHTN 7 Bài 7: Hóa trị và công thức hóa học
B. Bài tập trắc nghiệm KHTN 7 Bài 7: Hóa trị và công thức hóa học
Câu 1. Một hợp chất có công thức NxOy, trong đó N chiếm 30,43%. Khối lượng phân tử hợp chất là 46 amu. Công thức hóa học của hợp chất là
A. N2O.
B. NO2.
C. N2O3.
D. N2O5.
Đáp án: B
Giải thích:
Ta có %O = 100% - %N = 100% - 30,43% = 69,57%.
%N = ×100% = ×100% = 30,43%
® x = 1
%O = ×100% = ×100% = 69,57%
® x = 2
Công thức hóa học của hợp chất là NO2.
Câu 2. Soda là hóa chất được dùng rộng rãi trong các ngành công nghiệp thủy tinh, đồ gốm, xà phòng, phẩm nhuộm. Xác định công thức hóa học của soda biết soda có cấu tạo từ Na hóa trị I và nhóm CO3 hóa trị II?
A. NaCO3.
B. Na(CO3)2.
C. Na2CO3.
D. Na2(CO3)3.
Đáp án: C
Giải thích:
Gọi công thức chung của soda là .
Áp dụng quy tắc hóa trị:
x.I = y.II → = =
Lấy x = 2 và y = 1.
Công thức hóa học của soda là Na2CO3.
Câu 3. Pháo hoa có thành phần nhiên liệu nổ gồm sulfur, than và potassium nitrate. Biết potassium nitrate có công thức hóa học là KNO3. Thành phần phần trăm khối lượng của các nguyên tố K, N và O trong potassium nitrate lần lượt là
A. 56,52%, 20,29%, 23,19%.
B. 38,61%, 13,86%, 15,84%.
C. 45,88%, 16,47%, 37,65%.
D. 38,61%, 13,86%, 47,53%.
Đáp án: D
Giải thích:
Khối lượng phân tử KNO3 là:
1.39 + 1.14 + 3.16 = 101 (amu)
Phần trăm khối lượng của các nguyên tố trong KNO3 là:
%K = = 38,61%
%N = = 13,86%
%O = 100% - %K - %N = 100% - 38,61% - 13,86% = 47,53%
Câu 4. Bột thạch cao có nhiều ứng dụng quan trọng trong đời sống. Thành phần chính của bột thạch cao là hợp chất A. Phân tử A có cấu tạo từ nguyên tố calcium (Ca), sulfur (S) và oxygen (O) với tỉ lệ phần trăm tương ứng là 29,41%, 23,53% và 47,06%. Biết khối lượng phân tử của A là 136 amu, công thức hóa học của A là
A. CaSO4.
B. CaSO2.
C. Ca2SO4.
D. CaSO3.
Đáp án: A
Giải thích:
Gọi công thức hóa học của hợp chất A là CaxSyOz.
Phần trăm khối lượng của các nguyên tố trong hợp chất là:
%Ca = ×100% = ×100% = 29,41%
® x = 1
%S = ×100% = ×100% = 23,53%
® y = 1
%O = ×100% = ×100% = 47,06%
® z = 4
Vậy công thức hóa học của hợp chất A là CaSO4.
Câu 5. Thạch nhũ trong hang động có thành phần chính là hợp chất T. Phân tử T có cấu tạo từ nguyên tố calcium, carbon và oxygen với tỉ lệ phần trăm tương ứng là 40%, 12% và 48%. Khối lượng phân tử của T là 100 amu. Nhận định nào sau đây là sai?
A. Trong phân tử T tỉ lệ số nguyên tử Ca : C : O là 1 : 1 : 3.
B. Trong một phân tử T có 2 nguyên tử Ca, 1 nguyên tử C và 3 nguyên tử O.
C. Công thức hóa học của T là CaCO3.
D. Trong hai phân tử T có 2 nguyên tử Ca, 2 nguyên tử C và 6 nguyên tử O.
Đáp án: B
Giải thích:
Gọi công thức hóa học của hợp chất T là CaxCyOz.
Phần trăm khối lượng của các nguyên tố trong hợp chất là:
%Ca = ×100% = ×100% = 40%
® x = 1
%S = ×100% = ×100% = 12%
® y = 1
%O = ×100% = ×100% = 48%
® z = 3
Vậy công thức hóa học của hợp chất T là CaCO3 ® C đúng
Trong một phân tử T có 1 nguyên tử Ca, 1 nguyên tử C và 3 nguyên tử O ® B sai.
Trong hai phân tử T có 2 nguyên tử Ca, 2 nguyên tử C và 6 nguyên tử O ® D đúng.
Trong phân tử T tỉ lệ số nguyên tử Ca: C: O là 1 : 1 : 3 ® A đúng.
Câu 6. Cho hình mô phỏng phân tử ammonia:
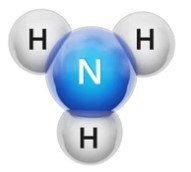
Hóa trị của nguyên tố nitrogen trong phân tử ammonia là
A. I.
B. II.
C. III.
D. IV.
Đáp án: C
Giải thích:
Để xác định hóa trị của nguyên tố trong hợp chất cộng hóa trị, người ta dựa vào hóa trị của nguyên tố đã biết làm đơn vị, chẳng hạn hóa trị của H là I, hóa trị của O là II.
Trong phân tử ammonia, nguyên tử N liên kết với 3 nguyên tử H (mỗi nguyên tử H hóa trị I) nên hóa trị của nguyên tử N là III.
Câu 7. Cho hình mô phỏng phân tử silicon dioxide:
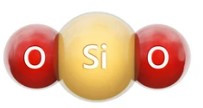
Trong tự nhiên, silicon dioxide có nhiều trong cát, đất sét, ... Hóa trị của nguyên tố silicon trong phân tử silicon dioxide là
A. IV.
B. III.
C. II.
D. I.
Đáp án: A
Giải thích:
Để xác định hóa trị của nguyên tố trong hợp chất cộng hóa trị, người ta dựa vào hóa trị của nguyên tố đã biết làm đơn vị, chẳng hạn hóa trị của H là I, hóa trị của O là II.
Trong phân tử silicon dioxide, nguyên tử Si liên kết với 2 nguyên tử O (mỗi nguyên tử O hóa trị II) nên hóa trị của nguyên tử Si là IV.
Câu 8. Phân tử khí ozone được tạo thành từ 3 nguyên tử ozone liên kết với nhau. Công thức hóa học của phân tử khí ozone là
A. 3O.
B. O3.
C. O3.
D. O3.
Đáp án: B
Giải thích:
Công thức hóa học dùng để biểu diễn chất, gồm một hoặc nhiều kí hiệu nguyên tố và chỉ số ở bên dưới mỗi kí hiệu.
Công thức hóa học của phân tử khí ozone là O3.
Câu 9. Phân tử methane gồm một nguyên tử carbon liên kết với 4 nguyên tử oxygen. Công thức hóa học của phân tử methane là
A. C4H.
B. C2H2.
C. C4H.
D. CH4.
Đáp án: D
Giải thích:
Công thức hóa học dùng để biểu diễn chất, gồm một hoặc nhiều kí hiệu nguyên tố và chỉ số ở bên dưới mỗi kí hiệu.
Công thức hóa học của phân tử methane là CH4.
Câu 10. Công thức hóa học của iron(III) oxide là Fe2O3. Nhận định nào sau đây là sai?
A. Iron(III) oxide do hai nguyên tố Fe, O tạo ra.
B. Trong một phân tử iron(III) oxide có hai nguyên tử Fe, ba nguyên tử O.
C. Khối lượng phân tử iron(III) oxide là 160 amu.
D. Trong phân tử iron(III) oxide tỉ lệ số nguyên tử Fe : O là 3 : 2.
Đáp án: D
Giải thích:
Iron(III) oxide do hai nguyên tố Fe, O tạo ra ® A đúng
Trong một phân tử iron(III) oxide có hai nguyên tử Fe, ba nguyên tử O ® B đúng
Khối lượng phân tử iron(III) oxide là:
2.56 + 3.16 = 160 amu ® C đúng
Trong phân tử iron(III) oxide tỉ lệ số nguyên tử Fe : O là 2 : 3 ® D sai
A. Lý thuyết KHTN 7 Bài 7: Hóa trị và công thức hóa học
I. Hóa trị
1. Định nghĩa
- Hóa trị của một nguyên tố trong hợp chất là con số biểu thị khả năng liên kết của nguyên tử nguyên tố đó với nguyên tử khác trong phân tử.
- Hóa trị được biểu thị bằng các chữ số La Mã (I; II …)
2. Cách xác định
- Để xác định hóa trị của nguyên tố trong hợp chất cộng hóa trị, người ta dựa vào hóa trị của nguyên tố đã biết làm đơn vị, chẳng hạn hóa trị của H là I; hóa trị của O là II.
Ví dụ 1: Trong phân tử phosphine (PH3) một nguyên tử P có khả năng liên kết với 3 nguyên tử H, mỗi nguyên tử H có hóa trị I ⇒ P có hóa trị III
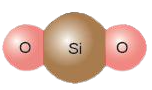
Ví dụ 2: Trong phân tử silicon dioxide (SiO2), 1 nguyên tử Si có khả năng liên kết với 2 nguyên tử O, mỗi nguyên tử O hóa trị II ⇒ Si có hóa trị IV.
II. Quy tắc hóa trị
- Quy tắc hóa trị: Trong phân tử hợp chất hai nguyên tố, tích hóa trị và số nguyên tử của nguyên tố này bằng tích hóa trị và số nguyên tử của nguyên tố kia.
- Ví dụ: Trong phân tử aluminium chlorine (AlCl3), hóa trị và số nguyên tử tham gia liên kết của Al và Cl như sau:
|
Nguyên tố |
Al |
Cl |
|
Hóa trị |
III |
I |
|
Số nguyên tử |
1 |
3 |
|
Tích hóa trị và số nguyên tử |
III × 1 = I × 3 |
|
III. Công thức hóa học
Phân tử của chất được tạo thành từ nguyên tử của một hay nhiều nguyên tố và được biểu diễn bằng công thức hóa học.
1. Viết công thức hóa học của đơn chất
- Công thức hóa học của đơn chất được kí hiệu bằng kí hiệu nguyên tố hóa học kèm với chỉ số (chỉ số nguyên tử của mỗi nguyên tố trong một phân tử) ghi ở bên dưới.
- Một số đơn chất phi kim thể khí (ở điều kiện thường) có công thức hóa học chung là Ax.
Ví dụ: Phân tử khí oxygen được tạo thành từ hai nguyên tử oxygen liên kết với nhau, công thức phân tử của khí oxygen là O2.
- Đối với đơn chất kim loại, hạt hợp thành là nguyên tử nên kí hiệu hóa học của nguyên tố kim loại được coi là công thức hóa học của đơn chất kim loại.
Ví dụ: Kim loại iron có công thức hóa học là Fe.
- Một số đơn chất phi kim ở thể rắn, quy ước công thức hóa học là kí hiệu nguyên tố.
Ví dụ: Công thức hóa học của đơn chất phosphorus là P.
Chú ý:
- Nếu chỉ số trong công thức hóa học bằng 1 thì quy ước không ghi.
- Trong hợp chất gồm oxygen và nguyên tố khác, nguyên tố oxygen thường ghi ở cuối công thức hóa học.
2. Viết công thức hóa học của hợp chất
- Công thức hóa học của hợp chất gồm kí hiệu hóa học của những nguyên tố tạo thành kèm chỉ số ở bên dưới mỗi kí hiệu.
- Công thức chung của phân tử có dạng: AxBy
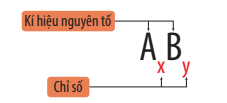
Ví dụ: Phân tử carbon dioxide gồm 1 nguyên tử carbon và 2 nguyên tử oxygen, công thức hóa học của phân tử carbon dioxide là CO2.
- Công thức hóa học cho biết thành phần nguyên tố và số lượng nguyên tử của mỗi nguyên tố có trong phân tử đó. Từ đó, có thể tính được khối lượng phân tử.
Chú ý: Cách viết công thức hóa học hợp chất
- Hợp chất tạo bởi oxygen và nguyên tố khác, công thức hóa học có dạng AxOy.
- Nếu A là kim loại và B là phi kim, công thức hóa học có dạng AxBy.
- Hợp chất tạo bởi hydrogen và nguyên tố A:
+ Nếu A thuộc các nhóm IA đến VA, công thức hóa học có dạng AHx.
+ Nếu A thuộc các nhóm VIA đến VIIA, công thức hóa học có dạng HxA.
IV. Tính phần trăm nguyên tố trong hợp chất
- Phần trăm (%) nguyên tố trong hợp chất được tính bằng tỉ số giữa khối lượng của nguyên tố đó trong một phân tử hợp chất và khối lượng phân tử (KLPT) của hợp chất.
- Khối lượng của nguyên tố trong một phân tử hợp chất được tính bằng tích của khối lượng nguyên tử (KLNT) và số nguyên tử của nguyên tố đó.
- Tổng quát:
+ Với hợp chất AxBy, ta có:
+ Tổng tất cả các phần trăm nguyên tố trong một phân tử luôn bằng 100%.
- Ví dụ: Đối với hợp chất MgCl2
%Mg = = = 25,26%
%O = 100% - 25,26% = 74,74%
V. Xác định công thức hóa học
1. Xác định công thức hóa học khi biết phần trăm nguyên tố và khối lượng phân tử
- Các bước xác định:
Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát);
Bước 2: Lập biểu thức tính phần trăm nguyên tố có trong hợp chất;
Bước 3: Xác định số nguyên tử của mỗi nguyên tố và viết công thức hóa học cần tìm.
- Ví dụ: Thạch nhũ trong hang động có thành phần chính là hợp chất (T). Phân tử (T) có cấu tạo từ nguyên tố calcium, carbon và oxygen với các tỉ lệ phần trăm tương ứng là 40%, 12% và 48%. Khối lượng phân tử (T) là 100 amu. Hãy xác định công thức hóa học của (T).
Hướng dẫn giải:
Đặt công thức hóa học của hợp chất (T) là: CaxCyOz
%Ca = = 40%
⇒ x = 1
%C = = 12%
⇒ y = 1
%O = = 48%
⇒ z = 3
Vậy công thức hóa học của hợp chất là CaCO3
2. Xác định công thức hóa học dựa vào quy tắc hóa trị
- Các bước xác định:
+ Bước 1: Đặt công thức hóa học cần tìm (công thức tổng quát)
+ Bước 2: Lập biểu thức tính dựa vào quy tắc hóa trị, chuyển thành tỉ lệ các chỉ số nguyên tử.
+ Bước 3: Xác định số nguyên tử (những số nguyên đơn giản nhất, có tỉ lệ tối giản) và viết công thức hóa học cần tìm.
- Ví dụ: Hợp chất tạo bởi oxygen và phosphorus có dạng:
Theo quy tắc hóa trị ta có: x × V = y × II
Chuyển thành tỉ lệ:
Chọn x = 2; y = 5
Vậy công thức hóa học của hợp chất là P2O5
Chú ý:
- Quy tắc hóa trị thường đúng với đa số hợp chất vô cơ. Tuy nhiên, quy tắc này không đúng với đa số hợp chất hữu cơ (C2H4; C6H6 …) và một số hợp chất vô cơ (H2O2; Na2O2 …)
Xem thêm các bài trắc nghiệm Khoa học tự nhiên 7 Chân trời sáng tạo hay, chi tiết khác:
Trắc nghiệm KHTN 7 Bài 6: Giới thiệu về liên kết hóa học
Trắc nghiệm KHTN 7 Bài 7: Hóa trị và công thức hóa học
Trắc nghiệm KHTN 7 Bài 8: Tốc độ chuyển động
Trắc nghiệm KHTN 7 Bài 9: Đồ thị quãng đường - thời gian
Trắc nghiệm KHTN 7 Bài 10: Đo tốc độ
Trắc nghiệm KHTN 7 Bài 11: Tốc độ và an toàn giao thông