Tailieumoi.vn xin giới thiệu Trắc nghiệm Khoa học tự nhiên lớp 7 Bài 2: Nguyên tử sách Chân trời sáng tạo. Bài viết gồm 20 câu hỏi trắc nghiệm với đầy đủ các mức độ và có hướng dẫn giải chi tiết sẽ giúp học sinh ôn luyện kiến thức và rèn luyện kĩ năng làm bài trắc nghiệm KHTN 7. Ngoài ra, bài viết còn có phần tóm tắt nội dung chính lý thuyết Bài 2: Nguyên tử. Mời các bạn đón xem:
Trắc nghiệm KHTN 7 Bài 2: Nguyên tử
A. Bài tập trắc nghiệm KHTN 7 Bài 2: Nguyên tử
Câu 1. Cho sơ đồ nguyên tử nitrogen như sau:
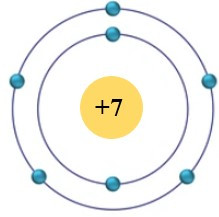
Số đơn vị điện tích hạt nhân của nguyên tử nitrogen là
A. +7.
B. 7.
C. 5.
D. 2.
Đáp án: C
Giải thích:
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân và phân bố theo từng lớp với số lượng electron nhất định trên mỗi lớp ở vỏ nguyên tử A đúng
Lớp đầu tiên gần sát hạt nhân chứa tối đa 2 electron, lớp thứ hai chứa tối đa 8 electron B đúng và C sai
Các electron được sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết D đúng
Câu 2. Tại sao các nguyên tử trung hòa về điện?
A. Trong nguyên tử, số hạt proton và electron luôn bằng nhau.
B. Trong nguyên tử, số hạt neutron và proton luôn bằng nhau.
C. Trong nguyên tử, số hạt electron và neutron luôn bằng nhau.
D. Trong nguyên tử, số hạt negatron và electron luôn bằng nhau.
Đáp án: A
Giải thích:
Trong nguyên tử, số hạt proton và electron luôn bằng nhau, chúng có trị số điện tích bằng nhau nhưng trái dấu. Do đó nguyên tử trung hòa về điện.
Câu 3. Cho biết sơ đồ của nguyên tử carbon như sau:
Số lớp electron và số electron lớp ngoài cùng của nguyên tử carbon lần lượt là
A. 2 và 6 electron.
B. 3 và 4 electron.
C. 3 và 6 electron.
D. 2 và 4 electron.
Đáp án: D
Giải thích:
Dựa vào sơ đồ của nguyên tử carbon ta thấy:
Nguyên tử carbon có hai lớp electron.
Lớp thứ nhất (trong cùng) chứa 2 electron.
Lớp thứ hai (ngoài cùng) chứa 4 electron.
Câu 4. Nguyên tử sodium có 11 proton và 12 neutron. Khối lượng gần đúng của nguyên tử sodium là
A. 11 amu.
B. 12 amu.
C. 23 amu.
D. 24 amu.
Đáp án: C
Giải thích:
Một proton có khối lượng gần đúng bằng khối lượng của một neutron và xấp xỉ bằng 1 amu.
Khối lượng gần đúng của nguyên tử sodium là: 11×1 + 12×1 = 23 (amu).
Câu 5. Cho các phát biểu sau:
(1) Trong mỗi nguyên tử, số hạt proton và electron luôn bằng nhau.
(2) Điện tích hạt nhân bằng tổng điện tích của các hạt proton trong nguyên tử.
(3) Khối lượng hạt nhân được coi là khối lượng nguyên tử.
(4) Proton và electron có khối lượng xấp xỉ bằng nhau.
Số phát biểu đúng là
A. 1.
B. 2.
C. 3.
D. 4.
Đáp án: C
Giải thích:
Phát biểu đúng: (1), (2), (3)
Phát biểu sai: (4)
Sửa phát biểu sai: Proton và neutron có khối lượng xấp xỉ bằng nhau (gần bằng 1 amu). Electron có khối lượng rất bé (chỉ bằng khoảng 0,00055 amu), nhỏ hơn rất nhiều lần so với khối lượng của proton và neutron.
Câu 6. Phát biểu nào sau đây không mô tả đúng mô hình nguyên tử của Rutherford - Bohr?
A. Nguyên tử gồm các electron được sắp xếp thành từng lớp và chuyển động xung quanh hạt nhân theo quỹ đạo giống như hành tinh trong hệ Mặt Trời.
B. Nguyên tử có cấu tạo gồm hạt nhân ở bên trong và vỏ tạo bởi một hay nhiều electron.
C. Hạt nhân nguyên tử mang điện tích dương, electron mang điện tích âm.
D. Nguyên tử có cấu tạo gồm hạt nhân ở bên trong và vỏ tạo bởi một hay nhiều proton.
Đáp án: D
Giải thích:
Theo Rutherford, nguyên tử có cấu tạo gồm hạt nhân ở bên trong và vỏ tạo bởi một hay nhiều electron (kí hiệu là e) mang điện tích âm. Bên trong hạt nhân chứa các hạt proton (kí hiệu là p) mang điện tích dương D sai
Câu 7. Các hạt cấu tạo nên hầu hết các nguyên tử là
A. electron, proton và negatron.
B. electron, proton và neutron.
C. neutron và electron.
D. proton và neutron.
Đáp án: B
Giải thích:
Nguyên tử có cấu tạo gồm hạt nhân ở bên trong và vỏ tạo bởi một hay nhiều electron (kí hiệu là e) mang điện tích âm. Bên trong hạt nhân chứa các hạt proton (kí hiệu là p) mang điện tích dương và hạt neutron (kí hiệu là n) không mang điện.
Các hạt cấu tạo nên hầu hết các nguyên tử là proton, electron và neutron.
Câu 8. Trong nguyên tử, hạt mang điện tích âm là
A. negatron.
B. neutron.
C. electron.
D. proton.
Đáp án: C
Giải thích:
Theo Rutherford, nguyên tử có cấu tạo gồm hạt nhân ở bên trong và vỏ tạo bởi một hay nhiều electron (kí hiệu là e) mang điện tích âm.
Câu 9. Hạt nhân nguyên tử được tạo thành từ các hạt
A. proton và neutron.
B. electron và neutron.
C. electron, proton và neutron.
D. proton và electron.
Đáp án: A
Giải thích:
Bên trong hạt nhân chứa các hạt proton (kí hiệu là p) mang điện tích dương và hạt neutron (kí hiệu là n) không mang điện.
Câu 10. Phát biểu nào sau đây không mô tả đúng vỏ nguyên tử theo mô hình nguyên tử của Rutherford - Bohr?
A. Các electron chuyển động rất nhanh xung quanh hạt nhân và phân bố theo từng lớp.
B. Lớp đầu tiên gần sát hạt nhân chứa tối đa 2 electron, lớp thứ hai chứa tối đa 8 electron.
C. Các electron được phân bố theo từng lớp với số lượng electron trên mỗi lớp là như nhau.
D. Các electron được sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết.
Đáp án: C
Giải thích:
Trong nguyên tử, các electron chuyển động rất nhanh xung quanh hạt nhân và phân bố theo từng lớp với số lượng electron nhất định trên mỗi lớp ở vỏ nguyên tử A đúng
Lớp đầu tiên gần sát hạt nhân chứa tối đa 2 electron, lớp thứ hai chứa tối đa 8 electron B đúng và C sai
Các electron được sắp xếp vào các lớp theo thứ tự từ trong ra ngoài cho đến hết D đúng
B. Lý thuyết KHTN 7 Bài 2: Nguyên tử
I. Mô hình nguyên tử Rutherford – Bohr
1. Sơ lược về nguyên tử
- Nguyên tử có kích thước vô cùng nhỏ, tạo nên các chất.
Ví dụ:
+ Kim cương được cấu tạo nên từ các nguyên tử carbon.

Chú ý: Không thể quan sát nguyên tử bằng kính hiển vi quang học thông thường. Người ta sử dụng kính hiển vi điện tử với độ phóng đại lớn để quan sát nguyên tử.
2. Khái quát về mô hình nguyên tử
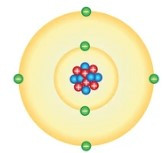
∎ Theo Ernest Rutherford (1871 – 1937):
- Nguyên tử có cấu tạo gồm:
+ Vỏ tạo bởi một hay nhiều electron (kí hiệu là e), mỗi electron mang điện tích -1.
+ Hạt nhân ở bên trong chứa các hạt proton (kí hiệu là p), mỗi proton mang điện tích +1.
- Trong nguyên tử, số proton = số electron nên nguyên tử trung hòa về điện.
- Trong hạt nhân nguyên tử:
+ Điện tích hạt nhân = tổng điện tích các hạt proton.
+ Số đơn vị điện tích hạt nhân = số proton.
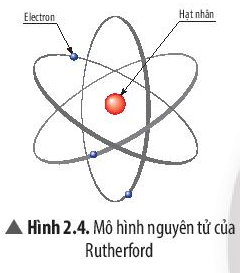
∎ Sau này, dựa trên mô hình của Rutherford, Niels Bohr đã phát triển một mô hình hoàn thiện hơn về nguyên tử:
- Mô hình Rutherford – Bohr: Trong nguyên tử, các electron ở vỏ được xếp thành từng lớp và chuyển động xung quanh hạt nhân theo những quỹ đạo như các hành tinh quay xung quanh Mặt Trời.
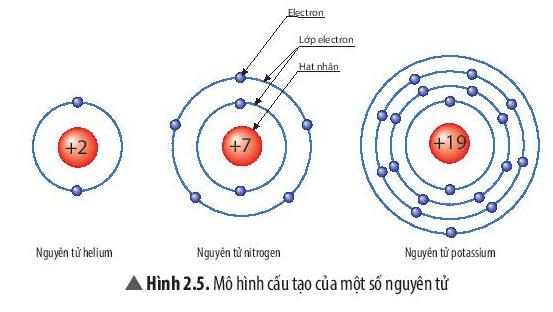
Chú ý:
Các electron chuyển động rất nhanh xung quanh hạt nhân và phân bố thành từng lớp với số lượng electron nhất định.
+ Lớp đầu tiên gần sát hạt nhân chứa tối đa 2 electron.
+ Lớp thứ hai chứa tối đa 8 electron, …
∎ Năm 1932, sau khi nghiên cứu sâu hơn về nguyên tử bằng các thiết bị tiên tiến, James Chadwick (1891 – 1974) đã phát hiện ra bên trong hạt nhân còn có hạt không mang điện, gọi là neutron.
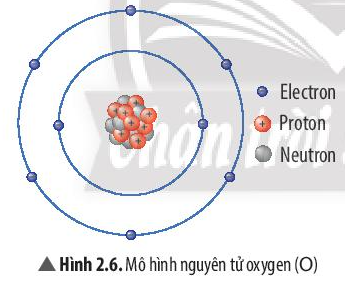
II. Khối lượng nguyên tử
- Khối lượng nguyên tử là khối lượng của một nguyên tử, bằng tổng khối lượng các hạt (proton, neutron và electron) có trong nguyên tử.
- Tuy nhiên, khối lượng nguyên tử rất nhỏ nên để biểu thị khối lượng nguyên tử người ta sử dụng đơn vị khối lượng nguyên tử, viết tắt là amu (atomic mass unit, 1 amu = 1,6605 × 10-24 gam).
- Proton và neutron có khối lượng xấp xỉ nhau (gần bằng 1 amu); electron có khối lượng rất bé (chỉ bằng khoảng 0,00055 amu). Do đó, có thể xem như khối lượng của hạt nhân là khối lượng của nguyên tử.
- Cách tính: Khối lượng nguyên tử = số proton + số neutron.
Ví dụ: Nguyên tử magnesium (Mg) trong hạt nhân có 12 proton và 12 neutron
⇒ Khối lượng nguyên tử magnesium (Mg) = 12 + 12 = 24 (amu)
Xem thêm các bài trắc nghiệm Khoa học tự nhiên 7 Chân trời sáng tạo hay, chi tiết khác:
Trắc nghiệm KHTN 7 Bài 1: Phương pháp và kĩ năng học tập môn Khoa học tự nhiên
Trắc nghiệm KHTN 7 Bài 2: Nguyên tử
Trắc nghiệm KHTN 7 Bài 3: Nguyên tố hóa học
Trắc nghiệm KHTN 7 Bài 4: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm KHTN 7 Bài 5: Phân tử - Đơn chất – Hợp chất
Trắc nghiệm KHTN 7 Bài 6: Giới thiệu về liên kết hóa học