Với tóm tắt lý thuyết Hóa học lớp 9 Chương 3: Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học hay, chi tiết cùng với 350 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Chương 3: Phi kim. Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Trắc nghiệm bài 25: Tính chất của phi kim
Bài 1: Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với:
A. Hiđro hoặc với kim loại
B. Dung dịch kiềm
C. Dung dịch axit
D. Dung dịch muối
Lời giải
Để so sánh mức độ hoạt động mạnh, yếu của phi kim thường được xem xét qua khả năng phản ứng của phi kim đó với hiđro hoặc với kim loại
Đáp án: A
Bài 2: Mức độ hoạt động hóa học mạnh hay yếu của phi kim được xét căn cứ vào khả năng và mức độ phản ứng của phi kim đó với
A. oxi và kim loại.
B. hiđro và oxi.
C. kim loại và hiđro.
D. cả oxi, kim loại và hiđro.
Lời giải
Mức độ hoạt động mạnh hay yếu của phi kim căn cứ vào khả năng của phi kim đó phản ứng với cả oxi, kim loại và hiđro.
Đáp án: D
Bài 3: Để chuyển 11,2 gam Fe thành FeCl3 thì thể tích khí clo (đktc) cần dùng là
A. 6,72 lít.
B. 3,36 lít.
C. 4,48 lít.
D. 2,24 lít.
Lời giải
nFe = 0,2 mol
2Fe + 3Cl2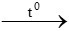 2FeCl3
2FeCl3
0,2 → 0,3 mol
=> V = 0,3.22,4 = 6,72 lít
Đáp án: A
Bài 4: Hỗn hợp khí X gồm O2, Cl2, CO2 SO2. Để thu được O2 tinh khiết, người ta dẫn X qua:
A. nước brom
B. dd NaOH
C. dd HCl
D. nước clo
Lời giải
Để thu được O2 tinh khiết, người ta dẫn X qua dung dịch NaOH vì Cl2, CO2 và SO2 đều có phản ứng
2NaOH + Cl2 → NaCl + NaClO + H2O
CO2 + 2NaOH → Na2CO3 + H2O
SO2 + 2NaOH → Na2SO3 + H2O
Đáp án: B
Bài 5: Để phân biệt SO2 và SO3 có thể dùng một hóa chất sau:
A. dd BaCl2
B. dd NaOH
C. dd H2SO4
D. dd Ba(OH)2
Lời giải
Để phân biệt SO2 và SO3 có thể dùng dung dịch BaCl2. SO2 không hiện tượng còn SO3 tạo kết tủa trắng
SO3 + H2O → H2SO4
H2SO4 + BaCl2 → BaSO4↓ + 2HCl
Đáp án: A
Bài 6: Cho 10,8 gam kim loại M hóa trị III tác dụng với khí clo dư thì thu được 53,4 gam muối. Hãy xác định kim loại M?
A. Fe B. Cr
C. Al D. Mg
Lời giải
2M + 3Cl2 → 2MCl3
Theo PT: 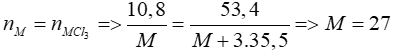
=> M là Al
Đáp án: C
Bài 7: X là nguyên tố phi kim có hóa trị III trong hợp chất với hiđro. Biết thành phần phần trăm khối lượng của hiđro trong hợp chất là 17,65%. X là nguyên tố:
A. C B. N
C. S D. P
Lời giải
Gọi phi kim cần tìm là X
=> hợp chất hiđro của X là: XH3
Ta có: phần trăm khối lượng của hiđro trong hợp chất là 17,65%
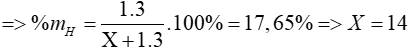
=> X là nguyên tố N
Đáp án: B
Bài 8: Hỗn hợp X gồm Zn, Mg và Fe. Hòa tan hết m gam X vào dung dịch HCl thu được 11,20 lít khí (đktc). Mặt khác, để tác dụng vừa hết m gam X cần 12,32 lít clo (đktc). Khối lượng của Fe trong hỗn hợp là
A. 2,8 gam
B. 5,6 gam
C. 8,4 gam
D. 11,2 gam
Lời giải
Gọi số mol của Zn, Mg và Fe lần lượt là x, y và z mol
TN1: tác dụng với dung dịch HCl tạo 0,5 mol khí H2
Zn + 2HCl → ZnCl2 + H2
x mol → x mol
Mg + 2HCl → MgCl2 + H2
y mol → y mol
Fe + 2HCl → FeCl2 + H2
z mol → z mol
⇒∑nH2 = x + y + z = 0,5 (1)
TN2: tác dụng với 0,55 mol Cl2
Zn + Cl2 → ZnCl2
x → x
Mg + Cl2 → MgCl2
y → y
2Fe + 3Cl2 → 2FeCl3
z → 1,5z
⇒∑nCl2 = x + y + 1,5z = 0,55 (2)
Lấy (2) trừ (1) => 0,5z = 0,55 – 0,5 => z = 0,1 mol
=> mFe = 0,1.56 = 5,6 gam
Đáp án: B
Bài 9: Dãy các nguyên tố được sắp xếp đúng theo chiều tính phi kim tăng dần:
A. O,F, P.
B. P, O, F.
C. F, O, P.
D. O, P, F.
Lời giải
Tính phi kim: P < O < F
Đáp án: B
Bài 10: Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái
A. Lỏng và khí
B. Rắn và lỏng
C. Rắn và khí
D. Rắn, lỏng, khí
Lời giải
Ở điều kiện thường, phi kim có thể tồn tại ở trạng thái rắn, lỏng, khí
Đáp án: D
Bài 11: Dãy gồm các phi kim thể khí ở điều kiện thường
A. S, P, N2, Cl2
B. C, S, Br2, Cl2
C. Cl2, H2, N2, O2
D. Br2, Cl2, N2, O2
Lời giải
Dãy gồm các phi kim thể khí ở điều kiện thường là: Cl2, H2, N2, O2
Loại A vì S ở thể rắn
Loại B và D vì Br2 ở thể lỏng
Đáp án: C
Bài 12: Dãy gồm các nguyên tố phi kim là
A. C, S, O, Fe
B. Cl, C, P, S
C. P, S, Si, Ca
D. K, N, P, Si
Lời giải
Dãy gồm các nguyên tố phi kim là Cl, C, P, S
Đáp án: B
Bài 13: Dãy phi kim tác dụng với oxi tạo thành oxit là
A. S, C, P
B. S, C, Cl2
C. C, P, Br2
D. C, Cl2, Br2
Lời giải
Dãy phi kim tác dụng với oxi tạo thành oxit là S, C, P
S + O2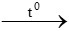 SO2
SO2
C + O2 CO2
CO2
4P + 5O2  2P2O5
2P2O5
Loại B, C và D vì Cl2 và Br2 không phản ứng với O2
Đáp án: A
Câu 14: Cho 6,6 gam CO2 đi qua 200ml dung dịch KOH 1M. Sau phản ứng kết thúc, thu được những sản phẩm muối nào?
A. Muối trung hòa K2CO3
B. Muối axit KHCO3
C. Cả hai loại muối
D. Không xác định được
Đáp án: C
Câu 15: Hỗn hợp gồm các khí: CO, CO2, SO3 có thể nhận biết sự hiện diện các chất khí bằng cách:
A. Dẫn hỗn hợp qua dung dịch BaCl2
B. Dẫn hỗn hợp qua dung dịch BaCl2, sau đó qua dung dịch nước vôi trong.
C. Dẫn hỗn hợp qua dung dịch nước vôi trong.
D. Tất cả đều đúng.
Đáp án: B
Câu 16: Cho a mol P2O5 vào dung dịch chứa 0,015 mol NaOH. Dung dịch sau phản ứng chứa 2 muối NaH2PO4 và Na2HPO4 với số mol bằng nhau. Gái trị của a là:
A. 0,010
B. 0,015
C. 0,005
D.0,002
Đáp án: C
Câu 17: Hỗn hợp khí X gồm O2 Cl2, CO2 SO2. Để thu được O2 tinh khiết, người ta dẫn X qua:
A. nước brom
B. dd NaOH
C. dd HCl
D. nước clo
Đáp án: B
Câu 18: Có 4 lọ đựng 4 khí riêng biệt: oxi, hidro, clo và khí cacbonic. Bằng cách nào trong các cách sau đây để phân biệt mỗi khí trên (tiến hành theo trình tự sau);
A. Dùng nước vôi trong dư
B. Dùng nước vôi trong dư, dùng quỳ tím ấm
C. Dùng tàn đom đóm, dùng quỳ tím ẩm
D. Dùng quỳ tím ẩm, dùng nước vôi trong
Đáp án: C
Câu 19: Sản phẩm của phản ứng khi đốt cháy hoàn toàn lần lượt lưu huỳnh, hiđro, cacbon, photpho, trong khí oxi dư là :
A. SO2 , H2O, CO2 , P2O5
B. SO3 , H2O, CO2 , P2O5
C. SO2 , H2O, CO , P2O5
D. SO3 , H2O, CO , P2O5
Đáp án: A
Câu 20: Cho sơ đồ biến đổi sau: Phi kim → Oxit axit (1) → Oxit axit (2) → Axit
Dãy chất phù hợp với sơ đồ trên là:
A. S → SO2 →SO3 → H2SO4
B. C → CO → CO2 → H2CO3
C. P →P2O3 → P2O5 →H3PO3
D. N2 → NO →N2O5 →HNO3
Đáp án: A
Trắc nghiệm bài 26: Clo
Bài 1: Nước clo thường được dùng phổ biến để diệt trùng trong bể bơi. Vậy nước clo là:
A. HCl.
B. HClO.
C. HCl và HClO.
D. H2O.
Lời giải
Cl2 tan một phần trong nước tạo ra dd nước clo có tính sát khuẩn nên được dùng trong các bể bơi.
Cl2 + H2O ⇆ HCl + HClO (dd nước clo)
Đáp án: C
Bài 2: Clo tác dụng với hiđro tạo thành sản phẩm gì?
A. Hiđro clorua
B. Hiđro florua
C. Hiđro bromua
D. Hiđro iotua
Lời giải
Clo tác dụng với hiđro tạo thành hiđro clorua
H2 + Cl2 → 2HCl
Đáp án: A
Bài 3: Trong công nghiệp, clo được điều chế bằng phương pháp gì?
A. Điện phân dung dịch
B. Thủy phân
C. Nhiệt phân
D. Điện phân nóng chảy
Lời giải
Trong công nghiệp, clo được điều chế bằng phương pháp điện phân dung dịch
Đáp án: A
Bài 4: Clo tác dụng với sắt dư, sản phẩm thu được là:
A. FeCl3
B. FeCl2
C. Fe
D. Fe và FeCl3
Lời giải
Clo tác dụng với sắt xảy ra phản ứng:
3Cl2 + 2Fe → 2FeCl3
Tuy Fe dư nhưng đây không phải trong dung dịch, do đó Fe không tiếp tục phản ứng với FeCl3 để tạo ra FeCl2
Vậy sản phâm thu được gồm Fe và FeCl3
Đáp án: D
Bài 5: Cho dung dịch NaOH 1M để tác dụng vừa đủ với 1,12 lít khí clo (đktc). Nồng độ mol của muối natri clorua thu được là
A. 0,05M.
B. 0,5M.
C. 1,0M.
D. 1,5M.
Lời giải
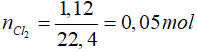
2NaOH + Cl2 → NaCl + NaClO + H2O
0,1 ← 0,05 → 0,05 mol
Đáp án: B
Bài 6: Hòa tan hoàn toàn 52,2 gam MnO2 trong dung dịch HCl đặc, nóng, dư thì sau phản ứng thu được bao nhiêu lít khí Cl2 (đktc)?
A. 6,72 lít.
B. 13,44 lít.
C. 14,56 lít.
D. 19,2 lít.
Lời giải
MnO2 + 4HCl → MnCl2 + Cl2 + 2H2O
⇒ nCl2 = nMnO2 = 0,6 mol
=> V = 13,44 lít
Đáp án: B
Bài 7: Nguyên liệu được dùng để điều chế khí clo trong phòng thí nghiệm là:
A. H2SO4
B. HCl đặc
C. HNO3
D. H2SO3
Lời giải
Nguyên liệu được dùng để điều chế khí clo trong phòng thí nghiệm là HCl đặc
MnO2(r) + 4HClđặc → MnCl2 + Cl2(k) + 2H2O
Đáp án: B
Bài 8: Mô hình điều chế khí clo trong phòng thí nghiệm được cho như hình vẽ bên (Hình 1). Quy trình thí nghiệm xảy ra như sau:
Nhỏ từ từ dung dịch (1) xuống bình cầu có chứa chất rắn màu đen (2). Đun nóng hỗn hợp thì thoát ra khí clo (màu vàng lục). Khí clo sinh ra di chuyển theo hệ thống bình (3); (4); (5). Tại bình số (5), khí clo được giữ lại. Để tránh việc clo thoát ra ngoài không khí, người ta tẩm vào (6) dung dịch T. Vậy (6) là:
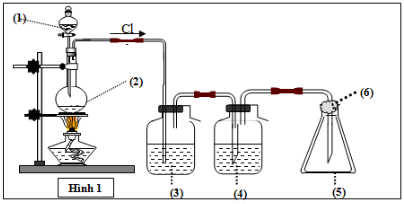
A. HCl.
B. NaOH.
C. H2SO4.
D. NaCl.
Lời giải
Để tránh Cl2 thoát ra ngoài không khí, người ta tẩm NaOH vào (6). Vì Cl2 có phản ứng với NaOH do đó bị giữ lại
PTPƯ: Cl2 + 2NaOH → NaCl + NaClO + H2O
Đáp án: B
Bài 9: Dung dịch hỗn hợp hai muối natri clorua và natri hipoclorit được gọi là gì?
A. Nước gia-ven
B. Nước muối
C. Nước axeton
D. Nước cất
Lời giải
Dung dịch hỗn hợp hai muối natri cloruavà natri hipoclorit được gọi là nước gia-ven
Đáp án: A
Bài 10: Dung dịch nước clo có màu gì?
A. Xanh lục
B. Hồng
C. Tím
D. Vàng lục
Lời giải
Nước clo là dung dịch hỗn hợp các chất HCl, HClO và Cl2 nên có màu vàng lục, mùi hắc của khí clo.
Đáp án: D
Bài 11: Có 3 khí đựng riêng biệt trong 3 lọ là oxi, clo, hiđroclorua. Để phân biệt các khí đó có thể dùng một hóa chất là
A. quì tím ẩm
B. dd NaOH
C. dd AgNO3
D. dd brom
Lời giải
Để phân biệt 3 khí O2, Cl2 và HCl ta dùng giấy quỳ tím ẩm.
- O2 không làm đổi màu quỳ
- Cl2 làm mất màu quỳ tím ẩm (do có tính tẩy màu)
- HCl làm quỳ tím ẩm hóa đỏ (vì HCl tan vào nước tạo thành axit HCl)
Đáp án: A
Bài 12: Có 4 lọ đựng 4 khí riêng biệt: oxi, hiđro, clo và khí cacbonic. Bằng cách nào trong các cách sau đây để phân biệt mỗi khí trên (tiến hành theo trình tự sau):
A. Dùng nước vôi trong dư.
B. Dùng nước vôi trong dư, sau đó dùng quỳ tím ẩm.
C. Dùng tàn đom đóm, sau đó dùng quỳ tím ẩm.
D. Dùng quỳ tím ẩm, sau đó dùng nước vôi trong.
Lời giải
Ban đầu dùng tàn đóm đỏ => khí làm tàn đóm bùng cháy là O2
H2, Cl2, CO2 đều làm tàn đóm tắt
Sau đó dùng quỳ tím ẩm, khí làm mất màu quỳ ẩm là Cl2, khí làm quỳ ẩm hóa đỏ là CO2, khí không hiện tượng là H2
Đáp án: C
Câu 13: Nước clo có tính tẩy màu và sát trùng vì có đặc điểm nào sau đây?
A. Tạo ra ion Cl+ có tính oxi hóa mạnh
B. Tạo ra axit HClO có tính oxi hóa mạnh
C. Clo tác dụng với nước tạo ra HCl có tính tẩy màu
D. Clo có tính oxi hóa mạnh
Đáp án: B
Câu 14: Phương pháp để thu khí clo trong phòng thí nghiệm là:
A. Phương pháp đẩy không khí
B. Thu qua dung dịch NaCl bão hòa
C. Thu qua nước nóng
D. Cả ba phương pháp trên
Câu 15: Phát biểu nào sau đây là không đúng khi nói về số oxi hóa của clo?
A. Clo có số oxi hóa đặc trưng là -1
B. Clo chỉ có một số oxi hóa là -1
C. Clo có thể có các oxi hóa sau: -1; +1; +3; +5; +7
D. Do clo có phân lớp 3d còn trống nên clo có nhiều số oxi hóa
Đáp án: B
Câu 16: Đốt cháy 11,9 gam hỗn hợp gồm Zn, Al trong khí Cl2 dư. Sauk hi các phản ứng xảy ra hoàn toàn, thu được 40,3 gam hỗn hợp muối. Thể tích khí Cl2 (đktc) đã phản ứng là
A. 17,92 lít.
B. 6,72 lít.
C. 8,96 lít.
D. 11,20 lít.
Đáp án: C
Câu 17: Nguyên tố nào sau đây không phản ứng trực tiếp với clo?
A. Cacbon
B. Magie
C. Kẽm
D. Lưu huỳnh
Đáp án: A
Câu 18: Nguyên tố Cl ở ô thứ 17 trong bảng tuần hoàn, cấu hình electron của ion Cl- là :
A. 1s22s22p63s23p4.
B. 1s22s22p63s23p2.
C. 1s22s22p63s23p6.
D. 1s22s22p63s23p5.
Đáp án: C
Câu 19: Hiện tượng sẽ quan sát được khi cho nước clo thêm dần vào dung dịch KI có chứa sẵn hồ tinh bột?
A. Có hơi màu tím bay lên
B. Dung dịch chuyển sang màu vàng
C. Dung dịch có màu xanh đặc trưng
D. Không có hiện tượng gì
Đáp án: C
Câu 20: Khi hạ nhiệt độ xuống giá trị -100,98∘C thì khí clo sẽ hóa rắn. Ở trạng thái rắn, clo thuộc loại tinh thể nào?
A. Tinh thể ion
B. Tinh thể nguyên tử
C. Tinh thể phân tử
D. Không xác định được
Đáp án: C
Câu 21: Phản ứng nào sau đây thể hiện clo vừa có tính khử vừa có tính oxi hóa?
A. 3Cl2 + 2NH3 → 6HCl + N2
B. Cl2 + SO2 + 2H2O → 2HCl + H2SO4
C. Cl2 + 2NaOH → NaCl + NaClO + H2O
D. 3Cl2 + 2Fe → 2FeCl3
Đáp án: A
Câu 22: Cho 7,84 lít hỗn hợp khí X (đktc) gồm Cl2 và O2 phản ứng vừa đủ với 11,1 gam hỗn hợp Y gồm Mg và Al, thu được 30,1 gam hỗn hợp Z. Phần trăm khối lượng của Al trong Y là
A. 75,68%.
B. 24,32%.
C. 51,35%.
D. 48,65%.
Đáp án: B
Câu 23: Sục Cl2 vào nước, thu được nước clo màu vàng nhạt. Trong nước clo có chứa các chất là :
A. Cl2, H2O.
B. HCl, HClO.
C. HCl, HClO, H2O.
D. Cl2, HCl, HClO, H2O.
Câu 24: Hoà tan khí Cl2 vào dung dịch KOH đặc, nóng, dư. Dung dịch thu được có các chất thuộc dãy nào dưới đây ?
A. KCl, KClO3, Cl2.
B. KCl, KClO3, KOH, H2O.
C. KCl, KClO, KOH, H2O.
D. KCl, KClO3.
Đáp án: B
Câu 25: Cho 10,8 gam kim loại M hóa trị III tác dụng với khí clo dư thì thu được 53,4 gam muối. Kim loại M là:
A. Al
B. Cr
D.Ni
Đáp án: C
Trắc nghiệm bài 27: Cacbon
Bài 1: Cacbon có thể tạo với oxi hai oxit là:
A. CO, CO3
B. CO2, CO3
C. CO, CO2
D. CO2, C2O4
Lời giải
Cacbon có thể tạo với oxi 2 oxit là CO, CO2
C + O2 CO2
CO2
C + CO2 2CO
2CO
Đáp án: C
Bài 2: Cacbon tạo thành một số dạng thù hình là:
A. Kim cương
B. Than chì
C. Fuleren
D. Cả A, B, C và cacbon vô địch hình
Lời giải
Cacbon tạo thành một số dạng thù hình là: Kim cương, than chì, fuleren và cacbon vô địch hình.
Đáp án: D
Bài 3: Khi mở các chai nước giải khát có ga thấy xuất hiện hiện tượng sủi bọt vì:
A. Áp suất của khí CO2 trong chai nhỏ hơn áp suất của khí quyển, khi mở nút chai dưới áp suất của khí quyển, độ tan giảm đi, khí CO2 trong dung dịch thoát ra.
B. Áp suất của khí CO2 trong chai bằng áp suất của khí quyển, khi mở nút chai dưới áp suất của khí quyển, độ tan giảm đi, khí CO2 trong dung dịch thoát ra.
C. Áp suất của khí CO2 trong chai bằng áp suất của khí quyển, khi mở nút chai dưới áp suất của khí quyển, độ tan tăng lên, khí CO2 trong dung dịch thoát ra.
D. Áp suất của khí CO2 trong chai lớn hơn áp suất của khí quyển, khi mở nút chai dưới áp suất của khí quyển, độ tan giảm đi, khí CO2 trong dung dịch thoát ra.
Lời giải
Khi mở các chai nước giải khát có ga thấy xuất hiện hiện tượng sủi bọt vì: Áp suất của khí CO2 trong chai lớn hơn áp suất của khí quyển, khi mở nút chai dưới áp suất của khí quyển, độ tan giảm đi, khí CO2 trong dung dịch thoát ra.
Đáp án: D
Bài 4: Tính nhiệt lượng tỏa ra khi đốt cháy 5 kg than có chứa 90% cacbon. Biết 1 mol cacbon cháy tỏa ra 394 kJ.
A. 133333 kJ.
B. 147750 kJ.
C. 144450 kJ.
D. 191340 kJ.
Lời giải
C + O2 CO2
CO2
Trong 5 kg than có chứa 0,9.5 = 4,5 kg cacbon = 4500 gam
Số mol C = 4500 / 12 = 375 mol
=> nhiệt lượng tỏa ra = 375.394 = 147750 kJ
Đáp án: B
Bài 5: Cho 1,6 gam hỗn hợp gồm CuO và Fe2O3 phản ứng với bột cacbon ở nhiệt độ cao thu được 0,28 lít khí CO2 (đktc). Thành phần % của hỗn hợp trên là
A. 50% CuO; 50% Fe2O3
B. 40% CuO; 60% Fe2O3
C. 30% Fe2O3; 70% CuO
D. 56% Fe2O3; 44% CuO
Lời giải
![]()
Gọi số mol của CuO và Fe2O3 lần lượt là x và y mol
=> 80x + 160y = 1,6 (1)
2CuO + C 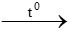 2Cu + CO2
2Cu + CO2
x → x → 0,5x
2Fe2O3 + 3C 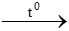 4Fe + 3CO2
4Fe + 3CO2
y → 2y → 1,5y
⇒∑nCO2 = 0,5x + 1,5y = 0,0125 (2)
Từ (1) và (2) ta có hệ:
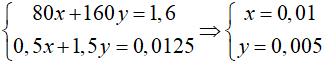
![]()
Đáp án: A
Bài 6: Trong luyện kim, người ta sử dụng cacbon và hoá chất nào để điều chế kim loại ?
A. Một số oxit kim loại như PbO, ZnO, CuO, ...
B. Một số bazơ như NaOH, Ca(OH)2, Cu(OH)2, ...
C. Một số axit như HNO3; H2SO4; H3PO4, ....
D. Một số muối như NaCl, CaCl2, CuCl2,...
Lời giải
Trong luyện kim, người ta sử dụng cacbon và oxit của kim loại để điều chế kim loại
Đáp án: A
Bài 7: Kim cương và than chì là 2 dạng thù hình của cacbon vì
A. đều có cấu tạo tinh thể như nhau.
B. đều do nguyên tố cacbon tạo nên.
C. đều có tính chất vật lí tương tự nhau.
D. cả A và B đều đúng.
Lời giải
Kim cương và than chì là 2 dạng thù hình của cacbon vì đều do nguyên tố cacbon tạo nên.
Đáp án: B
Bài 8: Cacbon gồm những dạng thù hình nào?
A. Kim cương, than chì, than gỗ.
B. Kim cương, than chì, cacbon vô định hình.
C. Kim cương, than gỗ, than cốc.
D. Kim cương, than xương, than cốc.
Lời giải
Cacbon gồm những dạng thù hình: Kim cương, than chì, cacbon vô định hình.
Đáp án: B
Bài 9: Để chứng minh sự có mặt của khí CO và CO2 trong hỗn hợp, người ta dẫn hỗn hợp khí qua (1) thấy xuất hiện kết tủa trắng, sau đó dẫn khí còn lại qua (2) thấy có chất rắn màu đỏ xuất hiện. Hoá chất đem sử dụng ở (1), (2) lần lượt là:
A. Nước vôi trong; đồng (II) oxit nung nóng.
B. Kali hiđroxit, nhôm oxit
C. Natri hiđroxit, đồng (II) oxit nung nóng.
D. Nước vôi trong; nhôm oxit
Lời giải
Dẫn hỗn hợp khí qua (1) thấy xuất hiện kết tủa trắng => (1) là dung dịch nước vôi trong Ca(OH)2
=> khí CO2 bị hấp thụ, còn lại khí CO thoát ra khỏi bình
PTHH: CO2 + Ca(OH)2 → CaCO3 + H2O
Dẫn CO qua (2) thấy chất rắn màu đỏ xuất hiện => chất rắn đó là Cu
=> (2) là CuO
PTHH: CO + CuO 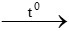 Cu + CO2
Cu + CO2
Đáp án: A
Bài 10: Dạng thù hình của một nguyên tố là
A. những đơn chất khác nhau do nguyên tố đó tạo nên.
B. những chất khác nhau do từ hai nguyên tố hoá học trở lên tạo nên.
C. những chất khác nhau được tạo nên từ cacbon.
D. những chất khác nhau được tạo nên từ nguyên tố phi kim với oxi.
Đáp án: A
Bài 11: Các dạng thù hình của cacbon là
A. than chì, cacbon vô định hình, khí cacbonic.
B. than chì, kim cương, canxi cacbonat.
C. cacbon, cacbon oxit; cacbon ddioxxit.
D. kim cương, than chì, cacbon vô định hình.
Đáp án: D
Bài 12: Do có tính hấp phụ, nên cacbon vô định hình được dùng làm
A. điện cực, chất khử.
B. trắng đường, mặt nạ phòng hơi độc.
C. ruột bút chì, chất bôi trơn.
D. mũi khoan, dao cắt kính.
Đáp án: B
Bài 13: Chất nào sau đây khi cháy tạo ra oxit ở thể khí ?
A. Kali.
B. Silic.
C. Cacbon.
D. Natri.
Đáp án: C
Bài 14: Dãy oxit phản ứng với cacbon ở nhiệt độ cao tạo thành đơn chất kim loại là
A. CuO, BaO, Fe2O3.
B. PbO, CuO, FeO.
C. Fe2O3, PbO, Al2O3.
D. K2O, ZnO, Fe3O4.
Đáp án: B
C khử được oxit của các kim loại đứng sau Al trong dãy hoạt động hóa học thành kim loại.
Bài 15: Để có thể nhận biết 3 lọ mất nhãn, mỗi lọ đựng một chất rắn màu đen là: bột than, bột đồng (II) oxit và bột mangan đioxit, ta dùng
A. dung dịch HCl đặc, nóng.
B. dung dịch NaCl.
C. dung dịch CuSO4.
D. nước nóng.
Đáp án: A
Sử dụng dung dịch HCl đặc, nóng.
+ chất rắn tan dần, có khí màu vàng lục, mùi xốc thoát ra → mangan đioxit (MnO2)
+ chất rắn tan dần, sau phản ứng thu được dung dịch màu xanh → đồng (II) oxit (CuO)
CuO + 2HCl → CuCl2 (xanh) + H2O
+ không có hiện tượng gì xuất hiện → cacbon.
Bài 16: Đốt cháy hoàn toàn 12 gam C thì thể tích tối đa của khí CO2 thu được ở đktc là
A. 1,12 lít.
B. 11,2 lít.
C. 2,24 lít.
D. 22,4 lít.
Đáp án: D
Số mol cacbon: nC = 12 : 12 = 1 mol
→ Thể tích CO2: V = 1.22,4 = 22,4 lít.
Bài 17: Khối lượng C cần dùng để khử hoàn toàn 8 gam CuO thành kim loại là
A. 3,6 gam.
B. 1,2 gam.
C. 2,4 gam.
D. 0,6 gam.
Đáp án: D
Số mol CuO: nCuO = 8 : 80 = 0,1 mol
→ mC pư = 0,05.12 = 0,6 gam.
Bài 18: Thể tích cacbon đioxit (đktc) thu được khi đốt cháy hoàn toàn 1 tấn than chứa 8% tạp chất là
A. 1717,3 m3
B. 1715,3 m3
C. 1710,3 m3
D. 1708 m3
Đáp án: A
%C có trong than là 100% - 8% = 92%
Khối lượng C có trong 1 tấn than là:
→ VCO2 = nCO2.22,4 = nC.22,4 = 76 666,67.22,4 = 1717333,408 lít
≈ 1717,33 m3.
Bài 19: Đốt cháy hoàn toàn 45g cacbon cần dùng V lít không khí (đktc). Biết Vkk = 5VO2 và sản phẩm tạo thành chỉ có cacbonđioxit.
A. 450 lít.
B. 425 lít.
C. 420 lít.
D. 400 lít.
Đáp án: C
Số mol cacbon: nC = 45 : 12 = 3,75 mol
Thể tích khí O2 cần dùng: VO2 = 3,75.22,4 = 84 lít
→ Thể tích không khí cần dùng: Vkk = 5.84 = 420 lít.
Trắc nghiệm bài 28: Các oxit của cacbon
Bài 1: “Nước đá khô“ không nóng chảy mà thăng hoa nên được dùng để tạo môi trường lạnh và khô rất tiện cho việc bảo quản thực phẩm. Nước đá khô là
A. CO rắn. B. SO2 rắn.
C. H2O rắn. D. CO2 rắn.
Lời giải
Nước đá khô là CO2 rắn
Đáp án: D
Bài 2: Hiệu ứng nhà kính là hiện tượng Trái đất đang ấm dần lên, do các bức xạ có bước sóng dài trong vùng hồng ngoại bị giữ lại, mà không bức xạ ra ngoài vũ trụ. Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính?
A. H2. B. N2.
C. CO2. D. O2.
Lời giải
Chất khí gây ra hiệu ứng nhà kính là CO2
Đáp án: C
Bài 3: Khí CO2 điều chế trong phòng TN thường lẫn khí HCl và hơi nước. Để loại bỏ HCl và hơi nước ra khỏi hỗn hợp, ta dùng
A. Dung dịch NaOH đặc.
B. Dung dịch Na2CO3 bão hoà và dung dịch H2SO4 đặc.
C. Dung dịch H2SO4 đặc.
D. Dung dịch NaHCO3 bão hoà và dung dịch H2SO4 đặc.
Lời giải
A loại vì NaOH phản ứng với CO2 và HCl
B loại vì Na2CO3 phản ứng với CO2 và HCl
C loại vì H2SO4 đặc chỉ tách được nước, không tách được CO2 và HCl.
D đúng vì NaHCO3 chỉ phản ứng với HCl sinh ra khí CO2 và dung dịch H2SO4 để hút nước.
NaHCO3 + HCl →NaCl + CO2 + H2O
Đáp án: D
Bài 4: Người ta có thể rót khí CO2 từ cốc này sang cốc khác là do tính chất nào sau đây?
A. CO2 là chất nặng hơn không khí
B. CO2 là chất khí không màu, không mùi.
C. CO2 không duy trì sự cháy và sự sống.
D. CO2 bị nén và làm lạnh hóa rắn.
Lời giải
Người ta có thể rót khí CO2 từ cốc này sang cốc khác là do tính chất : CO2 là chất nặng hơn không khí
Đáp án: A
Bài 5: Có thể dùng thuốc thử nào sau đây để phân biệt khí CO2 và khí CO?
A. dung dịch NaCl.
B. dung dịch CuSO4.
C. dung dịch HCl.
D. dung dịch Ca(OH)2 dư.
Lời giải
Để phân biệt khí CO2 và khí CO, ta dùng dung dịch Ca(OH)2 dư vì CO2 tạo kết tủa trắng còn CO không phản ứng
CO2 + Ca(OH)2 → CaCO3 + H2O
Đáp án: D
Bài 6: Trong bình chữa cháy chứa khí nào sau đây?
A. Cl2. B. CO2.
C. SO2. D. O2
Lời giải
Trong bình chữa cháy chứa khí CO2
Đáp án: B
Bài 7: Dẫn luồng khí CO qua hỗn hợp Al2O3, CuO, MgO, Fe2O3 (nung nóng). Sau khi phản ứng xảy ra hoàn toàn thu được chất rắn là
A. Al2O3, Cu, MgO, Fe.
B. Al, Fe, Cu, Mg.
C. Al2O3, Cu, Mg, Fe.
D. Al2O3, Fe2O3, Cu, MgO.
Lời giải
Khí CO chỉ khử được các oxit kim loại đứng sau Al => khử được CuO và Fe2O3
Đáp án: A
Bài 8: Trong các phản ứng hoá học sau, phản ứng nào sai?
A. 3CO + Fe2O3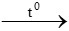 3CO2 + 2Fe
3CO2 + 2Fe
B. CO + Cl2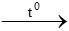 COCl2
COCl2
C. 3CO + Al2O3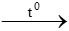 2Al + 3CO2
2Al + 3CO2
D. 2CO + O2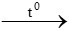 2CO2
2CO2
Lời giải
Phản ứng hóa học sai là 3CO + Al2O3 2Al + 3CO2 vì CO không khử được Al2O3
2Al + 3CO2 vì CO không khử được Al2O3
Đáp án: C
Bài 9: Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta sử dụng mặt nạ với chất hấp phụ là
A. đồng (II) oxit và mangan oxit.
B. đồng (II) oxit và magie oxit.
C. đồng (II) oxit và than hoạt tính.
D. than hoạt tính.
Lời giải
Để phòng nhiễm độc CO, là khí không màu, không mùi, rất độc người ta dùng chất hấp thụ là than hoạt tính.
Vì CuO và MnO có phản ứng với CO nhưng ở nhiệt độ cao
MgO không phản ứng với CO
Đáp án: D
Bài 10: Sự hình thành thạch nhũ trong các hang động đá vôi là nhờ phản ứng hoá học nào sau đây?
A. CaCO3 + CO2 +H2O → Ca(HCO3)2
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH
C. CaCO3 CaO + CO2
CaO + CO2
D. Ca(HCO3)2 → CaCO3 + CO2 + H2O
Lời giải
Sự hình thành thạch nhũ:
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Sư xâm thực đá vôi (quá trình hòa tan núi đá vôi):
CaCO3 + CO2 +H2O → Ca(HCO3)2
Đáp án: D
Bài 11: Nhóm gồm các chất khí đều khử được CuO ở nhiệt độ cao là
A. CO, H2.
B. Cl2, CO2.
C. CO, CO2.
D. H2, C.
Đáp án: A
Bài 12: Phản ứng nào sau đây là sai?
Đáp án: D
CO chỉ khử được oxit của những kim loại đứng sau nhôm trong dãy hoạt động hóa học.
Bài 13: Đốt cháy 11,2 lít CO (đktc). Thể tích không khí cần cho phản ứng trên là
A. 21,4 lít.
B. 24 lít.
C. 26 lít.
D. 28 lít.
Đáp án: D
Số mol CO: nCO = 11,2 : 22,4 = 0,5 mol
Thể tích oxi cần dùng: Voxi = 0,25.22,5 = 5,6 lít
→ Thể tích không khí cần dùng: Vkk = 5,6.5 = 28 lít.
Bài 14: Quá trình nào sau đây làm giảm CO2 trong khí quyển?
A. Sự hô hấp của động vật và con người.
B. Cây xanh quang hợp.
C. Đốt than và khí đốt.
D. Quá trình nung vôi.
Đáp án: B
Bài 15: Cho 1 mol Ba(OH)2 phản ứng với 1 mol CO2. Muối tạo thành là
A. BaCO3.
B. Ba(HCO3)2.
C. BaCO3 và Ba(HCO3)2.
D. BaCO3 và Ba(OH)2 dư.
Đáp án: A
Bài 16: Khử hoàn toàn 4,8 gam đồng (II) oxit bằng khí CO. Thể tích khí CO cần dùng (đktc) là
A. 1,344 lít.
B. 1,12 lít.
C. 6,72 lít.
D. 4,48 lít.
Đáp án: A
Số mol CuO là: nCuO = 4,8 : 80 = 0,06 mol
→ VCO pư = 0,06.22,4 = 1,344 lít.
Bài 17: Người ta dùng 22 gam CO2 hấp thụ 20 gam NaOH. Khối lượng muối tạo thành là
A. 45 gam.
B. 44 gam.
C. 43 gam.
D. 42 gam.
Đáp án: D
Ta có:
Bài 18: Khử hoàn toàn 3,2 gam Fe2O3 bằng khí CO dư. Sản phẩm khí thu được cho vào bình đựng nước vôi trong dư được a gam kết tủa màu trắng. Giá trị của a là
A. 5,0.
B. 6,0.
C. 4,0.
D. 3,0.
Đáp án: B
Số mol Fe2O3 là 3,2 : 160 = 0,02 mol
Phương trình hóa học:
Vậy a = 0,06.100 = 6 gam.
Bài 19: Khí CO dùng làm chất đốt trong công nghiệp có lẫn tạp chất là CO2 và SO2. Có thể làm sạch CO bằng
A. CuSO4 khan.
B. H2SO4 đặc.
C. dung dịch BaCl2.
D. dung dịch nước vôi trong.
Đáp án: D
Cho hỗn hợp khí qua lượng dư nước vôi trong; CO2 và SO2 phản ứng với nước vôi trong bị giữ lại; CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
CO2 + Ca(OH)2 (dư) → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 (dư) → CaSO3 ↓ + H2O
Bài 20: Để tạo muối KHCO3 duy nhất thì tỉ lệ CO2 sục vào dung dịch KOH là bao nhiêu ?
A. 1 : 3
B. 1 : 2
C. 1 : 1
D. 2 : 3
Đáp án: C
Trắc nghiệm bài 29: Axit cacbonic và muối cacbonat
Bài 1: Có các chất rắn màu trắng, đựng trong các lọ riêng biệt không nhãn : CaCO3, NaCl, NaOH. Nếu dùng quỳ tím và nước thì có thể nhận ra
A. 1 chất
B. 2 chất
C. 3 chất
D. không nhận được
Lời giải
- Cho nước vào các mẫu chất rắn, mẫu không tan trong nước là CaCO3, 2 mẫu tan trong nước là NaCl và NaOH
- Dùng quỳ tím để nhận biết 2 dung dịch của 2 mẫu tan, dung dịch không làm đổi màu quỳ là NaCl, dung dịch làm đổi màu quỳ là NaOH
Đáp án: C
Bài 2: Tính thể tích khí CO2 (đktc) tạo thành để dập tắt đám cháy nếu trong bình chữa cháy có dung dịch chứa 980 gam H2SO4 tác dụng hết với dung dịch NaHCO3.
A. 22,4 lít.
B. 224 lít.
C. 44,8 lít.
D. 448 lít.
Lời giải
H2SO4 + 2NaHCO3 → Na2SO4 + 2CO2 + 2H2O
98 gam → 2.22,4 lít
980 gam → 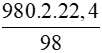 = 448 lít
= 448 lít
Vậy thể tích CO2 tạo thành là 448 lít
Đáp án: D
Bài 3: Hãy xác định công thức hóa học của muối natri cacbonat ngậm nước biết rằng khi nung 3,1 gam tinh thể này đến khối lượng không đổi được chất rắn có khối lượng là 2,65 gam
A. Na2CO3.H2O
B. Na2CO3.2H2O
C. 2Na2CO3.H2O
D. Na2CO3.3H2O
Lời giải
Đặt CTPT của muối cacbonat ngậm nước là: x.Na2CO3.yH2O
Khi nung thu được muối khan:
x.Na2CO3.yH2O  xNa2CO3 + yH2O
xNa2CO3 + yH2O
Chất rắn có khối lượng 2,65 gam là Na2CO3
=> 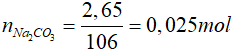
Bảo toàn khối lượng: mtinh thể = mH2O + m Na2CO3
mH2O = 3,1 - 2,65 = 0,45 gam => nH2O = 0,025 mol
Tỉ lệ x : y = 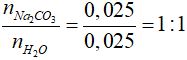
Vậy CTPT của muối cacbonat ngậm nước là Na2CO3.H2O
Đáp án: A
Bài 4: Sự tạo thành thạch nhũ trong các hang động của mỏ đá vôi là do có phản ứng:
A. CaCO3 + CO2 + H2O → Ca(HCO3)2.
B. Ca(OH)2 + Na2CO3 → CaCO3 + 2NaOH.
C. CaCO3 → CaO + H2O.
D. Ca(HCO3)2 → CaCO3 + CO2 + H2O.
Lời giải
Thạch nhũ là CaCO3
Sự tạo thành thạch nhũ trong các hang động của mỏ đá vôi là do có phản ứng :
Ca(HCO3)2 → CaCO3 + CO2 + H2O
Đáp án: D
Bài 5: Hãy cho biết trong các cặp chất sau đây, cặp nào không thể tác dụng với nhau?
A. H2SO4 và KHCO3
B. K2CO3 và NaCl
C. MgCO3 và HCl
D. CaCl2 và Na2CO3
Lời giải
Những cặp chất tác dụng với nhau:
A. H2SO4+ 2KHCO3 → K2SO4 + 2CO2 ↑ + 2H2O
C. MgCO3+ 2HCl → MgCl2 + CO2 ↑ + H2O
D. CaCl2+ Na2CO3 → CaCO3 ↓ + 2NaCl
Cặp chất không tác dụng với nhau là B. K2CO3 và NaCl
Đáp án: B
Bài 6: Quá trình thổi khí CO2 vào dung dịch NaOH, muối tạo ra theo thứ tự là :
A. NaHCO3, Na2CO3
B. Na2CO3, NaHCO3
C. Na2CO3
D. Không đủ dữ liệu xác định
Lời giải
Ban đầu tạo muối NaCO3
CO2 + 2NaOH → Na2CO3 + H2O
Sau đó, CO2 dư tiếp tục xảy ra phản ứng:
CO2 + Na2CO3 + H2O → 2NaHCO3
Đáp án: B
Bài 7: Có 4 chất rắn: NaCl, Na2CO3, CaCO3, BaSO4 chỉ dùng thêm một cặp chất nào dưới đây để nhận biết ?
A. H2O và CO2
B. H2O và NaOH
C. H2O và HCl
D. H2O và BaCl2
Lời giải
- Cho nước cất vào cả 4 mẫu chất rắn trên, mẫu không tan trong nước là CaCO3 và BaSO4 (nhóm I), 2 mẫu tan trong nước là NaCl và Na2CO3 (nhóm II)
- Cho dung dịch HCl vào các mẫu ở cả 2 nhóm.
+ Nhóm I: mẫu xuất hiện khí thoát ra là CaCO3, mẫu không hiện tượng là BaSO4
PTHH: CaCO3 + 2HCl → CaCl2 + CO2 + H2O
+ Nhóm II: mẫu xuất hiện khí thoát ra là Na2CO3, mẫu không hiện tượng là NaCl
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
Đáp án: C
Bài 8: Cho luồng khí H2 dư qua hỗn hợp các oxit CuO, Fe2O3, ZnO, MgO nung nóng ở nhiệt độ cao. Sau phản ứng, hỗn hợp chất rắn còn lại là
A. Cu, Fe, ZnO, MgO.
B. Cu, Fe, Zn, Mg.
C. Cu, Fe, Zn, MgO.
D. Cu, FeO, ZnO, MgO.
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ
⇒ chỉ khử được CuO, Fe2O3, ZnO tạo thành Cu, Fe, Zn
⇒ hỗn hợp chất rắn thu được là Cu, Fe, Zn, MgO.
Đáp án: C
Bài 9: Cho khí CO (dư) đi vào ống sứ nung nóng đựng hỗn hợp X gồm Al2O3, MgO, Fe3O4, CuO thu được chất rắn Y. Cho Y vào dung dịch NaOH (dư), khuấy kĩ, thấy còn lại phần không tan Z. Giả sử các phản ứng xảy ra hoàn toàn. Phần không tan Z gồm:
A. MgO, Fe3O4, Cu.
B. MgO, Fe, Cu.
C. Mg, Fe, Cu.
D. Mg, Al, Fe, Cu.
Các chất khử C, CO, H2 không khử được các oxit MgO, Al2O3 và các oxit khác của kim loại kiềm và kiềm thổ.
⇒ trong hỗn hợp X, CO khử được Fe3O4 và CuO tạo ra Fe và Cu
⇒ chất rắn Y gồm: Al2O3, MgO, Fe, Cu
Cho Y vào dung dịch NaOH dư, chỉ có Al2O3 tan ⇒ chất rắn Z sau phản ứng gồm MgO, Fe, Cu
Đáp án: B
Bài 10: Khử hoàn toàn 32 gam CuO bằng khí CO dư, thu được m gam kim loại. Giá trị của m là
A. 12,8
B. 25,6
C. 32,0
D.
Đáp án: B
Bài 11: Cho khí CO dư đi qua ống chứa 0,2 mol MgO và 0,2 mol CuO nung nóng đến phản ứng hoàn toàn, thu được x gam chất rắn. Giá trị của x là
A. 17,6
B. 4,8
C. 20,8
D. 24,0
Đáp án: C
Bài 12: Cho luồng khí CO (dư) đi qua 9,1 gam hỗn hợp gồm CuO và Al2O3 nung nóng đến khi phản ứng hoàn toàn, thu được 8,3 gam chất rắn. Khối lượng CuO có trong hỗn hợp ban đầu là
A. 0,8 gam.
B. 8,3 gam.
C. 2,0 gam.
D. 4,0 gam.
Gọi số mol của CuO và Al2O3 lần lượt là a và b mol
⇒ mhỗn hợp đầu = 80a + 102b = 9,1 (1)
Khí CO chỉ phản ứng với CuO
Hỗn hợp chất rắn sau phản ứng gồm Cu (a mol) và Al2O3 (b mol)
⇒ mhỗn hợp sau = 64a + 102b = 8,3 (2)
Lấy (1) trừ (2) ta có: 16a = 0,8 ⇒ a = 0,05 mol
⇒ mCuO = 0,05.80 = 4 gam
Đáp án: D
Bài 13: Cho V lít khí CO (ở đktc) phản ứng với một lượng dư hỗn hợp rắn gồm CuO và Fe2O3 nung nóng. Sau khi các phản ứng xảy ra hoàn toàn, khối lượng hỗn hợp rắn giảm 0,32 gam. Giá trị của V là
A. 0,224
B. 0,560
C. 0,112
D. 0,448
Giả sử khối lượng hỗn hợp rắn ban đầu là m gam ⇒ khối lượng rắn sau phản ứng là (m – 0,32) gam
Đáp án: D
Bài 14: Dẫn từ từ V lít khí CO (ở đktc) đi qua một ống sứ đựng lượng dư hỗn hợp rắn gồm CuO, Fe2O3 (ở nhiệt độ cao). Sau khi các phản ứng xảy ra hoàn toàn, thu được khí X. Dẫn toàn bộ khí X ở trên vào lượng dư dung dịch Ca(OH)2 thì tạo thành 4 gam kết tủa. Giá trị của V là
A. 0,896
B. 1,120
C. 0,224
D. 0,448
Đáp án: A
Bài 15: Hoà tan hoàn toàn 20 gam một oxit kim loại bằng dung dịch H2SO4 loãng thu được 50 gam muối. Khử hoàn toàn lượng oxit đó thành kim loại ở nhiệt độ cao cần V lít khí CO (đktc). Giá trị của V là
A. 2,80
B. 5,60
C. 6,72
D. 8,40
| n | 1 | 2 | 3 | 4 |
| R | 18,67 (loại) | 37,33 (loại) | 56 (Fe) | 74,67 (loại) |
Đáp án: D
Bài 16: Cho H2 dư qua 8,14 gam hỗn hợp A gồm CuO, Al2O3 và FexOy nung nóng. Sau khi phản ứng xong, thu được 1,44 gam H2O và a gam chất rắn. Giá trị của a là :
A. 6,70
B. 6,86
C. 6,78
D. 6,80
Đáp án: A
Bài 17: Khử 3,48 gam một oxit của kim loại M cần dùng 1,344 lít H2 (đktc). Toàn bộ lượng kim loại M sinh ra cho tác dụng với dung dịch HCl dư thu được 1,008 lít H2 (đktc). Công thức oxit là
A. Fe3O4.
B. Fe2O3.
C. FeO.
D. ZnO.
| n | 1 | 2 | 3 | 4 |
| M | 21 (loại) | 42 (loại) | 63 (loại) | 84 (loại) |
Đáp án: A
Bài 18: Cho khí CO qua ống chứa 15,2 gam hỗn hợp A gồm CuO và FeO nung nóng. Sau một thời gian thu được hỗn hợp khí B và 13,6 gam chất rắn
C. Cho B tác dụng với dung dịch Ca(OH)2 dư thu được m gam kết tủa. Giá trị của m là :
A. 15
B. 10
C. 20
D. 25
Đáp án: B
Bài 19: Dẫn một luồng khí CO dư qua ống sứ đựng m gam hỗn hợp Fe3O4 và CuO nung nóng đến khi phản ứng hoàn toàn thu được 2,32 gam hỗn hợp kim loại. Khí thoát ra khỏi bình được dẫn qua dung dịch nước vôi trong dư thu được 5 gam kết tủa. Giá trị của m là :
A. 6,24
B. 5,32
C. 3,12
D. 4,56
Đáp án: C
Trắc nghiệm bài 30: Silic. Công nghiệp silicat
Bài 1: Một loại thủy tinh thường chứa 13% natri oxit, 11,7% canxi oxit và 75,3 silic đioxit về khối lượng. Thành phần của thủy tinh này biểu diễn dưới dạng hợp chất của các oxit nào?
A. Na2O.2CaO.3SiO2.
B. 2Na2O.CaO.SiO2
C. Na2O.CaO.6SiO2
D. 2Na2O.2CaO.SiO2
Lời giải
Đặt công thức thủy tinh: xNa2O.yCaO.zSiO2
Ta có tỉ lệ:
x : y : z = 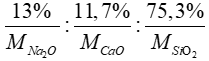 = 0,209 : 0,208 : 1,255 = 1 : 1 : 6
= 0,209 : 0,208 : 1,255 = 1 : 1 : 6
=> Công thức thủy tinh: Na2O.CaO.6SiO2
Đáp án: C
Bài 2: Để sản xuất 100 kg thủy tinh Na2O.CaO.6SiO2 cần dùng bao nhiêu kg natri cacbonat với hiệu suất của quá trình sản xuất là 100%?
A. 22,17 kg.
B. 27,12 kg.
C. 25,15 kg.
D. 20,92 kg.
Lời giải
6SiO2 + CaCO3 + Na2CO3 → Na2O.CaO.6SiO2 + 2CO2
106 478
x 100 kg
![]()
Đáp án: A
Bài 3: Tính khối lượng Na2CO3 cần dùng để sản xuất được 120 kg thủy tinh Na2O.CaO.6SiO2 với hiệu suất 90%?
A. 26,61 kg.
B. 29,57 kg.
C. 20,56 kg.
D. 24,45 kg.
Lời giải
6SiO2 + CaCO3 + Na2CO3 → Na2O.CaO.6SiO2 + 2CO2
106 gam → 478 gam
mNa2CO3 120 kg
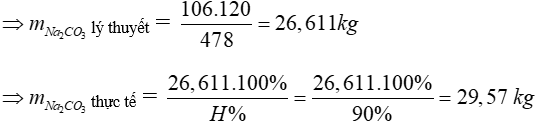
Đáp án: B
Bài 4: Nguyên tố phổ biến thứ hai ở vỏ trái đất là
A. oxi
B. cacbon
C. silic
D. sắt
Lời giải
Nguyên tố phổ biến thứ hai ở vỏ trái đất là silic
Đáp án: C
Bài 5: Oxit axit nào sau đây không tác dụng với nước?
A. Cacon đioxit
B. Lưu huỳnh đioxit
C. Silic đioxit
D. Đinitơ pentaoxit
Lời giải
Vì SiO2 là chất rắn không tan trong nước.
Đáp án: C
Bài 6: Silic đioxit (SiO2) tan chậm trong dung dịch kiềm đặc, nóng, tan dễ trong dung dịch kiềm nóng chảy tạo thành silicat. SiO2 là
A. oxit axit
B. oxit trung tính
C. oxit bazơ
D. oxit lưỡng tính
Lời giải
Tan được trong dung dịch kiềm => SiO2 là oxit axit
Đáp án: A
Bài 7: Cặp chất nào sau đây không xảy ra phản ứng
A. NaOH và CO2
B. CO2 và C
C. SiO2 và NaOH
D. KOH và K2SiO3
Lời giải
Cặp chất không xảy ra phản ứng là KOH và K2SiO3
Đáp án: D
Bài 8: Nhận xét nào sau đây không đúng về Silic?
A. Silic là nguyên tố phổ biến thứ hai trong thiên nhiên, chỉ sau oxi.
B. Silic chiếm ¼ khối lượng vỏ Trái Đất.
C. Trong tự nhiên Silic tồn tại cả ở dạng đơn chất và hợp chất.
D. Một số hợp chất của silic: cát trắng, đất sét (cao lanh).
Đáp án: D
Trong tự nhiên Silic không tồn tại ở dạng đơn chất mà chỉ tồn tại ở dạng hợp chất.
Bài 9: Khi cho nước tác dụng với oxit axit nào sau đây sẽ không thu được axit?
A. CO2.
B. SO2.
C. SiO2.
D. N2O5.
Đáp án: C.
SiO2 không phản ứng với nước.
Bài 10: Nhận định nào sau đây về tính chất của silic là sai ?
A. Silic là phi kim hoạt động hóa học yếu hơn cacbon, clo.
B. Ở nhiệt độ cao, silic phản ứng với oxi tạo thành silic đioxit
C. Silic là chất rắn, màu xám.
D. Silic dẫn điện tốt nên được dùng làm pin mặt trời.
Đáp án: D
Silic dẫn điện kém. Tinh thể silic tinh khiết là chất bán dẫn nên silic được dùng làm vật liệu bán dẫn trong kỹ thuật điện tử và chế tạo pin mặt trời.
Bài 11: SiO2 là nguyên liệu quan trọng để sản xuất
A. thủy tinh, đồ gốm.
B. thạch cao.
C. phân bón hóa học.
D. chất dẻo.
Đáp án: A.
SiO2 là nguyên liệu quan trọng để sản xuất thủy tinh, đồ gốm…
Bài 12: Đun nóng m gam Silic trong oxi dư thu được 5,34 gam silic đioxit. Giá trị của m
A. 1,869 gam.
B. 2,492 gam.
C. 3,738 gam.
D. 1,246 gam.
Đáp án: B
Bài 13: Công nghiệp silicat gồm
A. sản xuất đồ gốm, thủy tinh.
B. sản xuất xi măng.
C. sản xuất silic.
D. sản xuất đồ gồm, thủy tinh, xi măng.
Đáp án: D
Bài 14: Một loại thủy tinh chịu lực có thành phần theo khối lượng của các oxit như sau: 13% Na2O; 11,7% CaO và 75,3% SiO2. Công thức biểu diễn thành phần của loại thủy tinh này là
A. Na2O.CaO.6SiO2.
B. Na2O.CaO.3SiO2.
C. Na2O.2CaO.6SiO2.
D. Na2O.2CaO.3SiO2
Đáp án: A
Vậy công thức của loại thủy tinh này: Na2O.CaO. 6SiO2
Bài 15: Để có thể khắc chữ và hình trên thuỷ tinh người ta dùng dung dịch nào dưới đây?
A. dung dịch HCl.
B. dung dịch HBr.
C. dung dịch HI.
D. dung dịch HF.
Đáp án: D
SiO2 tan được trong HF, dựa vào tính chất này người ta dùng dung dịch HF để khắc chữ và hình lên thủy tinh.
Bài 16: Phản ứng hóa học nào sau đây là sai?
Đáp án: D
SiO2 không phản ứng với nước.
Bài 17: Để hòa tan hoàn toàn 2,4 gam SiO2 cần dùng vừa hết m gam dd HF 25%, sau phản ứng thu được dd X. Giá trị của m là.
A. 12,8.
B. 6,4.
C. 3,2.
D. 2,56.
Đáp án: A
Trắc nghiệm bài 31: Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Bài 1: Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo nguyên tắc :
A. Chiều nguyên tử khối tăng dần.
B. Chiều điện tích hạt nhân tăng dần.
C. Tính kim loại tăng dần.
D. Tính phi kim tăng dần.
Lời giải
Bảng tuần hoàn các nguyên tố hóa học được sắp xếp theo chiều điện tích hạt nhân tăng dần.
Đáp án: B
Bài 2: Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết
A. Số thứ tự của nguyên tố.
B. Số electron lớp ngoài cùng.
C. Số hiệu nguyên tử
D. Số lớp electron.
Lời giải
Số thứ tự chu kì trong bảng hệ thống tuần hoàn cho biết số lớp electron.
Đáp án: D
Bài 3: Số thứ tự nhóm trong bảng hệ thống tuần hoàn cho biết:
A. Số electron lớp ngoài cùng.
B. Số thứ tự của nguyên tố.
C. Số hiệu nguyên tử.
D. Số lớp electron.
Lời giải
Số thứ tự nhóm trong bảng hệ thống tuần hoàn cho biết: Số electron lớp ngoài cùng
Đáp án: A
Bài 4: Dãy nào sau đây thể hiện mức độ hoạt động hóa học của kim loại tăng dần:
A. Be, Fe, Ca, Cu.
B. Ca, K, Mg, Al.
C. Al, Zn, Co, Ca.
D. Ni, Mg, Li, Cs.
Lời giải
Dãy thể hiện mức độ hoạt động hóa học của kim loại tăng dần là: Ni, Mg, Li, Cs.
Loại A vì Ca có tính kim loại mạnh hơn Cu.
Loại B vì Mg có tính kim loại mạnh hơn Al
Loại C vì Al có tính kim loại mạnh hơn Zn
Đáp án: D
Bài 5: Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần:
A. Mg, Na, Si, P.
B. Ca, P, B, C.
C. C, N, O, F.
D. O, N, C, B.
Lời giải
Dãy các nguyên tố sắp xếp theo chiều tính phi kim tăng dần: C, N, O, F vì 4 nguyên tố này cùng thuộc 1 chu kì và cùng sắp xếp theo chiều tăng điện tích hạt nhân.
Đáp án: C
Bài 6: Phát biểu nào sau đây là không đúng:
A. Bảng tuần hoàn gồm có các ô nguyên tố, các chu kì và các nhóm
B. Chu kì là dãy các nguyên tố mà nguyên tử của chúng có cùng số lớp electron, sắp xếp theo Z tăng dần
C. Bảng tuần hoàn có 7 chu kì, số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử
D. Bảng tuần hoàn có 8 nhóm A, 8 nhóm B, 18 cột trong đó nhóm A có 8 cột và nhóm B có 10 cột
Lời giải
Phát biểu không đúng là: Bảng tuần hoàn có 7 chu kì, số thứ tự của chu kì bằng số phân lớp electron trong nguyên tử.
Số thứ tự của chu kì bằng số lớp electron trong nguyên tử
Đáp án: C
Bài 7: Dãy công thức hoá học của oxit tương ứng với các nguyên tố hoá học thuộc chu kì 3 là:
A. Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
B. Na2O, MgO, K2O, SiO2, P2O5, SO3, Cl2O7
C. Na2O, MgO, K2O, SO2, P2O5, SO3, Cl2O7
D. K2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
Lời giải
Dãy công thức hoá học của oxit tương ứng với các nguyên tố hoá học thuộc chu kì 3 là: Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7
Đáp án: A
Bài 8: Nguyên tố X có cấu tạo như sau: điện tích hạt nhân là 11+, 3 lớp electron, lớp ngoài cùng có 1 electron. Tính chất hóa học cơ bản của X là
A. Tính kim loại mạnh.
B. Tính phi kim mạnh.
C. X là khí hiếm.
D. Tính kim loại yếu.
Lời giải
Từ vị trí này ta biết:
+ Nguyên tố X có số hiệu nguyên tử là 11, đó là Na.
+ Nguyên tố X ở chu kì 3, do đó có 3 lớp electron.
+ Nguyên tố X ở nhóm I có 1e lớp vỏ ngoài cùng, nguyên tố A ở đầu chu kì nên có tính kim loại mạnh.
Đáp án: A
Bài 9: Nguyên tố B có điện tích hạt nhân bằng 19+, có 4 lớp electron, có 1e ở lớp ngoài cùng. Hãy cho biết vị trí của nguyên tố B?
A. B thuộc ô 18, chu kì 4, nhóm IB.
B. B thuộc ô 19, chu kì 3, nhóm II.
C. B thuộc ô 19, chu kì 4, nhóm I.
D. B thuộc ô 18, chu kì 3, nhóm I.
Lời giải
Ta có:
+ Nguyên tố B có điện tích hạt nhân là 19+ nên B thuộc ô thứ 19
+ Nguyên tố B có 4 lớp e nên B thuộc chu kì 4.
+ Nguyên tố B có 1 e lớp ngoài cùng nên B thuộc nhóm I
Đáp án: C
Bài 10: Biết nguyên tố X có số hiệu là 17, chu kì 3, nhóm VII. Hãy cho biết cấu tạo nguyên tử và tính chất của nguyên tố X?
A. X có 3 lớp e, lớp ngoài cùng có 7e, X là phi kim mạnh.
B. X có 4 lớp e, lớp ngoài cùng có 17e, X là phi kim mạnh.
C. X có 3 lớp e, lớp ngoài cùng có 7e, X là kim loại mạnh.
D. X có 4 lớp e, lớp ngoài cùng có 17e, X là kim loại mạnh.
Lời giải
- Nguyên tố X có số hiệu nguyên tử là 17 => đó là Cl
- Nguyên tố X có số hiệu nguyên tử là 17 => điện tích hạt nhân là 17+, có 17 proton, 17 electron
- Nguyên tố X ở chu kì 3 => có 3 lớp electron
- Nguyên tố X thuộc nhóm VII => lớp e ngoài cùng có 7e
Vì X ở cuối chu kì 3 nên X là phi kim mạnh
Đáp án: A
Bài 11: Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử:
A. 3 B. 5
C. 6 D. 7
Lời giải
Các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là 6
Đáp án: C
Bài 12: Trong bảng tuần hoàn các nguyên tố, số chu kì nhỏ và số chu kì lớn:
A. 3 và 3
B. 4 và 3
C. 4 và 4
D. 3 và 4
Lời giải
Trong bảng tuần hoàn các nguyên tố gồm 7 chu kì. Trong đó 3 chu kì nhỏ (chu kì 1, 2, 3) và 4 chu kì lớn (chu kì 4, 5, 6, 7).
Đáp án: D
Bài 13: Số nguyên tố trong chu kì 3 và 5 lần lượt là:
A. 8 và 18
B. 18 và 8
C. 8 và 8
D. 18 và 32
Lời giải
Chu kì 3 là chu kì nhỏ => có 8 nguyên tố
Chu kì 5 là chu kì lớn => có 18 nguyên tố
Đáp án: A
Bài 14: A là khí không màu mùi hắc, rất độc và nặng hơn không khí
Hãy xác định công thức của hợp chất khí A, biết rằng
+ A là oxit của lưu huỳnh chưa 50% oxi
+ 1 gam khí A chiến thể tích 0,35 lit ở đktc
A. SO
B. SO3
C. SO2
D. NO2
Lời giải
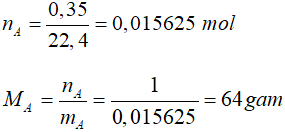
– Tìm số nguyên tử S, O trong phân tử A
![]()
mS = 64 – 32 = 32g => ns = 32/32 = 1 mol
Suy ra trong 1 phân tử A có 1S và 2O, công thức của A là SO2
Đáp án: C
Bài 15: Nhóm các nguyên tố được sắp xếp theo chiều tính phi kim tăng dần là
A. O, F, N, C.
B. F, O, N, C.
C. O, N, C, F.
D. C, N, O, F.
Đáp án: D
Các nguyên tố C, N, O, F cùng thuộc chu kỳ 2;
Trong một chu kỳ, theo chiều tăng của điện tích hạt nhân tính phi kim của các nguyên tố tăng dần
→ Tính phi kim: C < N < O < F.
Bài 16: Trong 1 chu kỳ (trừ chu kì 1), đi từ trái sang phải tính chất của các nguyên tố biến đổi như sau
A. tính kim loại và tính phi kim đều giảm dần.
B. tính kim loại và tính phi kim đều tăng dần.
C. tính kim loại giảm dần đồng thời tính phi kim tăng dần.
D. tính kim loại tăng dần đồng thời tính phi kim giảm dần.
Đáp án: C
Bài 17: Dãy các kim loại nào sau đây được sắp xếp theo chiều tính kim loại tăng dần ?
A. K, Na, Li, Rb.
B. Li, K, Rb, Na.
C. Na, Li, Rb, K.
D. Li, Na, K, Rb.
Đáp án: D
Các kim loại Li, Na, K, Rb thuộc cùng nhóm IA trong bảng tuần hoàn.
Trong cùng một nhóm, theo chiều tăng của điện tích hạt nhân tính kim loại của các nguyên tố tăng dần
→ Tính kim loại: Li < Na < K < Rb.
Bài 18: Cho các nguyên tố sau O, P, N. Hãy chỉ ra thứ tự sắp xếp đúng theo chiều tính phi kim tăng dần
A. O, P, N.
B. N, P, O.
C. P, N, O.
D. O, N, P.
Đáp án: C
Ta có: P và N cùng thuộc nhóm VA, theo quy luật biến đổi xác định được tính phi kim của P < N.
O và N cùng thuộc chu kỳ 2, theo quy luật biến đổi xác định được tính phi kim của N < O.
Chiều tăng dần tính phi kim là: P < N < O.
Bài 19: Biết X có cấu tạo nguyên tử như sau: điện tích hạt nhân là 12+, có 3 lớp electron, lớp ngoài cùng có 2 electron. Vị trí của X trong bảng tuần hoàn là
A. chu kỳ 3, nhóm II.
B. chu kỳ 3, nhóm III.
C. chu kỳ 2, nhóm II.
D. chu kỳ 2, nhóm III.
Đáp án: A
X có 3 lớp electron → X thuộc chu kỳ 3
Lớp ngoài cùng của X có 2 electron → X thuộc nhóm II.
Bài 20: Nguyên tử của nguyên tố X có 3 lớp electron, lớp electron ngoài cùng có 7 electron. Vị trí và tính chất cơ bản của nguyên tố X là
A. thuộc chu kỳ 3, nhóm VII là kim loại mạnh.
B. thuộc chu kỳ 7, nhóm III là kim loại yếu.
C. thuộc chu kỳ 3, nhóm VII là phi kim mạnh.
D. thuộc chu kỳ 3, nhóm VII là phi kim yếu.
Đáp án: C
X có 3 lớp electron → X thuộc chu kỳ 3
Lớp ngoài cùng của X có 7 electron → X thuộc nhóm VII.
X ở phía cuối chu kỳ nên là phi kim mạnh.
Bài 21: Trong chu kỳ 3, X là nguyên tố đứng đầu chu kỳ, còn Y là nguyên tố đứng cuối chu kỳ nhưng trước khí hiếm. Nguyên tố X và Y có tính chất sau
A. X là kim loại mạnh, Y là phi kim yếu.
B. X là kim loại mạnh, Y là phi kim mạnh.
C. X là kim loại yếu, Y là phi kim mạnh.
D. X là kim loại yếu, Y là phi kim yếu.
Đáp án: B
Bài 22: Nguyên tố M có số hiệu nguyên tử là 19, chu kỳ 4, nhóm I trong bảng tuần hoàn các nguyên tố hóa học. Phát biểu nào sau đây đúng ?
A. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 1 electron, kim loại mạnh.
B. Điện tích hạt nhân 19+, 1 lớp electron, lớp ngoài cùng có 4 electron, kim loại mạnh.
C. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 4 electron, kim loại yếu.
D. Điện tích hạt nhân 19+, 4 lớp electron, lớp ngoài cùng có 1 electron, kim loại yếu.
Đáp án: A
M có số hiệu nguyên tử là 19 nên điện tích hạt nhân nguyên tử M là 19+.
M thuộc chu kỳ 4 nên có 4 lớp electron trong nguyên tử; M thuộc nhóm I nên lớp ngoài cùng có 1 electron.
M đứng ở đầu chu kỳ nên là kim loại mạnh.
Bài 23: Nguyên tố X ở chu kỳ 4 nhóm VI, nguyên tố Y ở chu kỳ 2 nhóm VII. So sánh tính chất của X và Y thấy
A. tính phi kim của X mạnh hơn Y.
B. tính phi kim của Y mạnh hơn X.
C. X, Y có tính phi kim tương đương nhau.
D. X, Y có tính kim loại tương đương nhau.
Đáp án: B
Theo quy luật biến đổi tính chất các nguyên tố trong bảng tuần hoàn xác định được Y là phi kim mạnh nhất. Do đó, tính phi kim của Y mạnh hơn X.
Bài 24: Nguyên tố X có hiệu số nguyên tử là 10. Điều khẳng định nào sau đây không đúng ?
A. Điện tích hạt nhân của nguyên tử là 10+, nguyên tử có 10 electron.
B. Nguyên tử X cuối chu kỳ 2.
C. X là một khí hiếm.
D. X là 1 kim loại hoạt động yếu.
Đáp án: D
Trắc nghiệm bài 32: Luyện tập chương 3: Phi kim - Sơ lược về bảng tuần hoàn các nguyên tố hóa học
Câu 1: Nguyên tố X có hiệu số nguyên tử là 9. Điều khẳng định nào sau đây không đúng ?
A. Điện tích hạt nhân của nguyên tử là 9+, nguyên tử có 9 electron.
B. Nguyên tử X ở gần cuối chu kỳ 2, đầu nhóm VII.
C. X là 1 phi kim hoạt động mạnh.
D. X là 1 kim loại hoạt động yếu.
Đáp án: D
Câu 2: Cặp chất tác dụng được với dung dịch KOH là
A. CO, SO2
B. SO2, SO3
C. FeO, Fe2O3
D. NO, NO2
Đáp án: B
SO2 và SO3 là các oxit axit nên tác dụng được với dung dịch KOH
Phương trình hóa học:
SO2 + 2KOH → K2SO3 + H2O
SO3 + 2KOH → K2SO4 + H2O
Câu 3: Chất khí nào sau đây có thể gây chết người vì ngăn cản sự vận chuyển oxi trong máu ?
A. CO
B. CO2
C. SO2
D. NO
Đáp án: A
Câu 4: Khi dẫn khí clo vào cốc đựng nước, sau đó cho vào cốc 1 mẩu quỳ tím. Hiện tượng xảy ra là
A. quỳ tím hóa đỏ.
B. quỳ tím hóa xanh.
C. quỳ tím không chuyển màu.
D. quỳ tím hóa đỏ sau đó mất màu ngay.
Đáp án: D
Câu 5: Phản ứng giữa Cl2 và dung dịch NaOH ở điều kiện thường dùng để điều chế
A. thuốc tím.
B. nước gia - ven.
C. clorua vôi.
D. kali clorat.
Đáp án: B
Câu 6: Trong thực tế, người ta có thể dùng cacbon để khử oxit kim loại nào trong số các oxit kim loại dưới đây để sản xuất kim loại ?
A. Al2O3
B. K2O
C. CaO
D. Fe3O4
Đáp án: D
Cacbon khử được oxit của những kim loại đứng sau nhôm trong dãy hoạt động hóa học
Câu 7: Trong các chất sau chất nào có thể tham gia phản ứng với clo ?
A. Oxi.
B. Dung dịch KOH.
C. CuO.
D. NaCl.
Đáp án: B
Cl2 + 2KOH → KCl + KClO + H2O
Câu 8: Khí CO lẫn tạp chất là CO2 và SO2 có thể làm sạch CO bằng cách dẫn mẫu khí trên qua
A. dung dịch H2SO4 đặc.
B. dung dịch Ca(OH)2.
C. dung dịch CaSO4.
D. dung dịch CaCl2.
Đáp án: B
Dẫn hỗn hợp khí qua dung dịch Ca(OH)2 dư. Khí SO2 và CO2 phản ứng bị giữ lại, khí CO không phản ứng thoát ra khỏi dung dịch thu được CO tinh khiết.
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
Câu 9: Đốt cháy hoàn toàn 3 gam C thành CO2. Cho toàn bộ sản phẩm hấp thụ vào dung dịch nước vôi trong dư. Khối lượng kết tủa tạo thành là
A. 50 gam.
B. 25 gam.
C. 15 gam.
D. 40 gam.
Đáp án: B
Ta có: nC = 3 : 12 = 0,25 mol
Khối lượng kết tủa: m = 0,25.100 = 25 gam.
Câu 10: Cho 69,6 gam MnO2 tác dụng với dung dịch HCl đặc, nóng, dư. Thể tích khí ở điều kiện tiêu chuẩn thu được là
A. 4,48 lít.
B. 6,72 lít.
C. 17,92 lít.
D. 13,44 lít.
Đáp án: C
Câu 11: Thể tích của dung dịch KOH 1M ở điều kiện thường cần dùng để tác dụng hoàn toàn với 1,12 lít khí Cl2 (đktc) là
A. 0,2 lít.
B. 0,3 lít.
C. 0,4 lít.
D. 0,1 lít.
Đáp án: D
Câu 12: Một nguyên tố X ở ô thứ 12 trong bảng tuần hoàn. Điện tích hạt nhân nguyên tử X là
A. 12-.
B. 12+.
C. -12.
D. +12.
Đáp án: B
Câu 13: Số thứ tự ô nguyên tố trong bảng hệ thống tuần hoàn bằng:
A. số hiệu nguyên tử
B. nguyên tử khối
C. số nơtron
D. số lớp electron.
Đáp án: A.
Câu 14: Trong bảng hệ thống tuần hoàn các nguyên tố hóa học, số chu kì nhỏ và chu kì lớn lần lượt là
A. 3 và 3
B. 4 và 3
C. 3 và 4
D. 4 và 4
Đáp án: C
Câu 15: Trong một chu kì, theo chiều tăng dần của điện tích hạt nhân
A. tính kim loại tăng dần.
B. tính phi kim tăng dần.
C. tính kim loại không đổi.
D. tính phi kim giảm dần.
Đáp án: B