Với tóm tắt lý thuyết Hóa học lớp 9 Kim loại hay, chi tiết cùng với 300 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Chương 2: Kim loại
Trắc nghiệm Bài 15: Tính chất vật lí của kim loại
Bài 1: Kim loại có nhiệt độ nóng chảy thấp nhất là:
A. Hg
B. Al
C. Fe
D. W
Lời giải
Hg là kim loại duy nhất ở điều kiện thường ở thể lỏng => có nhiệt độ nóng chảy thấp nhất
Đáp án: A
Bài 2: Kim loại vonfam được dùng làm dây tóc bóng đèn vì những nguyên nhân nào sau đây?
A. Là kim loại rất cứng
B. Là kim loại rất mềm
C. Là kim loại có nhiệt độ nóng chảy rất cao
D. Là kim loại có khối lượng phân tử lớn
Lời giải
Kim loại vonfam được dùng làm dây tóc bóng đèn vì Là kim loại có nhiệt độ nóng chảy rất cao
Đáp án: C
Bài 3: Trong tất cả các kim loại sau đây, kim loại nào dẻo nhất?
A. Đồng (Cu)
B. Nhôm (Al)
C. Bạc (Ag)
D. Vàng (Au)
Lời giải
Kim loại dẻo nhất là vàng (Au)
Đáp án: D
Bài 4: Kim loại nào sau đây nhẹ nhất (có khối lượng riêng nhỏ nhất) ?
A. Liti (Li)
B. Natri (Na)
C. Kali (K)
D. Rubiđi (Rb)
Lời giải
Kim loại nhẹ nhất là liti
Đáp án: A
Bài 5: Kim loại nào ở điều kiện thường ở thể lỏng trong các kim loại sau:
A. Na
B. Ca
C. Li
D. Hg
Lời giải
Tất cả các kim loại có duy nhất kim loại thủy ngân (Hg) ở thể lỏng ở điều kiện thường.
Đáp án: D
Bài 6: Trong tất cả các kim loại sau đây, kim loại nào dẫn điện tốt nhất ?
A. Vàng (Au)
B. Bạc (Ag)
C. Đồng (Cu)
D. Nhôm (Al)
Lời giải
Kim loại nào dẫn điện tốt nhất là Ag
Đáp án: B
Bài 7: Trong các kim loại: Al, Ag, Au, Fe, Cu, thì kim loại dẫn điện tốt nhất là
A. Cu
B. Ag
C. Al
D. Au
Lời giải
Thứ tự dẫn điên của kim loại: Ag > Cu> Au > Al > Fe
=> Ag dẫn điện tốt nhất
Đáp án: B
Bài 8: Có các kim loại sau: đồng, kẽm, magie, natri, bạc. Kim loại dẫn điện tốt nhất là:
A. đồng
B. natri
C. bạc
D. kẽm
Lời giải
Đáp án C
Bài 9: Trong tất cả các kim loại sau đây, kim loại nào có nhiệt độ nóng chảy cao nhất ?
A. Vonfam (W)
B. Đồng (Cu)
C. Sắt (Fe)
D. Kẽm (Zn)
Lời giải
Kim loại có nhiệt độ nóng chảy cao nhất là Vonfam (W)
Đáp án: A
Bài 10: Trong số các kim loại: Ag, Hg, Cu, Al kim loại nào nặng nhất?
A. Ag
B. Hg
C. Cu
D. Al
Lời giải
Kim loại nào nặng nhất là Ag
Đáp án: B
Bài 11: Kim loại được dùng làm vật liệu chế tạo vỏ máy bay do có tính bền và nhẹ là:
A. Na
B. Fe
C. Al
D. K
Lời giải
Kim loại được dùng làm vật liệu chế tạo vỏ máy bay do có tính bền và nhẹ là: Al
Đáp án: C
Bài 12: Kim loại được dùng làm đồ trang sức vì có ánh kim rất đẹp, đó là các kim loại:
A. Ag, Cu
B. Au, Ag
C. Au, Al
D. Ag, Al
Lời giải
Kim loại được dùng làm đồ trang sức vì có ánh kim rất đẹp, đó là Au và Ag (vàng và bạc)
Đáp án: B
Bài 13: Chọn các phát biểu đúng:
1. Vàng là kim loại có tính dẻo cao nhất
2. KL nào dẫn điên tốt thường dẫn nhiệt tốt
3. Tất cả các KL đều có tính ánh kim
4. Mọi KL đều cháy được trong oxi
A. 1,2,4
B. 2,3,4
C. 1,3,4
D. 1, 2
Lời giải
Hầu hết các kim loại đều có ánh kim trừ Au và Pt
Đáp án: D
Bài 14: 1 mol nhôm (nhiệt độ, áp suất trong phòng thí nghiệm), khối lượng riêng 2,7 gam/cm3, có thể tích tương ứng là:
A. 12 cm3
B. 11 cm3
C. 10 cm3
D. 13 cm3
Lời giải
1 mol Al có khối lượng 27 gam
Áp dụng công thức: 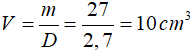
Đáp án: C
Bài 15: 1 mol kali (nhiệt độ áp suất trong phòng thí nghiệm), khối lượng riêng 0,86 gam/cm3, có thể tích tương ứng là:
A. 50 cm3
B. 47 cm3
C. 55, 4 cm3
D. 45,35 cm3
Lời giải
1 mol K có khối lượng 39 gam
Áp dụng công thức: 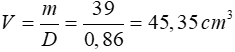
Đáp án: D
Câu 16: 1 mol đồng (nhiệt độ áp suất trong phòng thí nghiệm), thể tích 7,16 cm3, có khối lượng riêng tương ứng là:
A. 7,86 g/cm3
B. 8,39 g/cm3
C. 8,94 g/cm3
D. 9,3 g/cm3
Đáp án: C
Câu 17: Khi cho CaO vào nước thu Điện trở đặc trưng cho khả năng cản trở dòng điện. Điện trở càng lớn thì khả năng dẫn điện của kim loại càng giảm. Cho 4 kim loại X, Y, Z, T ngẫu nhiên tương ứng với Ag, Al, Fe, Cu. Cho bảng giá trị điện trở của các kim loại sau:
| Kim loại | X | Y | T | Z |
| Điện trở | 2,82.10-8 | 1,72.10-8 | 1,00.10-7 | 1,59.10-8 |
X là kim loại:
A. Fe.
B. Ag.
C. Cu.
D. Al.
Điện trở càng lớn thì khả năng dẫn điện càng giảm
Kim loại X có điện trở lớn nhất => trong 4 kim loại X có tính dẫn điện thấp nhất => X là kim loại Fe
Đáp án: A
Câu 18: Trong các kim loại sau đây, kim loại nào dẫn điện tốt nhất là:
A. Bạc
B. Đồng
C. Sắt
D. Nhôm
Trong các kim loại trên , kim loại nào dẫn điện tốt nhất là: bạc
Đáp án: A
Câu 19: Chọn câu trả lời đúng:
A. Tất cả các kim loại tồn tại ở thể rắn.
B. Kim loại có ánh kim
C. Kim loại dẫn điện, không dẫn nhiệt.
D. Kim loại có tính dẻo và giòn.
A thủy ngân là kim loại nhưng ở thể lỏng
C kim loại dẫn điện và dẫn nhiệt
D giòn không phải tính chất chung của kim loại
Đáp án: B
Câu 20: Chọn cụm từ thích hợp để điền vào chổ trống trong các câu sau:
a. Kim loại vonfram được dùng làm dây tóc bóng đèn điện là do có . . (X). . . cao.
b. Bạc vàng được dùng làm . . (Y). . . vì có ánh kim rất đẹp.
c. Nhôm được dùng làm vỏ máy bay do . . (Z). . . và . . (T). . .
d. Đồng và nhôm được dùng làm . . (G). . . là do dẫn điện tốt. (X), (Y), (Z và T), (G) lần lượt là:
A. nhiệt độ nóng chảy, đồ trang sức, mềm và dẻo, dây điện.
B. độ cứng, dây điện, nhẹ và bền, đồ trang sức.
C. độ dẻo, đồ trang sức, cứng và bền, dây điện.
D. nhiệt độ nóng chảy, đồ trang sức, nhẹ và bền, dây điện.
Đáp án: D
Câu 21: Độ dẫn điện, dẫn nhiệt của kim loại phụ thuộc vào yếu tố nào sau đây?
A. Bản chất của kim loại
B. Nhiệt độ của môi trường
C. Pha thể tích bên trong hay pha bề mặt bên ngoài của kim loại
D. Cả A, B, C đều đúng
Độ dẫn điện, dẫn nhiệt của kim loại phụ thuộc vào bản chất của kim loại
Đáp án: A
Trắc nghiệm Bài 16: Tính chất hóa học của kim loại
Bài 1: Thả một mảnh nhôm vào ống nghiệm chứa dung dịch CuSO4. Xảy ra hiện tượng:
A. Không có dấu hiệu phản ứng.
B. Có chất rắn màu trắng bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
C. Có chất rắn màu đỏ bám ngoài lá nhôm, màu xanh của dung dịch CuSO4 nhạt dần.
D. Có chất khí bay ra, dung dịch không đổi mà
Lời giải
Nhôm đứng trước đồng trong dãy điện hóa do đó sẽ đẩy đồng ra khỏi muối
2CuSO4 + 2Al → 3Cu↓ + Al2(SO4)3
Đáp án: C
Bài 2: Axit H2SO4 loãng phản ứng với tất cả các chất trong dãy nào dưới đây?
A. FeCl3, MgO, Cu, Ca(OH)2
B. NaOH, CuO, Ag, Zn
C. Mg(OH)2, CaO, K2SO3, SO2
D. Al, Al2O3, Fe(OH)3, BaCl2
Lời giải
Axit H2SO4 loãng phản ứng được với: Al, Al2O3, Fe(OH)3, BaCl2
Loại A vì Cu không phản ứng
Loại B vì Ag không phản ứng
Loại C vì SO2 không phản ứng
Đáp án: D
Bài 3: Chất nào sau đây không phản ứng với dung dịch HCl
A. Fe
B. Fe2O3
C. SO2
D. Mg(OH)2.
Lời giải
SO2 là oxit axit nên không phản ứng được với HCl
Đáp án: C
Bài 4: Axit sunfuric loãng tác dụng được với dãy chất nào sau đây?
A. Zn, CO2, NaOH
B. Zn, Cu, CaO
C. Zn, H2O, SO3
D. Zn, NaOH, Na2O
Lời giải
H2SO4 loãng tác dụng được với oxit bazơ, bazơ, kim loại đứng trước H, muối
A. Loại CO2
B. Loại Cu
C. Loại H2O, SO3
D. Thỏa mãn
Đáp án cần chọn là: D
Bài 5: Cho các kim loại Fe, Cu, Ag, Al, Mg. Trong các kết luận sau đây, kết luận nào sai ?
A. Kim loại tác dụng với dung dịch HCl, H2SO4 loãng: Cu, Ag
B. Kim loại tác dụng với dung dịch CuSO4 : Fe, Al, Mg
C. Kim loại không tác dụng với H2SO4 đặc nguội: Al, Fe
D. Kim loại không tan trong nước ở nhiệt độ thường: Tất cả các kim loại trên
Lời giải
Kết luận sai là: Kim loại tác dụng với dung dịch HCl, H2SO4 loãng: Cu, Ag
Đáp án: A
Bài 6: Để tách riêng các chất khỏi hỗn hợp gồm Fe, Cu, Al cần phải dùng hóa chất nào sau đây là thích hợp nhất?
A. HCl và HNO3
B. NaOH và HCl
C. HCl và CuCl2
D. H2O và H2SO4
Lời giải
Để tách riêng các chất khỏi hỗn hợp gồm Fe, Cu, Al cần phải dung : NaOH và HCl vì
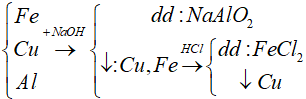
Đáp án: B
Bài 7: Tính chất hóa học chung của kim loại gồm:
A. Tác dụng với phi kim, tác dụng với axit.
B. Tác dụng với phi kim, tác dụng với bazơ, tác dụng với muối.
C. Tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
D. Tác dụng với oxit bazơ, tác dụng với axit.
Lời giải
Tính chất hóa học chung của kim loại gồm: tác dụng với phi kim, tác dụng với axit, tác dụng với muối.
Đáp án: C
Bài 8: Phương pháp nhiệt luyện dùng để điều chế
A. Các kim loại hoạt động mạnh như Ca, Na, Al
B. Các kim loại hoạt động yếu
C. Các kim loại hoạt động trung bình
D. Các kim loại hoạt động trung bình và yếu
Lời giải
Phương pháp nhiệt luyện dùng để điều chế các kim loại hoạt động trung bình
Đáp án: C
Bài 9: Kim loại nhôm bị hòa tan bởi H2SO4 loãng, thu được muối sunfat và khí hiđro. Phản ứng mô tả hiện tượng trên là
A. 2Al + H2SO4 → Al2(SO4)3 + H2
B. 2Al + H2SO4 → Al2SO4 + H2
C. Al + 3H2SO4 → Al(SO4)3 + H2
D. 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Lời giải
Phản ứng đúng là: 2Al + 3H2SO4 → Al2(SO4)3 + 3H2
Đáp án: D
Bài 10: Ngâm một viên kẽm sạch trong dd CuSO4. Câu trả lời nào sau đây là đúng nhất cho hiện tượng quan sát được?
A. Không có hiện tượng nào xảy ra.
B. Một phần viên kẽm bị hòa tan, có một lớp màu đỏ bám ngoài viên kẽm và màu xanh lam của dung dịch nhạt dần.
C. Không có chất mới nào sinh ra, chỉ có một phần viên kẽm bị hòa tan.
D. Kim loại đồng màu đỏ bám ngoài viên kẽm, viên kẽm không bị hòa tan.
Lời giải
Kẽm đứng trước Cu trong dãy điện hóa do đó đẩy được đồng ra khỏi dung dịch muối
Zn + CuSO4 → Cu + ZnSO4
Đáp án: B
Câu 11: Cho phản ứng: Zn + CuSO4 → muối X + kim loại Y. X là
A. ZnSO4
B. CuSO4
C. Cu
D. Zn
Zn + CuSO4 → ZnSO4 + Cu
⇒ muối X là ZnSO4
Đáp án: A
Câu 12: Nhúng một thanh sắt vào dung dịch đồng (II) sunfat. Phản ứng hóa học xảy ra là:
A. Fe + CuSO4 -> FeSO4 + Cu.
B. Fe + Cu2SO4 -> FeSO4 + 2Cu.
C. 2Fe + 3CuSO4 -> Fe2(SO4)3 + 3Cu.
D. 2Fe + 3Cu2SO4 -> Fe2(SO4)3 + 6Cu.
Phản ứng hóa học xảy ra là:
Fe + CuSO4 -> FeSO4 + Cu.↓
Đáp án: A
Câu 13: Cho sơ đồ phản ứng sau: A + NaOH → NaAlO2 + H2O. A là chất nào trong số các chất sau:
A. Al
B. Al2O3
C. Al(OH)3
D. Cả B và C đều đúng
Al2O3+ 2NaOH →2 NaAlO2 + H2O
Hoặc Al(OH)3+ NaOH → NaAlO2 + 2H2O
Đáp án: D
Câu 14: Một bạn học sinh đã đổ nhầm dung dịch sắt (II) sunfat vào lọ chứa sẵn dung dịch kẽm sunfat. Để thu được dung dịch chứa duy nhất muối kẽm sunfat, theo em dùng kim loại nào ?
A. Đồng
B. Sắt
C. Kẽm
D. Nhôm
Để thu được dung dịch chứa duy nhất muối ZnSO4 thì cần loại bỏ được dung dịch FeSO4 và không tạo ra muối nào khác
⇒ kim loại sử dụng được là Zn
PTHH: Zn + FeSO4 → ZnSO4 + Fe
Đáp án: C
Câu 15: Dung dịch muối ZnSO4 có lẫn một ít tạp chất là CuSO4. Dùng kim loại nào sau đây để làm sạch dung dịch ZnSO4 nêu trên là dễ dàng nhất?
A. Fe.
B. Zn.
C. Cu.
D. Mg.
Ta dùng kim loại Zn để làm sạch
Zn + CuSO4 → ZnSO4 + Cu↓
Đáp án: B
Câu 16: Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng. Kim loại A là:
A. Cu
B. Zn
C. K
D. Na
Giả sử kim loại A có hóa trị n (n = 1, 2, 3, 4)
⇒ công thức oxit của kim loại A là A2On
Trong hợp chất oxit của kim loại A thì oxi chiếm 17,02% theo khối lượng
Ta có bảng sau:
| n | 1 | 2 | 3 | 4 |
| MA | 39 (Kali) | 78 (loại) | 117 (loại) | 156 (loại) |
Vậy A là Kali
Đáp án: C
Câu 17: Để oxi hóa hoàn toàn một kim loại R thành oxit phải dùng một lượng oxi bằng 40% lượng kim loại đã dùng. R là kim loại nào sau đây ?
A. Fe
B. Al
C. Mg
D. Ca
Gọi nguyên tử khối của kim loại R là R và có hóa trị là x (x = 1, 2, 3, 4)
Ta có bảng sau:
| x | 1 | 2 | 3 |
| R | 20 (loại) | 40 (canxi) | 60 (loại) |
Vậy R là Canxi
Đáp án: D
Câu 18: Hòa tan 5,1g oxit của một kim loại hóa trị III bằng dung dịch HCl, số mol axit cần dùng là 0,3 mol. Công thức phân tử của oxit đó là :
A. Fe2O3
B. Al2O3
C. Cr2O3
D. FeO
Gọi công thức của oxit là A2O3
Ta có A2O3 + 6HCl → 2ACl3 + 3H2O
Từ pthh ta có nA2O3 = 1/6 nHCl = 1/6 . 0,3 = 0,05 mol
⇒ MA2O3 = mA2O3 : nA2O3 = 5,1 : 0,05 = 102
MA2O3 = 2 . MA + 3 . 16 = 2MA + 48 = 102
⇒ MA = 27 ⇒ A là nhôm
Đáp án: B
Câu 19: Hòa tan hoàn toàn 18 gam một kim loại M cần dùng 800 ml dung dịch HCl 2,5M. Kim loại M là kim loại nào sau đây? (biết hóa trị của kim loại trong khoảng từ I đến III).
A. Ca
B. Mg
C. Al
D. Fe
Ta có bảng sau:
| n | 1 | 2 | 3 |
| M | 9 (loại) | 18 (loại) | 27 (Al) |
Đáp án: C
Câu 20: Cho 17g oxit M2O3 tác dụng hết với dung dịch H2SO4 thu được 57g muối sunfat. Nguyên tử khối của M là:
A. 56
B. 52
C. 55
D. 27
Đáp án: D
Câu 21: Đốt cháy hoàn toàn 9,6 gam một kim loại M (chưa rõ hóa trị) trong bình chứa khí clo nguyên chất. Sau khi phản ứng kết thúc, để nguội thì thu được 20,25 gam muối clorua. Kim loại M là
A. Fe
B. Al
C. Cu
D. Zn
Ta có bảng sau:
| n | 1 | 2 | 3 | 4 |
| M | 32 (loại) | 64 (Cu) | 96 (loại) | 128 (loại) |
Vậy M là kim loại Cu
Đáp án: C
Câu 22: Cho 10,8 g một kim loại M (hóa trị III) phản ứng với khí clo tạo thành 53,4g muối. Kim loại M là:
A. Na
B. Fe
C. Al
D. Mg
2M + 3Cl2 → 2MCl3 (1)
Áp dụng định luật bảo toàn khối lượng ta có
mCl2 + mM = mMCl3
⇒ mCl2 = mMCl3 – mCl2 = 53,4 – 10,8 = 42,6g
⇒ nCl2 = mCl2 : MCl2 = 42,6 : 71 = 0,6 mol
Từ pt (1) ta có nM= 2/3 . nCl2 = 2/3 . 0,6 = 0,4 mol
⇒ MM = mM : nM = 10,8 : 0,4 = 27g/mol
⇒ M là nhôm
Đáp án: C
Câu 23: Cho 1,3 gam kẽm phản ứng với 14,7 gam dung dịch H2SO4 20%. Khi phản ứng kết thúc khối lượng khí thoát ra là:
A. 0,03 gam
B. 0,06 gam
C. 0,04 gam
D. 0,02 gam
Đáp án: C
Câu 24: Hòa tan 5,6 gam Fe bằng 250ml dung dịch HCl 1M, sau phản ứng thu được dung dịch X có chứa chất tan T. Chất T có khả thể tác dụng với Na2CO3 tạo khí. Coi thể tích dung dịch thay đổi không đáng kể. Nồng độ mol của T là:
A. 0,2M.
B. 0,4M.
C. 0,6M.
D. 0,8M.
Đáp án: A
Câu 25: Cho 1,35g Al vào dung dịch chứa 7,3g HCl. Khối lượng muối nhôm tạo thành là
A. 6,675 g
B. 8,945 g
C. 2,43 g
D. 8,65 g
Đáp án: A
Câu 26: Hòa tan 2,7 gam kim loại A bằng dung dịch H2SO4 loãng dư. Sau phản ứng thu được 3,36 lít H2 (đktc). Kim loại A là:
A. Fe
B. Sn
C. Zn
D. Al
Ta có bảng sau:
| n | 1 | 2 | 3 | 4 |
| M | 9 (loại) | 18 (loại) | 27 (Al) | 36 (loại) |
Vậy A là kim loại Al
Đáp án: D
Câu 27: Cho 1,08 gam kim loại R vào dung dịch H2SO4 loãng dư. Lọc dung dịch, đem cô cạn thu được 6,84 gam một muối khan duy nhất. Kim loại R là:
A. Niken
B. Canxi
C. Nhôm
D. Sắt
Ta có bảng sau:
| n | 1 | 2 | 3 | 4 |
| M | 9 (loại) | 18 (loại) | 27 (Al) | 36 (loại) |
Vậy A là kim loại Al
Đáp án: C
Câu 28: Clo hoá 33,6g một kim loại A ở nhiệt độ cao thu được 97,5g muối ACl3. A là kim loại:
A. Al
B. Cr
C. Au
D. Fe
2A + 3Cl2 → 2ACl3
Áp dụng định luật bảo toàn khối lượng ta có
mA + mCl2 = mACl3 ⇒ mCl2 = mACl3 – mA = 97,5 – 33,6 = 63,9g
⇒ nCl2 = 0,9 mol
Từ PTHH ta có nA = 2/3 nCl2 = 0,6 mol
⇒ MA = mA : nA = 33,6 : 0,6 = 56 (sắt)
Đáp án: D
Câu 29: Cho 6,5 gam Zn vào dung dịch HCl dư. Hỏi thể tích khí thu được từ phản ứng ở đktc là bao nhiêu? (cho Zn = 65)
A. 1,12 lít
B. 2,24 lít
C. 3,36 lít
D. 22,4 lít
Đáp án: B
Câu 30: Hòa tan hoàn toàn 5,6 gam Fe bằng dung dịch HCl, sau phản ứng thu được V lít H2 (đktc). Giá trị của V là:
A. 1,12 lít.
B. 2,24 lít.
C. 3,36 lít.
D. 4,48 lít.
Đáp án: B
Câu 31: Cho lá nhôm vào dung dịch axit HCl có dư thu được 3,36 lít khí hiđro (ở đktc). Khối lượng nhôm đã phản ứng là :
A. 1,8 g
B. 2,7 g
C. 4,05 g
D. 5,4 g
Đáp án: B
Câu 32: Cho phản ứng hóa học: x… + H2SO4 -> FeSO4 + y…↑. Tổng (x + y) có thể là:
A. 1
B. 2
C. 3
D. 4
Fe + H2SO4 → FeSO4 + H2↑
⇒ Tổng (x+y) = 1+1 = 2
Đáp án: B
Câu 33: Cho phản ứng: Fe3O4 + 8HCl → xFeCl2 + yFeCl3 + 4H2O
Tỉ lệ x, y là:
A. 1:2
B. 2:1
C. 3:1
D. 1:1
Fe3O4 + 8HCl → xFeCl2 + yFeCl3 + 4H2O
Số nguyên tử Fe bên trái = số nguyên tử Fe bên phải
⇒ 3 = x + y (1)
Số nguyên tử Cl bên trái = số nguyên tử Cl bên phải
⇒ 8 = 2x + 3y (2)
Từ (1) và (2) ⇒ x = 1 ; y = 2
Đáp án: A
Câu 34: Cho hỗn hợp bột gồm: Al, Fe, Mg và Cu vào dung dịch HCl dư, sau phản ứng thu được chất rắn T không tan. Vậy T là:
A. Al.
B. Fe.
C. Mg.
D. Cu.
Cu là kim loại đứng sau H trong dãy điện hóa nên không tan trong dd HCl ⇒ chất rắn T là Cu
Đáp án: D
Câu 35: Nhúng một thanh sắt vào dung dịch CuSO4, sau một thời gian thấy khối lượng chất rắn tăng 1,6 gam. Số mol CuSO4 đã tham gia phản ứng là:
A. 0,1 mol.
B. 0,2 mol.
C. 0,3 mol.
D. 0,4 mol.
Đáp án: B
Câu 36: Ngâm một lá sắt có khối lượng 20g vào dung dịch bạc nitrat, sau một thời gian phản ứng nhấc lá kim loại ra làm khô cân nặng 23,2g. Lá kim loại sau phản ứng có:
A. 18,88g Fe và 4,32g Ag
B. 1,880g Fe và 4,32g Ag
C. 15,68g Fe và 4,32g Ag
D. 18,88g Fe và 3,42g Ag
Đáp án: A
Câu 37: Cho 5,4 (g) bột nhôm vào 60 (ml) dung dịch AgNO3 1M. Lắc kĩ để phản ứng xảy ra hoàn toàn. Sau phản ứng thu được m (g) chất rắn. Tính m?
A. 11,34g
B. 13,14g
C. 11,43g
D. 14,31g
→ Nhôm dư: 0,2 – 0,02 – 0,18 (mol)
Chất rắn m gồm Al (dư) và Ag (phản ứng tạo thành)
→ mAl = n.m = 0,18.27 = 4,86 (g)
→ mAg = n.m = 0,06.108 = 6,48 (g)
Vậy m = 4,86 + 6,48 = 11,34 (g)
Đáp án: A
Câu 38: Nhúng 1 thanh Al nặng 50 gam vào 400ml dung dịch CuSO4 0,5M. Sau một thời gian, lấy thanh Al ra cân nặng 51,38 gam. Khối lượng Cu đã giải phóng là:
A. 0,81g
B. 1,62g
C. 1,92g
D. 1,38g
Đáp án: C
Câu 39: Hòa tan hoàn toàn một kim loại R có hóa trị II bằng dung dịch H2SO4 9,8% (loãng) vừa đủ, sau phản ứng thu được dung dịch X chứa muối Y với nồng độ phần trăm là 14,394%. Kim loại R là:
A. Mg.
B. Fe.
C. Zn.
D. Cu.
Đáp án: B
Câu 40: Hoà tan 16,8g kim loại hoá trị II vào dung dịch HCl dư, sau phản ứng thu được 6,72 lít khí H2 (đktc). Kim loại đem hoà tan là:
A. Mg
B. Zn
C. Pb
D. Fe
Gọi A là kim loại cần tìm
A + 2HCl → ACl2 + H2
nH2 = VH2 : 22,4 = 6,72 : 22,4 = 0,3 mol
từ pthh ta có nA = nH2 = 0,3 mol
⇒ MA = mA : nA = 16,8 : 0,3 = 56g/mol ⇒ A là sắt
Đáp án: D
Câu 41: Chọn câu đúng nhất khi nói đến tính chất hóa học của kim loại
A. Dãy gồm các kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thường) sẽ tạo thành các oxit bazơ tương ứng với nó.
B. Kim loại hoạt động hóa học mạnh hơn (trừ Na, K, Mg, Ca) có thể đẩy kim loại hoạt động yếu hơn ra khỏi dung dịch muối, tạo thành muối mới và kim loại mới.
C. Hầu hết tất cả các kim loại có thể phản ứng với dung dịch axit HCl hoặc H2SO4 loãng để giải phóng khí hiđro và sinh ra muối.
D. Ở nhiệt độ cao, các kim loại như Cu, Mg, Fe…phản ứng với lưu huỳnh tạo thành sản phẩm là muối sunfua tương ứng là CuS, MgS, FeS.
A. sai vì kim loại Mg, Al, Zn, Cu khi tác dụng với oxi (ở điều kiện thích hợp) sẽ tạo thành các oxit bazơ tương ứng với nó.
B. Sai vì từ kim loại Mg trở về sau trong dãy điện hóa thì kim loại mạnh hơn đẩy kim loại yếu hơn ra khỏi muối
C. Sai vì phải là các kim loại đứng trước H trong dãy điện hóa mới phản ứng được với dd HCl và H2SO4 loãng sinh ra khí hiđro và muối.
D. đúng
Đáp án: D
Câu 42: KL nào sau đây tác dụng với dd HCl loãng và tác dụng với khí Clo cho cùng loại muối clorua kim loại
A. Fe
B. Zn
C. Cu
D. Ag
Để tác dụng với HCl và khí clo cho cùng 1 muối khi kim loại đó chỉ có 1 số oxi hóa và đứng trước H2 trong dãy điện hóa
Đáp án: B
Câu 43: Cho các phương trình hóa học sau:
(1) Cu + Fe(NO3)2 → Fe + Cu(NO3)2.
(2) Al + FeSO4 → Fe + Al2(SO4)3
(3) Mg + CuCl2 → MgCl2 + Cu
(4) Ba + Na2SO4 + 2H2O → BaSO4 + 2NaOH + H2.
Số phương trình hóa học viết chưa đúng là
A. 1
B. 2
C. 3
D. 4
(1) sai vì phản ứng không xảy ra vì Cu là kim loại đứng sau Fe trong dãy điện hóa nên không đẩy được Fe ra khỏi dung dịch muối của nó.
(2) sai vì phương trình chưa được cân bằng
2Al + 3FeSO4 → 3Fe + Al2(SO4)3
(3) đúng
(4) đúng
Vậy có 2 phương trình chưa viết đúng
Đáp án: B
Câu 44: Phản ứng sai là:
A. 3Fe + 2O2 → Fe3O4
B. 2Cu + O2 → 2CuO
C. 4Ag + O2 → 2Ag2O
D. 2Al + 3S → Al2S3
Ag không phản ứng với oxi ở nhiệt độ thường
Đáp án: C
Câu 45: Cặp chất nào có tính chất hoá học tương tự nhau:
A. Mg và S
B. Ca và Oxi
C. Mg và Al
D. C và Na
A Mg là kim loại còn S là phi kim do đó tính chất hóa học trái nhau
B, D tương tự A
Đáp án: C
Câu 46: Nung hỗn hợp gồm 5,6 gam sắt và 1,6 gam lưu huỳnh trong điều kiện không có không khí. Sau phản ứng thu được hỗn hợp chất rắn A. Cho dung dịch HCl 0,5M phản ứng vừa đủ với chất rắn A thu được hỗn hợp khí
B. Thể tích dung dịch HCl 0,5M đã dùng là
A. 100 ml.
B. 200 ml.
C. 300 ml.
D. 400 ml.
Đáp án: D
Câu 47: Hòa tan 25,8g hỗn hợp gồm bột Al và Al2O3 trong dung dịch HCl dư. Sau phản ứng người ta thu được 0,6g khí H2. Khối lượng muối AlCl3 thu được là :
A. 53,4g
B. 79,6g
C. 80,1g
D. 25,8g
nH2 = mH2 : MH2 = 0,6 : 2 = 0,3 mol
2Al + 6HCl → 2AlCl3 + 3H2 (1)
Al2O3 + 6HCl → 2AlCl3 + 3H2O (2)
Theo pt (1) ta có nAl = 2/3 nH2 = 0,2 mol
⇒ mAl2O3 = mhh – mAl = 25,8 – 0,2 , 27 = 20,4g
⇒ nAl2O3 = mAl2O3 : MAl2O3 = 20,4 : (27 . 2 + 48) = 0,2 mol
nAlCl3 = nAlCl3 (1) + nAlCl3 (2) = nAl + 2nAl2O3 = 0,6 mol
⇒ mAlCl3 = 0,6 . 133,5 = 80,1g
Đáp án: C
Câu 48: Cho 4,6 gam một kim loại M hóa trị I phản ứng với khí Clo tạo thành 11,7g muối. M là kim loại nào sau đây?
A. Ag
B. Li
C. K
D. Na
Đáp án: D
Câu 49: Hòa tan 2,8 gam một kim loại R có hóa trị II bằng một hỗn hợp gồm 80 ml dung dịch H2SO4 0,5M và 200 ml dung dịch HCl 0,2M thu được dung dịch A và V lít khí H2(ở đktc). Để trung hòa dung dịch A thì cần 100 ml dung dịch KOH 0,2M. Phát biểu nào dưới đây về bài toán trên là chưa đúng?
A. Kim loại R không tan được trong nước ở điều kiện thường.
B. Kim loại R khi phản ứng với lưu huỳnh sẽ tạo ra chất rắn có màu đen.
C. Giá trị của V là 1,12.
D. Thành phần phần trăm về khối lượng của R (hóa trị II) trong hợp chất muối sunfat ứng với R là 28%.
Đáp án: D
Câu 50: Có các phản ứng sau:
a. HCl + (A) → MgCl2 + H2
b. AgNO3 + (B) → Cu(NO3)2 + Ag
c. S + (C) → K2S d. (D) + Cl2 → ZnCl2
(A), (B), (C), (D) lần lượt là:
A. KCl, MgO, CuO,ZnO
B. Zn, Mg, K,Cu
C. Mg, Cu, K,Zn
D. MgO, CuO, KCl,ZnO
HCl + (A) → MgCl2 + H2 ⇒ A là Mg
AgNO3 + (B) → Cu(NO3)2 + Ag ⇒ B là Cu
S + (C) → K2S ⇒ C là K(D) + Cl2 → ZnCl2 ⇒ D là Zn
Đáp án: C
Câu 51: Cho các phương trình phản ứng
A. O2, HCl, H2, CuO
B. O2, Cl2, HCl, CuSO4
C. O2, HCl, Cl2, SO3
D. O2, Cl2, H2, CuSO4
Đáp án: B
Câu 52: Đốt cháy hoàn toàn 1,35g nhôm trong oxi. .Khối lượng nhôm oxit tạo thành và khối lượng oxi đã tham gia phản ứng là:
A. 2,25g và 1,2g
B. 2,55g và 1,28g
C. 2,55 và 1,2g
D. 2,7 và 3,2 g
Đáp án: C
Câu 53: Đốt nhôm trong bình khí Clo . Sau phản ứng thấy khối lượng chất rắn trong bình tăng 7,1g . Khối lượng nhôm đã tham gia phản ứng là :
A. 2,7g
B. 1,8g
C. 4,1g
D. 5,4g
2Al + 3Cl2 → 2AlCl3
Dễ thấy m chất rắn tăng = mCl2 = 7,1g
⇒ nCl2 = 0,1 mol
nAl = 2/3 nCl2 = 1/15 mol
⇒ mAl = nAl . MAl = 1/15 . 27 = 1,8g
Đáp án: B
Trắc nghiệm Bài 17: Dãy hoạt động hóa học của kim loại
Bài 1: Cho dây nhôm vào trong ống nghiệm chứa dung dịch nào sẽ có phản ứng hóa học xảy ra?
A. CuSO4
B. Na2SO4
C. MgSO4
D. K2SO4
Lời giải
Al sẽ phản ứng được với dung dịch muối của kim loại yếu hơn Al
=> kim loại yếu hơn Al là Cu
PTHH: Zn + CuSO4 → ZnSO4 + Cu
Đáp án: A
Bài 2: Dung dịch ZnSO4 có lẫn tạp chất là CuSO4. Dùng kim loại nào sau đây để làm sạch dung dịch ZnSO4?
A. Fe
B. Zn
C. Cu
D. Mg
Lời giải
Dùng kẽm vì có phản ứng:
Zn + CuSO4 → ZnSO4 + Cu ↓
Nếu dùng dư Zn, Cu tạo thành không tan được tách ra khỏi dung dịch và thu được dung dịch ZnSO4 tinh khiết.
Đáp án: B
Bài 3: Có 1 mẫu dung dịch FeSO4 bị lẫn tạp chất CuSO4, có thể làm sạch mẫu dung dịch này bằng kim loại nào?
A. Zn
B. Mg
C. Fe
D. Cu
Lời giải
Có thể làm sạch mẫu dung dịch này bằng kim loại Fe vì
Fe + CuSO4 → Cu + FeSO4
Đáp án: C
Bài 4: Các cặp sau cặp nào xảy ra phản ứng:
A. Cu + ZnCl2
B. Zn + CuCl2
C. Fe + ZnCl2
D. Zn + ZnCl2
Lời giải
Cặp xảy ra phản ứng là: Zn + CuCl2 → ZnCl2 + Cu
Đáp án: B
Bài 5: Cho các cặp chất dưới đây, cặp chất nào không xảy ra phản ứng?
A. ZnSO4 và Mg
B. CuSO4 và Ag
C. CuCl2 và Al
D. CuSO4 và Fe
Lời giải
CuSO4 + Ag không xảy ra vì Ag là KL đứng sau Cu trong dãy điện hóa
Đáp án: B
Bài 6: Các cặp chất sau, cặp chất nào xảy ra phản ứng:
A. CuSO4 + Fe
B. Ag + HCl
C. Au + HNO3
D. Cu + HCl
Lời giải
Ag, Cu đứng sau hidro trong dãy điện hóa do đó không phản ứng với axit không có tính oxi hóa => loại B, D
Au không tan trong axit, tan trong dd nước cường toan => loại C
Đáp án: A
Bài 7: Dãy kim loại nào sau đây được sắp xếp đúng theo chiều hoạt động hóa học tăng dần?
A. K, Mg, Cu, Al, Zn, Fe.
B. Fe, Cu, K, Mg, Al, Zn.
C. Cu, Fe, Zn, Al, Mg, K.
D. Zn, K, Mg, Cu, Al, Fe.
Lời giải
Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần là: Cu, Fe, Zn, Al, Mg, K
Đáp án: C
Bài 8: Dãy nguyên tố nào sau đây xếp theo chiều tăng dần tính kim loại?
A. Fe, Zn, Al, Mg, Na.
B. Zn, Fe, Al, Na.
C. Na, Mg, Al, Zn, Fe.
D. Fe, Zn, Na, Al, Mg.
Lời giải
Thứ tự tính kim loại tăng dần là: Fe, Zn, Al, Mg, Na.
Đáp án: A
Bài 9: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần:
A. K, Al, Mg, Cu, Fe
B. Cu, Fe, Mg, Al, K
C. Cu, Fe, Al, Mg, K
D. K,Cu, Al, Mg, Fe.
Lời giải
Thứ tự chiều hoạt động hóa học tăng dần của kim loại là: Cu, Fe, Al, Mg, K.
Đáp án: C
Bài 10: Cho Al từ từ đến dư vào dung dịch hỗn hợp Cu(NO3)2; AgNO3; Fe(NO3)3 thứ tự các ion bị khử là:
A. Ag+, Cu2+, Fe3+
B. Ag+, Fe3+, Cu2+, Fe2+
C. Fe3+ ,Cu2+, Ag+
D. Ag+, Cu2+, Fe2+ ,Fe3+
Lời giải
Cho Al từ từ đến dư vào dung dịch hỗn hợp Cu(NO3)2; AgNO3; Fe(NO3)3 thứ tự các ion bị khử là : Ag+, Fe3+, Cu2+, Fe2+ vì theo thứ tự với chất có tính oxi hóa cao nhất : Ag+ > Fe3+> Cu2+ > Fe2+
Đáp án: B
Câu 11: Nhóm kim loại nào có thể tác dụng với nước ở nhiệt độ thường:
A. Cu, Ca, K, Ba
B. Zn, Li, Na, Cu
C. Ca, Mg, Li, Zn
D. K, Na, Ca, Ba
Nhóm kim loại tác dụng với nước ở nhiệt độ thường là: K, Na, Ca, Ba
Đáp án: D
Câu 12: Dãy kim loại nào sau đây tác dụng được với nước ở nhiệt độ thường:
A. Na, Fe, Ca, Ba
B. K, Na, Ba, Ca
C. K, Na, Ca, Zn
D. Cu, Ag, Na, Fe
Fe, Zn, Ag, Cu không tác dụng với nước ở nhiệt độ thường
Đáp án: B
Câu 13: Dãy gồm các kim loại đều phản ứng với nước ở nhiệt độ thường :
A. Na, Al
B. K, Na
C. Al, Cu
D. Mg, K
Nhớ các kim loại tan trong nước Khi Nào Cần tức K, Na, Ca phản ứng với nước ở đk thường
Đáp án: B
Câu 14: Kim loại tác dụng được với nước ở điều kiện thường là:
A. Al
B. Ba
C. Fe
D. Zn
Kim loại tác dụng được với nước ở điều kiện thường là: Ba
Đáp án: B
Câu 15: Các nhóm kim loại nào sau đây phản ứng với HCl sinh ra khí H2?
A. Fe, Cu, K, Ag, Al, Ba
B. Cu, Fe, Zn, Al, Mg, K
C. Mg, K, Fe, Al, Na
D. Zn, Cu, K, Mg, Ag, Al, Ba
Các kim loại phản ứng với HCl sinh ra khí H2 là: Mg, K, Fe, Al, Na
Đáp án: C
Câu 16: Dãy gồm các kim loại đều tác dụng được với axít HCl:
A. Na, Al, Cu, Mg
B. Zn, Mg, Cu
C. Na, Fe, Al, K
D. K, Na, Al, Cu
Cu đứng sau H2 trong dãy điện hóa ⇒ không phản ứng được với HCl ⇒ loại A, B, D
Đáp án: C
Câu 17: Dãy gồm các chất đều tác dụng được với dung dịch H2SO4 đặc, nguội là:
A. Na, K,Mg, Al, Cu
B. Na, K, Mg, Fe, Cu
C. Na, K, Al, Fe, Cu
D. Na, K, Mg, Cu, Ag
Đáp án: D
Câu 18: Kim loại Cu có thể phản ứng được với:
A. Dung dịch HCl
B. Dung dịch H2SO4 loãng
C. H2SO4 đặc, nóng
D. Dung dịch NaOH
Kim loại Cu có thể phản ứng được với H2SO4 đặc, nóng
Đáp án: C
Câu 19: Hiện tượng quan sát được khi ta đổ từ từ dung dịch NaOH đến dư vào dung dịch AlCl3 là:
A. Xuất hiện kết tủa keo trắng đến cực đại, sau đó kết tủa không tan khi cho dư NaOH
B. Xuất hiện kết tủa keo trắng đến cực đại, sau đó kết tủa tan từ từ đến khi cho dư NaOH, dung dịch thu được trong suôt
C. Không có hiện tượng gì xảy ra
D. Ban đầu không có hiện tượng gì, sau đó xuất hiện kết tủa keo trắng từ từ đến cực đại.
Hiện tượng quan sát được khi ta đổ từ từ dung dịch NaOH đến dư vào dung dịch AlCl3 là:
Xuất hiện kết tủa keo trắng đến cực đại, sau đó kết tủa tan từ từ đến khi cho dư NaOH, dung dịch thu được trong suôt
PTHH : 3NaOH + AlCl3 → 3 NaCl + Al(OH)3
NaOH + Al(OH)3 → NaAlO2 + 2H2O
Dung dịch NaAlO2 là dung dịch trong suốt
Đáp án: B
Câu 20: Kim loại nào sau đây dùng làm sạch dung dịch đồng nitrat có lẫn bạc nitrat:
A. Fe
B. K
C. Cu
D. Ag
Làm sạch dung dịch Cu(NO3)2 là loại bỏ được AgNO3 và sau phản ứng chỉ thu được Cu(NO3)2
⇒ dùng kim loại Cu
PTHH: Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Đáp án: C
Câu 21: Dãy gồm các kim loại đều phản ứng với dd CuSO4:
A. Na, Al, Cu
B. Al, Fe, Mg, Cu
C. Na, Al, Fe, K
D. K, Mg, Cu, Fe
- Na + H2O → NaOH + ½ H2
- NaOH + CuSO4 → Cu(OH)2 + Na2SO4
- Al + CuSO4 → Al2(SO4)3 + Cu
- Fe + CuSO4 → FeSO4 + Cu
- K + H2O → KOH + ½ H2
- KOH + CuSO4 → Cu(OH)2 + K2SO4
Đáp án: C
Câu 22: KL nào sau dây được dùng để nhận biết cả 3 dd: NaCl, CuCl2, Na2SO4
A. Mg
B. Ba
C. Fe
D. Al
Ba + 2H2O → Ba(OH)2 + H2
Khi cho Ba vào các dd muối thì Ba phản ứng với nước trước tạo thành dd Ba(OH)2 sau đó dd Ba(OH)2 phản ứng với các muối
+ dd chỉ xuất hiện bọt khí là NaCl
+ dd xuất hiện bọt khí và kết tủa màu xanh lơ
CuSO4 + Ba(OH)2 → Cu(OH)2↓ + BaSO4
+ dd xuất hiện bọt khí và kết tủa trắng là Na2SO4
Na2SO4 + Ba(OH)2 → BaSO4↓ + 2NaOH
Đáp án: B
Câu 23: Một người thợ đã làm lẫn Zn và Fe vào Ag. Để thu được Ag tinh khiết thì người ta dùng dung dịch nào sau đây?
A. Dung dịch AgNO3
B. Dung dịch Fe(NO3)2
C. Dung dịch Zn(NO3)2
D. Cả A, B, C đều đúng
Để thu được Ag tinh khiết thì người ta dùng dung dịch : AgNO3
Vì Zn, Fe + AgNO3 → muối Fe(NO3)2 + Zn(NO3)2 + Ag
Đáp án: A
Câu 24: Kim loại nào sau đây tác dụng được với muối CuCl2 và AlCl3?
A. Ag
B. Fe
C. Zn
D. Mg
Kim loại tác dụng được với muối CuCl2 và AlCl3 là Mg
Đáp án: D
Câu 25: Cho 12 gam hỗn hợp Fe và Cu vào dung dịch HCl dư thấy thoát ra 2,24 lít khí (đktc) và còn lại m gam chất rắn. Giá trị của m là
A. 6,4
B. 3,2
C. 10,0
D. 5,6
Cu đứng sau H nên Cu không phản ứng được với dung dịch HCl
Fe + 2HCl → FeCl2 + H2
0,1 mol(Fe) ← 0,1 mol(H2)
⇒ mFe = 0,1.56 = 5,6 gam ⇒ mCu = 12 – 5,6 = 6,4 gam
Đáp án: A
Câu 26: Cho 0,8gam CuO và Cu tác dụng với 20ml dd H2SO4 1M. Dung dịch thu được sau phản ứng
A. chỉ có CuSO4.
B. chỉ có H2SO4.
C. có CuSO4 và H2SO4.
D. có CuSO3 và H2SO4.
Khi cho hh CuO và Cu tác dụng với H2SO4 thì chỉ có CuO phản ứng với H2SO4
Giả sử hỗn hợp chỉ có CuO ⇒ nCuO = 0,8 : 80 = 0,01mol theo đề bài ta thấy nH2SO4 = 0.02 mol⇒ sau phản ứng H2SO4 dư ⇒ dung dịch thu được sau phản ứng gồm: H2SO4 dư và CuSO4
Đáp án: C
Câu 27: Cho 8,3 g hỗn hợp gồm nhôm và sắt tác dụng với dung dịch H2SO4 loãng dư. Sau PƯ thu được 5,6 lít khí đo ở đktc . Tính thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp đầu.
A. 32% và 68%
B. 40% và 60%
C. 32,5% và 67,5%
D. 30% và 70%
Gọi a, b là số mol của Al và Fe trong 8,3 g hỗn hợp ban đầu
PTHH:
Đáp án: C
Câu 28: Hòa tan 12g hỗn hợp gồm Al, Ag vào dung dịch H2SO4 loãng, dư. Phản ứng kết thúc thu được 13,44 lít khí H2 (đktc) . Thành phần % khối lượng của Al, Ag trong hỗn hợp lần lượt là
A. 70% và 30%
B. 90% và 10%
C. 10% và 90%
D. 30% và 70%
nH2 = VH2 : 22,4 = 13,44 : 22,4 = 0,6 mol
Ag đứng sau H2 trong dãy điện hóa do đó khi cho Al và Ag phản ứng với H2SO4 chỉ có Al phản ứng
Đáp án: B
Câu 29: Cho 27,6 gam hỗn hợp 2 kim loại Mg và Ag tác dụng với dung dịch HCl vừa đủ, sau phản ứng thấy thoát ra 5,6 lít khí ở đktc. Thành phần phần trăm theo khối lượng của mỗi kim loại trong hỗn hợp ban đầu lần lượt là:
A. 21,74% và 78,26%
B. 78,26% và 21,74%
C. 88, 04% và 11,96%
D. 11,96% và 88, 04%
Đặt số mol của Mg và Ag lần lượt là x và y mol → mhh = 24x +108y=27,6(g)(1)
Số mol khí H2 thoát ra là : 0,25 = x (2)
Giải (1) và (2) → x =0,25 và y =0,2 mol
Thành phần % từng kim loại trong hỗn hợp là :
Đáp án: A
Câu 30: Dãy các kim loại được xếp theo chiều hoạt động hoá học tăng dần là
A. K, Mg, Cu, Al, Zn, Fe.
B. Fe, Cu, K, Mg, Al, Zn.
C. Cu, Fe, Zn, Al, Mg, K.
D. Zn, K, Mg, Cu, Al, Fe.
Thứ tự sắp xếp đúng là: Cu, Fe, Zn, Al, Mg, K.
Đáp án: C
Câu 31: Cách sắp xếp các kim loại theo chiều hoạt động hoá học giảm dần .
A. Na, Fe, Pb, Cu, Ag, Au
B. K, Cu, Ag, Mg, Al
C. Fe, Cu, Al, Zn, Ca
D. Ca, Na, Cu, Au, Ag
Các kim loại sắp xếp theo chiều hoạt động giảm dần là: Na, Fe, Pb, Cu, Ag, Au
Đáp án: A
Câu 32: Dãy gồm các kim loại được sắp xếp theo chiều giảm dần về hoạt động hoá học :
A. Na, Al, Cu, K, Mg, H
B. Mg, Na, K, Al, Fe, H, Cu
C. Na, K, Mg, Al, Fe, Cu, H
D. K, Na, Mg, Al, Fe, H, Cu
Đáp án: D
Câu 33: Cho dung dịch AgNO3 vào dung dịch NaCl thì có hiện tượng là:
A. Có bọt khí thoát ra, dung dịch thu được không màu
B. Có xuất hiện kết tủa trắng
C. Dung dịch đổi màu vàng nâu
D. Không có hiện tượng gì xảy ra
Cho dung dịch AgNO3 vào dung dịch NaCl thì có hiện tượng là: Có xuất hiện kết tủa trắng
AgNO3 + NaCl → AgCl(↓ trắng) + NaNO3
Đáp án: B
Câu 34: Cho dãy các kim loại sau, dãy được sắp xếp theo chiều tăng tính khử của kim loại là:
A. Al, Fe, Zn, Mg
B. Ag, Cu, Mg, Al
C. Na, Mg, Al, Fe
D. Ag, Cu, Al, Mg
Dãy các kim sắp xếp theo chiều tăng tính khử của kim loại là Ag, Cu, Al, Mg
A sai vì Al khử mạnh hơn Fe và Zn
B sai vì Mg khử mạnh hơn Al
C sai vì Na > Mg > Al >Fe
Đáp án: D
Câu 35: Phản ứng hóa học nào sau đây không chính xác:
A. Fe + CuSO4 -> FeSO4 + Cu.
B. Fe + 2AgNO3 -> Fe(NO3)2 + 2Ag.
C. Cu + MgSO4 -> CuSO4 + Mg.
D. Cu + 2AgNO3 -> Cu(NO3)2 + 2Ag.
Phản ứng C sai vì Cu là kim loại đứng sau Mg trong dãy điện hóa, nên Cu không thể đẩy được Mg ra khỏi muối MgSO4
Đáp án: C
Câu 36: Kim loại X có đặc điểm:
- Tác dụng với dung dịch HCl, giải phóng H2
- Muối X(NO3)2 hoà tan được Fe.
Trong dãy hoạt động hoá học của kim loại, chọn câu đúng về vị trí của X:
A. Đứng giữa Fe và Cu
B. Đứng giữa Fe và H
C. Đứng giữa Fe và Zn
D. Đứng giữa Al và Fe
- X tác dụng với dung dịch HCl, giải phóng H2 ⇒ X đứng trước H trong dãy điện hóa
- Muối X(NO3)2 hoà tan được Fe ⇒ X đứng sau Fe trong dãy điện hóa
Đáp án: B
Câu 37: Phản ứng nào dưới đây không xảy ra?
A. dd CuCl2 + Fe
B. dd CuCl2+ Al
C. dd NaOH + Fe
D. dd NaOH + Al
A. dd CuCl2 + Fe
B. dd CuCl2 + Al
C. dd NaOH + Fe
D. dd NaOH + Al
Đáp án: C
Câu 38: Kim loại nào sau đây không tác dụng với HNO3 đặc nguội?
A. Cu
B. Zn
C. Fe
D. Na
Kim loại không tác dụng với HNO3 đặc nguội : Fe
Đáp án: C
Câu 39: Có 4 kim loại là: Al, Fe, Mg, Cu và 4 dung dịch ZnSO4, AgNO3, CuCl2, MgSO4. Kim loại nào tác dụng được với cả 4 dung dịch trên là:
A. Al
B. Fe
C. Mg
D. Không có kim loại nào
Không có kim loại nào tác dụng được với cả 4 dung dịch trên
Đáp án: D
Trắc nghiệm Bài 18: Nhôm
Bài 1: Một kim loại có những tính chất (vật lí và hóa học) như sau:
- Hợp kim của nó với các kim loại khác, được ứng dụng trong công nghệ chế tạo máy bay, tên lửa.
- Phản ứng mãnh liệt với axit clohiđric.
- Phản ứng với dung dịch kiềm, giải phóng khí hiđro
- Nhẹ, dẫn điện và dẫn nhiệt tốt. Đó là kim loại:
A. kẽm
B. vàng
C. nhôm
D. chì
Lời giải
Vì là kim loại phản ứng với dung dịch kiềm, giải phóng khí hiđro và nhẹ dẫn điện, dẫn nhiệt tốt
=> kim loại đó là Al
Đáp án: C
Bài 2: X là kim loại nhẹ, dẫn điện tốt , phản ứng mạnh với dung dịch HCl, tan trong dung dịch kiềm và giải phóng H2. X là:
A. Al
B. Mg
C. Cu
D. Fe
Lời giải
Đáp án A
Bài 3: Giải thích tại sao để điều chế Al người ta điện phân Al2O3 nóng chảy mà không điện phân AlCl3 nóng chảy là:
A. AlCl3 nóng chảy ở nhiệt độ cao hơn Al2O3.
B. AlCl3 không nóng chảy mà thăng hoa.
C. Điện phân AlCl3 tạo ra Cl2 rất độc.
D. Điện phân Al2O3 cho ra Al tinh khiết hơn.
Lời giải
Để điều chế Al người ta điện phân Al2O3 nóng chảy mà không điện phân AlCl3 nóng chảy vì AlCl3 không nóng chảy mà thăng hoa.
Đáp án: B
Bài 4: Trong công nghiệp người ta điều chế nhôm bằng cách
A. Khử Al2O3 bằng khí CO.
B. Khử Al2O3 bằng khí H2.
C. dùng Na tác dụng với dung dịch AlCl3.
D. điện phân nóng chảy Al2O3/criolit.
Lời giải
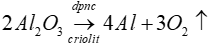
Đáp án: D
Bài 5: Nguyên liệu chính để sản xuất nhôm là:
A. criolit
B. quặng boxit
C. điện
D. than chì
Lời giải
Nguyên liệu chính để sản xuất nhôm là quặng boxit (Al2O3)
Đáp án: B
Bài 6: Khi điện phân Al2O3 nóng chảy người ta thêm criolit (Na3AlF6) với mục đích:
1. Làm hạ nhiệt độ nóng chảy của Al2O3.
2. Làm cho tính dẫn điện cao hơn.
3. Để thu được F2 ở anot thay vì là O2.
4. Tạo hỗn hợp nhẹ hơn Al để bảo vệ Al.
Các lý do nêu đúng là:
A. Chỉ có 1 B. 1 và 2
C. 1 và 3 D. 1, 2 và 4
Lời giải
Khi điện phân Al2O3 nóng chảy người ta thêm criolit (Na3AlF6) với mục đích:
1. Làm hạ nhiệt độ nóng chảy của Al2O3.
2. Làm cho tính dẫn điện cao hơn.
4. Tạo hỗn hợp nhẹ hơn Al để bảo vệ Al.
Đáp án: D
Bài 7: Nhôm là kim loại
A. dẫn điện và nhiệt tốt nhất trong số tất cả kim loại.
B. dẫn điện và nhiệt đều kém.
C. dẫn điện tốt nhưng dẫn nhiệt kém.
D. dẫn điện và nhiệt tốt nhưng kém hơn đồng.
Lời giải
Nhôm là kim loại dẫn điện và nhiệt tốt nhưng kém hơn đồng.
Thứ tự dẫn điện, dẫn nhiệt: Ag, Cu, Au, Al, Fe,…
Đáp án: D
Bài 8: Người ta có thể dát mỏng được nhôm thành thìa, xoong, chậu, giấy gói bánh kẹo là do nhôm có tính :
A. dẻo
B. dẫn điện
C. dẫn nhiệt
D. ánh kim
Lời giải
Người ta có thể dát mỏng được nhôm thành thìa, xoong, chậu, giấy gói bánh kẹo là do nhôm có tính dẻo
Đáp án: A
Bài 9: Một kim loại có khối lượng riêng là 2,7 g/cm3, nóng chảy ở 6600C. Kim loại đó là:
A. sắt
B. nhôm
C. đồng
D. bạc
Lời giải
Một kim loại có khối lượng riêng là 2,7 g/cm3, nóng chảy ở 6600C => kim loại là Al
Đáp án: B
Bài 10: Nhôm bền trong không khí là do
A. nhôm nhẹ, có nhiệt độ nóng chảy cao.
B. nhôm không tác dụng với nước.
C. nhôm không tác dụng với oxi.
D. có lớp nhôm oxit mỏng bảo vệ.
Lời giải
Nhôm bền trong không khí là do có lớp nhôm oxit mỏng bảo vệ.
Đáp án: D
Câu 11: Cho các kim loại: Cu, Zn, Fe, Mg, Ag, Al. Những kim loại nào không tác dụng với dd HNO3 đặc nguội?
A. Fe, Mg, Ag, Al.
B. Cu, Mg, Ag, Al.
C. Fe, Al.
D. Tất cả các kim loại
2 kim loại không phản ứng với dung dịch HNO3 đặc nguội là Fe và Al
Đáp án: C
Câu 12: Cho các phát biểu về phản ứng nhiệt nhôm, phát biểu đúng là
A. Nhôm chỉ có thể khử các oxit kim loại đứng sau H trong dãy hoạt động hóa học.
B. Nhôm chỉ có thể khử các oxit kim loại đứng sau Al trong dãy hoạt động hóa học.
C. Nhôm chỉ có thể khử các oxit kim loại đứng trước và đứng sau Al trong dãy hoạt động hóa học với điều kiện kim loại đó dễ bay hơi.
D. Nhôm khử tất cả các oxit kim loại.
Phát biểu đúng là: Nhôm chỉ có thể khử các oxit kim loại đứng sau Al trong dãy hoạt động hóa học.
Đáp án: B
Câu 13: Chỉ dùng 1 chất để phân biệt 3 kim loại sau: Al, Ba, Mg?
A. Dung dịch HCl
B. Nước
C. Dung dịch NaOH
D. Dung dịch H2SO4
Để phân biệt 3 kim loại Al, Ba, Mg ta dùng nước. Cho nước vào 3 mẫu kim loại, kim loại tốt trong nước và sủi bọt khí là Ba, 2 kim loại không tan trong nước là Al và Mg.
Ba + 2H2O → Ba(OH)2 + H2 ↑
- Lấy dung dịch Ba(OH)2 vừa thu được đổ vào mẫu 2 kim loại còn lại, kim loại nào tan, sủi bọt khí là Al, kim loại không có hiện tượng gì là Mg
2Al + Ba(OH)2 + 2H2O → Ba(AlO2)2 + 3H2 ↑
Đáp án: B
Câu 14: Chỉ dùng nước nhận biết được 3 chất rắn riêng biệt nào?
A. Al, Fe, Cu
B. Al, Na, Fe
C. Fe, Cu, Zn
D. Ag, Cu, Fe
Đáp án: B
Câu 15: Có 3 lọ không nhãn, mỗi lọ đựng một trong các chất rắn sau: Cu, Mg, Al. Thuốc thử để nhận biết 3 chất trên là:
A. Lần lượt NaOH và HCl.
B. Lần lượt là HCl và H2SO4 loãng.
C. Lần lượt NaOH và H2SO4 đặc nóng.
D. Tất a, b, c đều đúng.
Dể nhận biết 3 chất rắn trên thì ta dùng lần lượt dung dịch NaOH và HCl.
- Cho dung dịch NaOH vào 3 ống nghiệm đựng chất rắn, chất rắn nào tan và sủi bọt khí là Al, 2 ống không hiện tượng là Cu và Mg
PTHH: 2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2 ↑
- Cho dung dịch HCl vào 2 chất rắn còn lại, chất rắn nào tan và sủi bọt khí là Mg, chất rắn không hiện tượng là Cu
PTHH: Mg + 2HCl → MgCl2 + H2↑
Đáp án: A
Câu 16: Trong vỏ Trái Đất có nhiều quặng nhôm hơn sắt nhưng giá mỗi tấn nhôm cao hơn nhiều so với giá mỗi tấn sắt. Lí do vì:
A. Chuyển vận quặng nhôm đến nhà máy xử lí tốn kém hơn vận chuyển quặng sắt
B. Nhôm hoạt động mạnh hơn sắt nên để thu hồi nhôm từ quặng sẽ tốn kém hơn
C. Nhôm có nhiều công dụng hơn sắt nên nhà sản xuất có thể có lợi nhuận nhiều hơn
D. Quặng nhôm ở sâu trong lòng đất trong khi quặng sắt từng thấy ngay trên mặt đất
Nguyên liệu để sản xuất nhôm là quặng bôxit có thành phần chủ yếu là Al2O3. Sử dụng phương pháp điện phân hỗn hợp nóng chảy của nhôm oxit và criolit nên tốn kém hơn khi điều chế sắt
Đáp án: B
Câu 17: Trong các kim loại sau: Cu, Fe, Pb, Al người ta thường dùng kim loại nào để làm vật liệu dẫn điện hay dẫn nhiệt?
A. Chỉ có Cu
B. Cu và Al
C. Fe và Al
D. Chỉ có Al
Trong thực tế người ta thường sử dụng 2 kim loại để làm vật liệu dẫn điện và dẫn nhiệt là Cu và Al.
Đáp án: B
Câu 18: Kim loại nhôm có độ dẫn điện tốt hơn kim loại:
A. Cu, Ag
B. Ag
C. Fe, Cu
D. Fe
Kim loại dẫn điện tốt nhất là Ag sau đó đến Cu, Au, Al, Fe,..
Đáp án: D
Câu 19: Công thức hóa học của nhôm là:
A. Al.
B. Cu.
C. Fe.
D. Zn.
Đáp án: A
Câu 20: Tên gọi của Al2O3 và Al(OH)3 lần lượt là:
A. Nhôm oxit và nhôm (III) hidroxit.
B. Nhôm (III) oxit và nhôm hidroxit.
C. Nhôm oxit và nhôm hidroxit.
D. Nhôm (III) oxit và nhôm (III) hidroxit.
Al2O3: nhôm oxit
Al(OH)3: nhôm hiđroxit
Đáp án: C
Câu 21: Sản phẩm khi đốt cháy nhôm trong khí oxi (O2) là:
A. AlO.
B. Al2O3.
C. Al3O2.
D. Al2O2.
Đáp án: B
Câu 22: Cho phản ứng: Al + Cl2 ->…. Tổng hệ số tối giản của phương trình là:
A. 4
B. 3
C. 7
D. 9
Đáp án: C
Câu 23: Nhôm không tác dụng được với:
A. HCl.
B. H2SO4 loãng.
C. NaOH.
D. NaCl.
Al không phản ứng được với NaCl
Đáp án: D
Câu 24: Kim loại nào dưới đây tan được trong dung dịch kiềm :
A. Mg
B. Al
C. Fe
D. Ag
Do oxit và hidroxit của nhôm có tính lưỡng tính do đó nhôm có thể tan trong dd kiềm
Đáp án: B
Câu 25: Hi đroxit nào sau đây vừa tác dụng được với dung dịch ba zơ vừa tác dụng được với dung dịch axit?
A. Fe(OH)2
B. Fe(OH)3
C. Al(OH)3
D. Mg(OH)2
Hi đroxit vừa tác dụng được với dung dịch ba zơ vừa tác dụng được với dung dịch axit Al(OH)3
Đáp án: C
Câu 26: Quặng nào sau đây chứa thành phần chính là Al2O3:
A. Boxit.
B. Pirit.
C. Đolomit.
D. Apatit.
Thành phần chính của quặng boxit là Al2O3
Thành phần chính của quặng Pirit là FeS2
Thành phần chính của quặng Đolomit là: MgCO3. CaCO3
Thành phần chính của quặng Apatit là: Ca3(PO4)2
Đáp án: A
Câu 27: Nguyên liệu sản xuất nhôm là quặng :
A. Hematit
B. Manhetit
C. Boxit
D. Pirit
Quặng Boxit: Al2O3.nH2O
Quặng Pirit(Pirit sắt): FeS2
Quặng Hematit: Fe2O3
Quặng Manhetit: Fe3O4
Đáp án: C
Câu 28: Nguyên liệu để sản xuất nhôm là quặng bôxit. Thành phần chính của quặng bôxit là:
A. Fe2O3
B. Al2O3
C. NaAlO2
D. AlCl3
Thành phần chính của quặng bôxit là Al2O3
Đáp án: B
Câu 29: Hợp chất nào của nhôm dưới đây tan nhiều được trong nước ?
A. Al2O3
B. Al(OH)3
C. AlCl3
D. AlPO4
AlCl3 là muối dễ tan trong nước
Đáp án: C
Câu 30: Hợp chất nào dưới đây của nhôm tan nhiều trong nước?
A. AlCl3
B. Al2O3
C. Al(OH)3
D. AlPO4
Hợp chất dưới đây của nhôm tan nhiều trong nước: AlCl3
Đáp án: A
Câu 31: Không được dùng chậu nhôm để chứa nước vôi trong , do
A. nhôm tác dụng được với dung dịch axit.
B. nhôm tác dụng được với dung dịch bazơ.
C. nhôm đẩy được kim loại yếu hơn nó ra khỏi dung dịch muối.
D. nhôm là kim loại hoạt động hóa học mạnh
Al + Ca(OH)2 + H2O → H2 + Ca(AlO2)2
Đáp án: B
Câu 32: Kim loại vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch KOH là:
A. Fe
B. Cu
C. Al
D. Mg
Kim loại vừa tác dụng với dung dịch HCl vừa tác dụng với dung dịch KOH là: Al
Đáp án: C
Câu 33: Kim loại nào sau đây có tính chất hóa học lưỡng tính?
A. Fe
B. Na
C. Al
D. Ba
Kim loại có tính chất hóa học lưỡng tính Al
Đáp án: C
Trắc nghiệm Bài 19: Sắt
Bài 1: Kim loại Fe không phản ứng với chất nào sau đây trong dung dịch?
A. FeCl3.
B. CuSO4.
C. AgNO3.
D. MgCl2.
Lời giải
Kim loại Fe không phản ứng được với dung dịch MgCl2 vì Mg mạnh hơn Fe trong dãy hoạt động hóa học
Đáp án: D
Bài 2: Một tấm kim loại bằng vàng bị bám một lớp kim loại sắt ở bề mặt, để làm sạch tấm kim loại vàng ta dùng:
A. Dung dịch CuSO4 dư
B. Dung dịch FeSO4 dư
C. Dung dịch ZnSO4 dư
D. Dung dịch H2SO4 loãng dư
Lời giải
Fe có thể đẩy Cu khỏi muối CuSO4 nhưng lại tạo thành kim loại Cu bám lên tấm kim loại vàng => loại A
CuSO4 + Fe → Cu + FeSO4
Fe đứng trước H2 trong dãy điện hóa do đó sẽ tan trong H2SO4 loãng tạo thành dd và không có thêm kim loại bám vào vàng
Fe + H2SO4 → FeSO4 + H2
Đáp án: D
Bài 3: Ở nhiệt độ cao sắt phản ứng với lưu huỳnh cho:
A. FeS2
B. FeS
C. Fe2S2
D. FeS hoặc FeS2
Lời giải
Khi cho sắt phản ứng với lưu huỳnh ở nhiệt độ cao tạo muối sắt (II) có màu đen
Fe + S 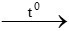 FeS
FeS
Đáp án: B
Bài 4: Kim loại Fe tác dụng được với bao nhiêu chất trong dãy sau: HCl, H2SO4 đặc nguội, dd NaOH, dd Al(NO3)3; khí Cl2
A. 2 B. 3
C. 4 D. 5
Lời giải
Kim loại Fe tác dụng được với: HCl, khí Cl2
Đáp án: A
Bài 5: Thí nghiệm không xảy ra phản ứng là
A. cho sắt vào dung dịch HCl.
B. cho sắt vào dung dịch H2SO4 loãng.
C. cho sắt vào dung dịch HNO3 loãng.
D. cho sắt vào dung dịch H2SO4 đặc nguội.
Lời giải
Thí nghiệm không xảy ra phản ứng là: cho sắt vào dung dịch H2SO4 đặc nguội.
Đáp án: D
Bài 6: Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat. Hiện tượng xảy ra là
A. sắt bị hòa tan một phần, bạc được giải phóng.
B. bạc được giải phóng nhưng sắt không biến đổi.
C. không có chất nào sinh ra, chỉ có sắt bị hòa tan.
D. không xảy ra hiện tượng gì.
Lời giải
Ngâm một cây đinh sắt sạch vào dung dịch bạc nitrat xảy ra phản ứng:
Fe + 2AgNO3 → Fe(NO3)2 + 2Ag↓
=> Hiện tượng xảy ra là: sắt bị hòa tan một phần, bạc được giải phóng.
Đáp án: A
Bài 7: Tính chất vật lí nào sau đây của sắt khác với các kim loại khác?
A. Dẫn nhiệt
B. Tính nhiễm từ
C. Dẫn điện
D. Ánh kim
Lời giải
Tính chất vật lí của sắt khác với các kim loại khác là: tính nhiễm từ
Đáp án: B
Bài 8: Phương trình hóa học nào sau đây không đúng?
A. Fe + S 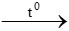 FeS
FeS
B. 4Fe + 3O2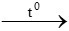 2Fe2O3
2Fe2O3
C. 2Fe + 3Cl2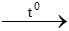 2FeCl3
2FeCl3
D. Fe + 2HCl → FeCl2 + H2
Lời giải
Phương trình không đúng là: 4Fe + 3O2 2Fe2O3
2Fe2O3
Sắt tác dụng với oxi tạo oxit sắt từ: 3Fe + 2O2 Fe3O4
Fe3O4
Đáp án: B
Bài 9: Sắt vừa thể hiện hóa trị II, vừa thể hiện hóa trị III khi tác dụng với
A. Cl2.
B. dung dịch HCl.
C. O2.
D. S.
Lời giải
Sắt vừa thể hiện hóa trị II, vừa thể hiện hóa trị III khi tác dụng với O2
PTHH: 3Fe + 2O2 Fe3O4
Fe3O4
Đáp án: C
Bài 10: Đốt cháy 1 mol sắt trong oxi, thu được 1 mol sắt oxit. Công thức oxit sắt này là:
A. FeO
B. Fe2O3
C. Fe3O4
D. Fe3O2
Lời giải
1mol Fe → 1 mol oxit sắt → CT có chứa 1 nguyên tử Fe
→ CT : FeO
Đáp án: A
Câu 11: Cho dây sắt quấn hình lò xo (đã được nung nóng đỏ) vào lọ đựng khí clo. Hiện tượng xảy ra là:
A. Sắt cháy tạo thành khói trắng dày đặt bám vào thành bình
B. Không thấy hiện tượng phản ứng
C. Sắt cháy sáng tạo thành khói màu nâu đỏ
D. Sắt cháy sáng tạo thành khói màu đen
Sắt cháy trong clo tạo thành muối FeCl3 có màu nâu đỏ
2Fe + 3Cl2 → 2FeCl3 (nâu đỏ)
Đáp án: C
Câu 12: Thí nghiệm tạo ra muối sắt (III) sunfat là
A. sắt phản ứng với dung dịch H2SO4 đặc nóng.
B. sắt phản ứng với dung dịch H2SO4 loãng
C. sắt phản ứng với dung dịch CuSO4.
D. sắt phản ứng với dung dịch Al2(SO4)3
Đáp án: A
Câu 13: Để chuyển FeCl3 thành Fe(OH)3, người ta dùng dung dịch:
A. HCl
B. H2SO4
C. NaOH
D. AgNO3
Từ muối tạo thành bazo ta cần cho muối tác dụng với bazo tan để tạo thành muối mới và bazo mới hoặc cho tác dụng với muối mà sản phẩm muối mới kém bền chuyển thành hidroxit
FeCl3 + 3NaOH → Fe(OH)3 + 3NaCl
Đáp án: C
Câu 14: Nung nóng Fe(OH)3 đến khối lượng không thay đổi, chất rắn thu được sau phản ứng là:
A. Fe3O4
B. Fe2O3
C. FeO
D. Fe
Đáp án: B
Câu 15: Kim loại nào sau đây đẩy được Fe ra khỏi dung dịch muối FeCl2 ?
A. Mg
B. Cu
C. Ag
D. Ni
Kim loại đẩy được Fe ra khỏi dung dịch muối FeCl2 là Mg:
Mg + FeCl2 → Fe + MgCl2
Đáp án: A
Câu 16: Nhúng 1 lá Fe nhỏ vào dung dịch dư chứa một trong những chất sau: FeCl3, AlCl3, NaCl, AgNO3, HNO3 loãng, H2SO4 đặc, nóng. Số trường hợp phản ứng tạo muối Fe(II) là:
A. 1
B. 2
C. 3
D. 4
Số trường hợp phản ứng tạo muối Fe(II) là : FeCl3
Đáp án: A
Câu 17: Hòa tan hỗn hợp gồm Fe và Cu vào dung dịch HCl vừa đủ. Các chất thu được sau phản ứng là
A. FeCl2 và H2.
B. FeCl2, Cu và H2.
C. Cu và khí H2.
D. FeCl2 và Cu.
Vì Cu không phản ứng với dung dịch HCl => sau phản ứng còn Cu
Fe phản ứng với HCl: Fe + 2HCl → FeCl2 + H2
Vậy các chất thu được là: FeCl2, Cu và H2
Đáp án: B
Câu 18: Hoà tan hỗn hợp gồm Fe và Cu vào dung dịch HCl (vừa đủ). Các sản phẩm thu được sau phản ứng là
A. FeCl2 và khí H2
B. FeCl2, Cu và khí H2
C. Cu và khí H2
D. FeCl2 và Cu
Khi cho Fe và Cu vào dd HCl thì chỉ có Fe phản ứng với HCl do Fe đứng trước H2 do đó có phản ứng tan ra tạo khí còn Cu đứng sau H2 trong dãy điện hóa nên không có phản ứng
Fe + 2HCl → FeCl2 + H2
Đáp án: B
Câu 19: Hòa tan 8,4 gam Fe bằng dung dịch HCl dư, thu được V lít khí H2 (đktc). Giá trị của V là
A. 2,24
B. 4,48
C. 3,36
D. 1,12
Đáp án: C
Câu 20: Để khử hoàn toàn 8 gam Fe2O3 bằng bột nhôm ở nhiệt độ cao, trong điều kiện không có không khí thì khối lượng bột nhôm cần dùng là
A. 2,7 gam.
B. 4,05 gam.
C. 5,40 gam.
D. 6,75 gam.
Đáp án: A
Câu 21: Hòa tan hết 2,8 gam kim loại Fe vào cốc đựng 60 gam dung dịch HCl 7,3% thu được khí H2 và dung dịch X. Nồng độ phần trăm của muối sắt (II) clorua trong dung dịch sau phản ứng là
A. 9,11%.
B. 10,03%.
C. 10,13%.
D. 12,13%.
Đáp án: C
Câu 22: Có thể phân biệt Fe và Al bằng dung dịch:
A. NaOH.
B. HCl.
C. H2SO4 (loãng).
D. CuSO4.
Al tác dụng được với dd NaOH còn Fe thì không => dùng dd NaOH để phân biệt
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2↑
Đáp án: A
Trắc nghiệm Bài 20: Hợp kim sắt: Gang, thép
Bài 1: Gang là hợp kim của sắt với cacbon và một lượng nhỏ các nguyên tố khác như: Si, Mn, S,… trong đó hàm lượng cacbon chiếm:
A. Từ 2% đến 6%
B. Dưới 2%
C. Từ 2% đến 5%
D. Trên 6%
Lời giải
Từ 0,01 – 2% khối lượng C là thép và từ 2 – 5% khối lượng C là gang
Đáp án: C
Bài 2: Trong sản xuất gang, người ta dùng một loại than vừa có vai trò là nhiêu liệu cung cấp nhiệt cho lò cao, vừa tạo ra chất khử CO, vừa tạo thành phần từ 2-5% C trong gang. Loại than đó là:
A. than non
B. than đá
C. than gỗ
D. than cốc
Lời giải
Trong sản xuất gang, người ta dùng một loại than vừa có vai trò là nhiêu liệu cung cấp nhiệt cho lò cao, vừa tạo ra chất khử CO, vừa tạo thành phần từ 2-5% C trong gang. Loại than đó là than cốc.
Đáp án: D
Bài 3: Nguyên tắc luyện thép từ gang là
A. tăng thêm hàm lượng cacbon trong gang để thu được thép.
B. dùng chất khử CO khử oxit sắt thành sắt ở nhiệt độ cao.
C. dùng CaO hoặc CaCO3 để khử tạp chất Si, P, S, Mn, … trong gang để thu được thép.
D. dùng O2 oxi hóa các tạp chất Si, P, S, Mn, … trong gang để thu được thép.
Lời giải
Nguyên tắc luyện thép từ gang là : làm giảm hàm lượng các tạp chất (C, S, Si, Mn,..) có trong gang bằng cách oxi hoá các tạp chất đó thành oxit rồi biến thành xỉ và tách ra khỏi thép
Đáp án: D
Bài 4: Quá trình sản xuất thép từ gang trắng, người ta cho thêm oxi của không khí vào. Vai trò của oxi là
A. oxi hóa tạp chất
B. oxi hóa cacbon
C. oxi hóa một phần Fe
D. cả A, B, C đều xảy ra
Lời giải
Vai trò của oxi là để oxi hóa các tạp chất (S, Si, Mn), C và oxi hóa 1 phần Fe để tạo thành xỉ và tách ra khỏi gang
Đáp án: D
Bài 5: Một loại quặng chứa sắt trong tự nhiên đã được loại bỏ tạp chất. Hòa tan quặng này trong dung dịch HNO3 thấy có khí màu nâu bay ra, dung dịch thu được cho tác dụng với dung dịch BaCl2 thấy có kết tủa (không tan trong axit mạnh). Loại quặng đó là
A. xiđerit.
B. hematit.
C. manhetit.
D. pirit sắt.
Lời giải
Kết tủa không tan trong axit mạnh là BaSO4 => trong quặng sắt có chứa nguyên tố S
=> quặng đó là pirit sắt
Đáp án: D
Bài 6: Cho các phát biểu sau:
(1) Gang là hợp kim của sắt chứa từ 1 - 3,1% là các nguyên tố C, Si, Mn, S và còn lại là Fe.
(2) Thép là hợp kim của sắt trong đó hàm lượng cacbon chiếm 0,01 - 2%.
(3) Thép được sử dụng trong ngành chế tạo máy và máy bay.
(4) Để luyện thép, người ta oxi hóa gang nóng chảy để loại phần lớn các nguyên tố C, P, Si, Mn, S.
(5) Thép đặc biệt là thép ngoài những nguyên tố có sẵn như thép thường còn thêm các nguyên tố được đưa vào là Cr, Ni, Mo, W, Mn, …
Số phát biểu đúng là
A. 4 B. 2
C. 5 D. 3
Lời giải
(1) sai vì trong gang hàm lượng C chiếm 2 – 5% nên các nguyên tố C, Si, Mn, S chiếm ít nhất 2%
(3) sai vì thành phần của thép có chứa 18% W và 5% Cr nên rất cứng, ứng dụng để chế tạo máy cắt gọt, phay,… không dùng để chế tạo máy bay.
Đáp án: D
Bài 7: Quặng nào sau đây có hàm lượng Fe cao nhất?
A. Hematit đỏ (Fe2O3).
B. Pirit (FeS2).
C. Manhetit (Fe3O4).
D. Xiđerit (FeCO3).
Lời giải
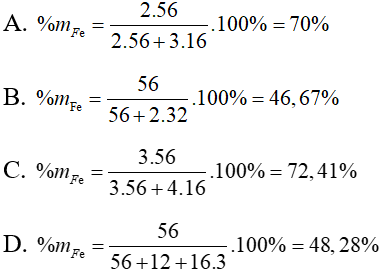
Vậy quặng có hàm lượng Fe cao nhất là Fe3O4
Đáp án: C
Bài 8: Quặng hemantit có công thức hóa học là:
A. Fe3O4
B. Fe2O3
C. FeO
D. Al2O3
Lời giải
Quặng hemantit có công thức hóa học là: Fe2O3
Đáp án: B
Bài 9: Nung một mẫu thép thường có khối lượng 10 gam trong O2 dư thu được 0,1568 lít khí CO2 (đktc). Thành phần phần trăm theo khối lượng của cacbon trong mẫu thép đó là
A. 0,82%.
B. 0,84%.
C. 0,85%.
D. 0,86%.
Lời giải
Bảo toàn nguyên tố C: nC (trong thép) = nCO2 = 0,007 mol
%C = ![]() = 0,84%
= 0,84%
Đáp án: B
Bài 10: Một loại quặng chứa 82% Fe2O3. Thành phần phần trăm của Fe trong quặng theo khối lượng là:
A. 57,4%
B. 57,0 %
C. 54,7%
D. 56,4 %
Lời giải
Giả sử có 160g quặng
=> mFe2O3có trong 160g quặng = 160 . 0,82 = 131,2g
=> nFe2O3 = 131,2 : 160 = 0,82 mol
=> nFecótrongquặng = 2 nFe2O3 = 1,64 mol
=> mFe có trong quặng = 1,64 . 56 = 91,84g
=> %Fe trong quặng = (mFe : m quặng) . 100% = (91,84 : 160) . 100% = 57,4%
Đáp án: A
Bài 11: Thép là hợp kim Fe – C và một số nguyên tố khác, trong đó C chiếm khoảng
A. trên 2%
B. 5% đến 10%
C. 0,01% đến 2%
D. Không chứa C
Lời giải
Thép là hợp kim Fe – C và một số nguyên tố khác, trong đó C chiếm khoảng 0,01% đến 2%
Đáp án: C
Bài 12: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác trong đó hàm lượng cacbon chiếm:
A. Trên 2%
B. Từ 0,01 - 2%
C. Từ 2% đến 5%
D. Trên 5%
Lời giải
Đáp án B
Bài 13: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác trong đó hàm lượng cacbon chiếm:
A. Dưới 2%
B. Trên 2%
C. Từ 2-5%
D. Trên 5%
Lời giải
Thép là hợp kim của sắt với cacbon và một số nguyên tố khác trong đó hàm lượng cacbon chiếm: Dưới 2%
Đáp án: A
Bài 14: Gang và thép là hợp kim của Fe. Tìm phát biểu đúng.
A. Gang là hợp kim Fe – C (5% đến 10%).
B. Nguyên tắc sản suất gang là khử Fe trong oxit bằng CO, H2 hay Al ở nhiệt độ cao.
C. Nguyên tắc sản xuất thép là oxi hoá các tạp chất trong gang (C, Si, Mn, S, P) thành oxit nhằm giảm hàm lượng của chúng.
D. Thép là hợp kim Fe – C (2% đến 5%).
Lời giải
A sai vì: Gang là hợp kim của sắt với cacbon, trong đó hàm lượng cacbon chiếm từ 2-5%
B sai vì: Nguyên tắc sản xuất gang: dùng CO khử oxit sắt ở nhiệt độ cao trong lò luyện kim.
D sai vì: Thép là hợp kim của sắt với cacbon và một số nguyên tố khác (C, Mn, S, Si,…), trong đó hàm lượng cacbon chiếm dưới 2%.
Đáp án: C
Bài 15: A là quặng hematit chứa 60% Fe2O3. B là quặng manhetit chứa 69,6% Fe3O4. Trộn m1 tấn A với m2 tấn B thu được 1 tấn quặng C. Từ 1 tấn quặng C điều chế được 0,5 tấn gang chứa 4% cacbon. Tỉ lệ m1 : m2 là
A. 5:2
B. 4:3
C. 3:4
D. 2:5
Lời giải
0,5 tấn gang chứa 4% C => 0,5 tấn gang chứa 96% Fe hay mFe = 0,48 tấn
Trong gang: nFe = 3/350
Bảo toàn nguyên tố Fe: 2.nFe2O3 + 3.nFe3O4 = 3/350
![]() (1)
(1)
+) Trộn m1 tấn A với m2 tấn B thu được 1 tấn quặng C
=> m1 + m2 = 1 (2)
Từ (1) và (2) => m1 = 2/7; m2 = 5/7 => m1 : m2 = 2 : 5
Đáp án: D
Câu 16: Để luyện được 800 tấn gang có hàm lượng sắt 95% cần dùng x tấn quặng manhetit chứa 80% Fe3O4 (còn lại là tạp chất không chứa sắt). Biết rằng lượng sắt hao hụt trong quá trình sản xuất là 1%. Giá trị của x là
A. 1235.
B. 1325.
C. 1324.
D. 1650.
Đáp án: B
Câu 17: Khử một lượng quặng hemantit chứa 80% (Fe2O3) thu được 1,68 tấn sắt, khối lượng quặng cần lấy là:
A. 2,4 tấn
B. 2,6 tấn
C. 2,8 tấn
D. 3,0 tấn
Đáp án: D
Trắc nghiệm Bài 21:Sự ăn mòn kim loại và bảo vệ kim loại không bị ăn mòn
Bài 1: Một số hoá chất được để trên ngăn tủ có khung bằng kim loại. Sau một thời gian, người ta thấy khung kim loại bị gỉ. Hoá chất nào dưới đây có khả năng gây ra hiện tượng trên?
A. Ancol etylic.
B. Nước cất.
C. Dầu hoả.
D. Axit clohidric.
Lời giải
Một số hoá chất được để trên ngăn tủ có khung bằng kim loại. Sau một thời gian, người ta thấy khung kim loại bị gỉ. Hóa chất có khả năng gây ra ăn mòn kim loại là axit HCl vì HCl có khả năng phản ứng với kim loại.
Đáp án: D
Bài 2: Sự phá huỷ kim loại hay hợp kim do kim loại tác dụng trực tiếp với các chất oxi hoá trong môi trường được gọi là :
A. sự khử kim loại.
B. sự tác dụng của kim loại với nước.
C. sự ăn mòn hóa học.
D. sự ăn mòn điện hoá học.
Lời giải
Sự phá huỷ kim loại hay hợp kim do kim loại tác dụng trực tiếp với các chất oxi hoá trong môi trường được gọi là sự ăn mòn hóa học
Đáp án: C
Bài 3: “Ăn mòn kim loại” là sự phá huỷ kim loại do:
A. Tác dụng hoá học của các chất trong môi trường xung quanh.
B. Kim loại phản ứng hoá học với chất khí hoặc hơi nước ở nhiệt độ cao.
C. Kim loại tác dụng với dung dịch chất điện ly tạo nên dòng diện.
D. Tác động cơ học.
Lời giải
“ăn mòn kim loại” là sự phá huỷ kim loại do tác dụng hoá học của các chất trong môi trường xung quanh.
Đáp án: A
Bài 4: Ăn mòn kim loại do ma sát được gọi là:
A. Ăn mòn vật lý.
B. Ăn mòn hóa học.
C. Ăn mòn sinh học.
D. Ăn mòn toán học.
Lời giải
Ăn mòn kim loại do ma sát không làm thay đổi tính chất hóa học của kim loại => là ăn mòn vật lí
Đáp án: A
Bài 5: Chất nào sau đây trong khí quyển không gây ra sự ăn mòn kim loại
A. O2.
B. CO2.
C. H2O.
D. N2.
Lời giải
Chất trong khí quyển không gây ra sự ăn mòn kim loại là N2 vì N2 là khí trơ ở điều kiện thường
Đáp án: D
Bài 6: Các dụng cụ như: cuốc, xẻng, dao, búa,… khi lao động xong con người ta phải lau, chùi (vệ sinh) các thiết bị này. Việc làm này nhằm mục đích
A. thể hiện tính cẩn thận của người lao động.
B. làm các thiết bị không bị gỉ.
C. để cho mau bén.
D. để sau này bán lại không bị lỗ.
Lời giải
Các dụng cụ như: cuốc, xẻng, dao, búa,… khi lao động xong con người ta phải lau, chùi (vệ sinh) các thiết bị này. Việc làm này nhằm mục đích làm các thiết bị không bị gỉ.
Đáp án: B
Bài 7: Hãy cho biết kết luận nào sau đây đúng?
A. Ăn mòn hóa học là một quá trình phản ứng trong đó kim loại là chất bị ăn mòn.
B. Ăn mòn hóa học xảy ra tại bề mặt kim loại.
C. Ăn mòn hóa học càng mạnh khi nồng độ chất ăn mòn càng lớn và nhiệt độ càng cao.
D. Cả A, B, C đều đúng
Lời giải
Kết luận đúng là:
- Ăn mòn hóa học là một quá trình phản ứng trong đó kim loại là chất bị ăn mòn
- Ăn mòn hóa học xảy ra tại bề mặt kim loại
- Ăn mòn hóa học càng mạnh khi nồng độ chất ăn mòn càng lớn và nhiệt độ càng cao
Đáp án: D
Bài 8: Kim loại nào sau đây có khả năng tự tạo ra màng oxit cứng bảo vệ khi để ngoài không khí?
A. Al
B. Fe
C. Ca
D. Na
Lời giải
Kim loại có khả năng tự tạo ra màng oxit cứng bảo vệ khi để ngoài không khí là Al. Al trong không khí thường có lớp màng oxit Al2O3 bảo vệ.
Đáp án: A
Câu 9: Natri là kim loại hoạt động mạnh, bị ăn mòn rất nhanh. Để natri không bị ăn mòn người ta ngâm natri trong:
A. Nước
B. Dầu hỏa
C. Rượu etylic
D. Dung dịch H2SO4 loãng
Đáp án: B
Câu 10: Nhôm không bị ăn mòn trong môi trường nào?
A. Dung dịch axit
B. Dung dịch kiềm
C. Dung dịch muối
D. Không khí
Câu 11: Yếu tố nào sau đây không ảnh hưởng đến sự ăn mòn kim loại?
A. Môi trường
B. Không khí
C. Áp suất
D. Nhiệt độ
Đáp án: C
Câu 12: Đồ vật làm bằng kim loại không bị gỉ nếu
A. Dùng xong rửa sạch lau khô
B. Để ở nơi có nhiệt độ cao
C. Ngâm trong nước lâu ngày
D. Bảo quản trong dung dịch nước muối
Đáp án: A
Câu 13: Chất nào sau đây trong khí quyển không gây ra sự ăn mòn kim loại?
A. O2
B. CO2
B. H2O
D. N2
Đáp án: D
Câu 14: Các dụng cụ như: Cuốc, xẻng, dao, búa,... khi lao động xong con người ta phải lau chùi, vệ sinh các thiết bị này. Việc làm này nhằm mục đích:
A. Thể hiện tính cẩn thận của người lao động
B. Làm các thiết bị không bị gỉ
C. Để cho mau bén
D. Để sau này bán lại không bị lỗ
Đáp án: B
Câu 15: Chọn đáp án đúng?
A. Ăn mòn hóa học là một quá trình phản ứng trong đó kim loại là chất bị ăn mòn
B. Ăn mòn hóa học xảy ra tại bề mặt kim loại
C. Ăn mòn hóa học càng mạnh khi nồng độ chất ăn mòn càng lớn và nhiệt độ càng cao
D. Cả ba đá án đều đúng
Đáp án: D
Câu 16: Chọn câu trả lời đúng?
Kim loại tự tạo ra màng oxit cứng bảo vệ khi để ra ngoài không khí là:
A. Nhôm
B. Sẳt
C. Canxi
D. Natri
Đáp án: A
Câu 17: Khi để một số hóa chất để trên ngăn tủ có khung bằng kim loại, sau một thời gian thì thấy khung kim loại bị gỉ. Hóa chất đó có thể là chất nào sau đây?
A. Ancol etylic
B. Nước cất
C. Dầu hỏa
D. Axit clohidric
Đáp án: D
Câu 18: Ăn mòn kim loại do ma sát được gọi là:
A. Ăn mòn vât lí
B. Ăn mòn hóa học
C. Ăn mòn sinh học
D. Ăn mòn toán học
Đáp án: A
Trắc nghiệm Bài 22: Luyện tập chương 2: Kim loại
Câu 1: Trong các kim loại sau đây, kim loại dẫn điện tốt nhất là:
A. Nhôm (Al)
B. Bạc (Ag)
C. Đồng (Cu)
D. Magie (Mg)
Đáp án: B
Câu 2: Trong các kim loại sau đây, kim loại dẻo nhất là:
A. Đồng (Cu)
B. Chì (Pb)
C. Bạc (Ag)
D. Vàng (Au)
Đáp án: D
Câu 3: Để làm sạch mẫu chì bị lẫn kẽm, ngươì ta ngâm mẫu chì này vào một lượng dư dung dịch:
A. ZnSO4
B. Pb(NO3)2
C. CuCl2
D. Na2CO3
Đáp án: B
Zn + Pb(NO3)2 → Zn(NO3)2 + Pb.
Câu 4: Dung dịch FeCl2 có lẫn tạp chất là CuCl2 có thể dùng kim loại nào sau đây để làm sạch dung dịch FeCl2 trên:
A. Zn
B. Fe
C. Mg
D. Ag
Đáp án: B
Fe + CuCl2 → FeCl2 + Cu
Câu 5: Kim loại vừa tác dụng với dd HCl vừa tác dụng được với dung dịch KOH:
A. Fe, Al
B. Ag, Zn
C. Al, Cu
D. Al, Zn
Đáp án: D
Câu 6: Các kim loại tác dụng được với nước ở nhiệt độ thường tạo thành dung dịch kiềm và giải phóng khí hiđro:
A. K, Ca
B. Zn, Ag
C. Mg, Ag
D. Cu, Ba
Đáp án: A
Câu 7: Khi thả một cây đinh sắt sạch vào dung dịch CuSO4 loãng, có hiện tượng sau:
A. Sủi bọt khí, màu xanh của dung dịch nhạt dần.
B. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch đậm dần.
C. Có một lớp đồng màu đỏ phủ lên đinh sắt, dung dịch không đổi màu.
D. Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Đáp án: D
Fe + CuSO4 → FeSO4 + Cu
Hiện tượng: Có một lớp đồng màu đỏ phủ lên đinh sắt, màu xanh của dung dịch nhạt dần
Câu 8: Hoà tan hết 2,3g Na kim loại vào 97,8g nước thu được dung dịch có nồng độ:
A. 2,4%.
B. 4,0%.
C. 23,0%.
D. 5,8%.
Đáp án: B
Câu 9: Cho 4,6 g một kim loại M (hoá trị I) phản ứng với khí clo tạo thành 11,7g muối. M là kim loại nào sau đây:
A. Li
B. K
C. Na
D. Ag
Đáp án: C
2M + Cl2 → 2MCl
Bảo toàn khối lượng có :
mclo = 11,7 – 4,6 = 7,1 gam → nclo = 7,1 :71 = 0,1 mol
Theo PTHH có nM = 2.nclo = 0,2 mol → MM = 4,6 : 0,2 = 23 (g/mol).
Vậy kim loại cần tìm là Na.
Câu 10: Nhúng một lá sắt vào dung dịch đồng sunfat sau một thời gian lấy lá sắt ra khỏi dung dịch cân lại thấy nặng hơn ban đầu 0,2g. Khối lượng đồng bám vào lá sắt là:
A. 0,2g
B. 1,6g
C. 3,2g
D. 6,4g
Đáp án: B
Khối lượng lá sắt tăng = mCu sinh ra – mFe phản ứng → 64x – 56x = 0,2 → x = 0,025 mol
mCu sinh ra = 64.0,025 = 1,6 gam.
Câu 11: Hoà tan 9 g hợp kim nhôm – magiê vào dung dịch H2SO4 dư thu được 10,08 lít khí H2 (đktc). Thành phần % khối lượng của Al và Mg trong hợp kim lần lượt là:
A. 50% và 50%
B. 40% và 60%
C. 60% và 40%
D. 39% và 61%
Đáp án: C
Gọi số mol của Al và Mg là x và y mol
mhợp kim = 9 gam → 27x + 24y = 9 (1)
PTHH:
Theo bài ra có nH2 = 0,45 mol → 1,5 x + y = 0,45 (2)
Từ (1) và (2) có: x = 0,2 và y = 0,15 mol
Câu 12: Cho 22,4g Fe tác dụng vừa đủ với 200g dung dịch H2SO4 loãng. Nồng độ % của dung dịch axít đã phản ứng là:
A. 32%
B. 54%
C. 19,6%
D. 18,5%
Đáp án: C
Số mol Fe = 22,4 : 56 = 0,4 mol
Câu 13: Dãy kim loại được sắp xếp theo chiều hoạt động hóa học tăng dần:
A. K , Al , Mg , Cu , Fe
B. Cu , Fe , Mg , Al , K
C. Cu , Fe , Al , Mg , K
D. K , Cu , Al , Mg , Fe
Đáp án: C
Câu 14: Có 3 lọ đựng 3 chất riêng biệt Mg, Al, Al2O3 để nhận biết chất rắn trong từng lọ chỉ dùng 1 thuốc thử là:
A. Nước
B. Dung dịch HCl
C. Dung dịch KOH
D. Dung dịch H2SO4 loãng.
Đáp án: C
Sử dụng dung dịch KOH
+ Nếu chất rắn tan và có khí thoát ra → Al
2Al + 2H2O + 2KOH → 2KAlO2 + 3H2
+ Nếu chất rắn tan, không có khí thoát ra → Al2O3
Al2O3 + 2KOH → 2KAlO2 + H2O
+ Nếu chất rắn không tan là Mg.
Câu 15: Cho một lá Fe vào dung dịch CuSO4, sau một thời gian lấy lá sắt ra, khối lượng dung dịch thay đổi như thế nào?
A. Tăng so với ban đầu
B. Giảm so với ban đầu
C. Không tăng, không giảm so với ban đầu
D. Tăng gấp đôi so với ban đầu
Đáp án: B