Với tóm tắt lý thuyết Hóa học lớp 9 Các loại hợp chất vô cơ hay, chi tiết cùng với 437 câu hỏi trắc nghiệm chọn lọc có đáp án giúp học sinh nắm vững kiến thức trọng tâm, ôn luyện để học tốt môn Hóa học lớp 9.
Hóa học 9 Chương 1: Các loại hợp chất vô cơ
Trắc nghiệm Bài 1: Tính chất hóa học của oxit. Khái quát về sự phân loại oxit
Bài 1: Oxit nào sau đây phản ứng với nước ở điều kiện thường?
A. Al2O3
B. CuO
C. Na2O
D. MgO
Lời giải
Các oxit bazơ của kim loại kiềm và kiềm thổ (trừ BeO, MgO) tác dụng được với nước ở điều kiện thường.
Na2O + H2O → 2NaOH
Đáp án: C
Bài 2: Trong những dãy oxit sau, dãy gồm những chất tác dụng được với nước để tạo ra dung dịch kiềm là:
A. CuO, CaO, Na2O, K2O
B. CaO, Na2O, K2O, BaO
C. CuO, Na2O, BaO, Fe2O3
D. PbO, ZnO, MgO, Fe2O3
Lời giải
Ghi nhớ: các oxit của kim loại kiềm và kiềm thổ (trừ BeO, MgO) tác dụng được với nước ở điều kiện thường tạo ra dung dịch bazo
A. loại CuO
B. thỏa mãn
C. loại CuO; Fe2O3
D. loại tất cả
Đáp án cần chọn là: B
Bài 3: Dãy các chất nào tác dụng được với nước?
A. SO2, CO2, Na2O, CaO
B. NO,CO, Na2O, CaO
C. SO2, CO2, FeO, CaO
D. NO, CO, Na2O, FeO
Lời giải
A đúng
B sai do NO,CO là không tác dụng với nước
C sai do FeO không tác dụng với nước
D sai do NO, CO, FeO không tác dụng với nước
Đáp án: A
Bài 4: Khí cacbon monooxit (CO) có lẫn tạp chất là khí cacbon đioxit (CO2) và lưu huỳnh đioxit (SO2). Dùng dung dịch nào sau đây để tách được những tạp chất ra khỏi CO?
A. Dung dịch HCl
B. Dung dịch Ca(OH)2
C. Dung dịch H2SO4
D. Dung dịch NaCl
Lời giải
Dẫn hỗn hợp khí qua dung dịch bazơ dư, các tạp chất là oxit axit bị giữ lại. Khí đi ra khỏi dung dịch là CO (oxit trung tính không tác dụng với bazơ)
PTHH: CO2 + Ca(OH)2 → CaCO3 ↓ + H2O
SO2 + Ca(OH)2 → CaSO3 ↓ + H2O
Đáp án: B
Bài 5: Cho 15,3 gam oxit của kim loại hóa trị II vào nước thu được 200 gam dung dịch bazơ với nồng độ 8,55%. Công thức của oxit trên là
A. Na2O
B. CaO
C. BaO
D. K2O
Lời giải
Đặt công thức hóa học của oxit là MO
PTHH: MO + H2O → M(OH)2
Ta có:
mM(OH)2 = gam
Theo phương trình, ta có:
=> kim loại M là Ba
=> công thức oxit là BaO
Đáp án: C
Bài 6: Hòa tan hoàn toàn 10 gam MgO cần dùng vừa đủ 400 ml dung dịch HCl aM thu được dung dịch X. Giá trị của a là
A. 1,50M
B. 1,25M
C. 1,35M
D. 1,20M
Lời giải
nMgO = 0,25 mol
MgO + 2HCl → MgCl2 + H2O
0,25 → 0,5 mol
=> Nồng độ của dung dịch HCl là
Đáp án: B
Bài 7: Hòa tan hoàn toàn 53,6 gam hỗn hợp A gồm (FeO, CuO) cần dùng vừa đủ 500 ml dung dịch H2SO4 1,4M (D = 1,2g/ml) thu được dung dịch X. Giả thiết thể tích của dung dịch sau phản ứng thay đổi không đáng kể. Nồng độ phần trăm của muối FeSO4 trong dung dịch X là
A. 7,04%
B. 6,06%
C. 9,30%
D. 6,98%
Lời giải
Gọi số mol của FeO và CuO lần lượt là x và y mol
=> mhỗnhợp = mFeO + mCuO => 72x + 80y = 53,6 (1)
nH2SO4 = 0,5.1,4 = 0,7 mol
FeO + H2SO4 → FeSO4 + H2O
x → x → x
CuO + H2SO4 → CuSO4 + H2O
y → y
=> nH2SO4 = x + y = 0,7 (2)
Từ (1) và (2) => x = 0,3 mol; y = 0,4 mol
Ta có: m dung dịch H2SO4 = D.V = 1,2.500 = 600 gam
=> m dd trước phản ứng = m hỗn hợp A + m dd H2SO4 = 53,6 + 600 = 653,6 gam
Vì phản ứng không tạo chất khí hay chất kết tủa
=> m dd sau phản ứng = m dd trước phản ứng = 653,6 gam
Đáp án: D
Bài 8: Cho 20 gam hỗn hợp X gồm CuO và Fe2O3 tác dụng vừa đủ với 0,2 lít dung dịch HCl có nồng độ 3,5M. Thành phần phần trăm theo khối lượng của CuO và Fe2O3 trong hỗn hợp X lần lượt là :
A. 25% và 75%
B. 20% và 80%
C. 22% và 78%
D. 30% và 70%
Lời giải
Gọi a là số mol của CuO và b là số mol của Fe2O3 có trong 20 gam
hh 200 ml dd HCl 3,5 M => nHCl = 0,2 . 3,5 = 0,7 mol
CuO + 2HCl → CuCl2 + H2O
a mol → 2a mol
Fe2O3 + 6HCl → 2FeCl3 + 3H2O
b mol → 6b mol
Ta có hệ PT:
m hh = m CuO + m Fe2O3 = 80a + 160b = 20
nHCl = 2a + 6b = 0,7
Giải hệ trên ta được
a = 0,05 mol b = 0,1 mol => mCuO = 0,05 . 80 = 4g
=> %CuO = 20% => %Fe2O3 = 80%
Đáp án: B
Bài 9: Sục 3,36 lít khí SO3 (đktc) vào 400 ml nước thu được dung dịch A. Biết DH2O = 1 g/ml ). Nồng độ phần trăm của chất tan trong dung dịch A là
A. 2,91%
B. 1,94%
C. 3,49%
D. 3,57%
Lời giải
nSO3 = 0,15 mol
SO3 + H2O → H2SO4
0,15 → 0,15 mol
mH2O = D.V = 400 gam
Đáp án: D
Bài 10: Hòa tan hết 12,4 gam Natrioxit vào nước thu được 500ml dung dịch A . Nồng độ mol của dung dịch A là :
A. 0,8M
B. 0,6M
C. 0,4M
D. 0,2M
Lời giải
nNa2O = 12,4 : 62 = 0,2 mol
PTHH: Na2O + H2O → 2NaOH
1 2
0,2 → 0,4
CM NaOH = nNaOH : V = 0,4 : 0,5 = 0,8M
Đáp án: A
Bài 11: Hòa tan 6,2 g Na2O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là:
A. 0,1M
B. 0,2 M
C. 0,3M
D. 0,4M
Lời giải
nNa2O = mNa2O : MNa2O = 6,2 : (23 . 2 + 16) = 0,1 mol
PTHH: Na2O + H2O → 2NaOH
Tỉ lệ 1 2
Phản ứng 0,1 ? mol
Từ PTHH => nNaOH = 2 nNa2O = 0,2 mol
Đáp án: A
Bài 12: Oxit bazơ không có tính chất hóa học nào sau đây?
A. Một số oxit bazơ tác dụng được với nước ở điều kiện thường.
B. Oxit bazơ tác dụng được với dung dịch axit.
C. Oxit bazơ tác dụng được với tất cả kim loại.
D. Một số oxit bazơ tác dụng được với oxit axit.
Lời giải
Oxit bazơ không có tính chất tác dụng được với tất cả kim loại.
Đáp án: C
Bài 13: Dãy các chất tác dụng được với oxit bazơ Na2O là:
A. H2O, SO2, HCl
B. H2O, CO, HCl
C. H2O, NO, H2SO4
D. H2O, CO, H2SO4
Lời giải
A tác dụng với Na2O
B có CO không tác dụng
C có NO không tác dụng
D có CO không tác dụng
Đáp án: A
Bài 14: Tính chất hóa học của oxit axit là
A. tác dụng với nước
B. tác dụng với dung dịch bazơ
C. tác dụng với một số oxit bazơ
D. cả 3 đáp án trên.
Lời giải
Tính chất hóa học của oxit axit là
- Tác dụng với nước.
- Tác dụng với dung dịch bazơ.
- Tác dụng với một số oxit bazơ.
Đáp án: D
Bài 15: Oxit axit có thể tác dụng được với
A. oxit bazơ
B. nước
C. bazơ
D. cả 3 hợp chất trên
Lời giải
Tính chất hóa học của oxit axit là
+ Tác dụng với nước tạo thành dung dịch axit
+ Tác dụng với dung dịch bazơ tạo thành muối và nước
+ Tác dụng với một số oxit bazơ tạo thành muối
Đáp án: D
Bài 16: Cho các oxit bazơ sau: Na2O, FeO, CuO, Fe2O3, BaO. Số oxit bazơ tác dụng với nước ở nhiệt độ thường là
A. 2
B. 3
C. 4
D. 5
Lời giải
Các oxit bazơ tác dụng được với nước ở nhiệt độ thường là: Na2O và BaO
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
Đáp án: A
Bài 17: 0,05 mol FeO tác dụng vừa đủ với:
A. 0,02mol HCl
B. 0,1mol HCl
C. 0,05mol HCl
D. 0,01mol HCl
Lời giải
FeO + 2HCl → FeCl2 + H2O
nFeO = 0,05 mol
theo phương trình nHCl = 2 nFeO = 0,1 mol
Đáp án: B
Bài 18: Hòa tan 4,88 gam hỗn hợp A gồm MgO và FeO trong 200 ml dung dịch H2SO4 0,45M loãng thì phản ứng vừa đủ, thu được dung dịch B. Phần trăm khối lượng của MgO trong A là
A. 59,02%
B. 61,34%
C. 40,98%
D. 38,66%
Lời giải
Gọi số mol của MgO và FeO trong hỗn hợp A là x và y mol
Vì mA = mMgO + mFeO = 40x + 72y
→ 40x + 72y = 4,88 (1)
Phương trình hóa học
MgO + H2SO4 → MgSO4 + H2O (*)
x → x
FeO + H2SO4 → FeSO4 + H2O (**)
y → y
Theo phương trình (*):
nH2SO4 = 0,2.0,45 = 0,09 mol
→ x + y = 0,09 (2)
Từ (1) và (2) ta có hệ phương trình:
=> mMgO = 40.0,05 = 2gam => % mMgO =
Đáp án: C
Bài 19: Cho 20 gam hỗn hợp Na2O và CuO tác dụng hết với 3,36 lít SO2(đktc). Sau phản ứng thấy thu được một chất rắn không tan. Thành phần phần trăm theo khối lượng của 2 oxit trong hỗn hợp lần lượt là:
A. 46,5% và 53,5%
B. 53,5% và 46,5%
C. 23,25% và 76,75%
D. 76,75% và 23,25%
Lời giải
PTPƯ: Na2O + SO2 → Na2SO3
nNa2O = nSO2 = 3,36:22,4 = 0,15(mol)
Đáp án: A
Bài 20: Biết rằng 1,12 lít khí cacbon đioxit (đktc) tác dụng vừa đủ với 100 ml dung dịch NaOH tạo ra muối trung hòa. Nồng độ mol của dung dịch NaOH đã dùng là
A. 1M
B. 2M
C. 0,1M
D. 0,2M
Lời giải
CO2 + 2NaOH → Na2CO3 + H2O
Từ phương trình, ta có:
=> nồng độ mol của dung dịch NaOH là:
Đáp án: A
Bài 21: Cho 38,4 gam một oxit axit của phi kim X có hóa trị IV tác dụng vừa đủ với dung dịch NaOH thu được 400 gam dung dịch muối có nồng độ 18,9%. Công thức của oxit là
A. CO2
B. SO3
C. NO2
D. SO2
Lời giải
Đặt công thức của oxit là XO2
mMuối =
XO2 + 2NaOH → Na2XO3 + H2O
Theo phương trình hóa học:
=> X = 32 => công thức oxit là SO2
Đáp án: D
Bài 22: Trong những cặp chất sau, cặp chất nào phản ứng được với nhau?
A. CO và Na2O
B. K2O và CO2
C. CO2 và P2O5
D. NO và K2O
Lời giải
K2O + CO2 → K2CO3
Đáp án: B
Bài 23: Hai oxit tác dụng với nhau tạo thành muối là:
A. CO2 và BaO
B. K2O và NO
C. Fe2O3 và SO3
D. MgO và CO
Lời giải
Một số oxit bazơ tác dụng với oxit axit tạo thành muối, thông thường đó là các oxit tác dụng được với nước (Na2O, CaO, K2O, BaO)
Đáp án: A
Câu 24: Các oxit nào sau đây phản ứng với nhau từng đôi một: CaO(1); K2O(2); CuO(3); FeO(4); CO2(5); SO2(6)
A. (1) và (5); (1) và (6); (2) và (5); (2) và (4)
B. (1) và (5); (1) và (6); (2) và (5); (2) và (3)
C. (2) và (5); (2) và (6); (3) và (5); (3) và (6)
D. (1) và (5); (1) và (6); (2) và (5); (2) và (6)
CaO; K2O là những oxit bazo tan nên pư được với oxit axit CO2; SO2
Đáp án: D
Câu 25: Oxit bazơ K2O có thể tác dụng được với oxit axit là:
A. CO
B. NO
C. SO2
D. CaO
Oxit bazo tan có thể tác dụng với oxit axit tạo muối
K2O + SO2 → K2SO3
Đáp án: C
Câu 26: Chất tác dụng với nước tạo ra dung dịch bazơ là:
A. CO2.
B. Na2O.
C. SO2.
D. CuO
Na2O + H2O → NaOH (dd bazơ)
Đáp án: B
Câu 27: Chất tác dụng với nước tạo ra dung dịch bazơ là:
A. K2O.
B. CuO.
C. CO.
D. SO2.
Oxit tác dụng được với nước tạo ra dd bazo là oxit bazo
Đáp án: A
Câu 28: Oxit tan trong nước tạo thành dung dịch làm quỳ tím chuyển sang màu đỏ là:
A. CuO
B. BaO
C. CO
D. SO3
CuO không tan trong nước
BaO tan trong nước làm quỳ chuyển xanh
CO không tan trong nước
SO3 tan trong nước tạo thành dung dịch làm quỳ tím chuyển sang màu đỏ
Đáp án: D
Câu 29: Dãy chất sau đây chỉ gồm các oxit:
A. MgO, Ba(OH)2, CaSO4, HCl.
B. MgO, CaO, CuO, FeO.
C. SO2, CO2, NaOH, CaSO4.
D. CaO, Ba(OH)2, MgSO4, BaO.
A. Chỉ có MgO là oxit
B. đúng
C. Chỉ có SO2, CO2 là oxit
D. Chỉ có CaO, BaO là oxit
Đáp án: B
Câu 30: Dãy chất gồm các oxit axit là:
A. CO2, SO2, NO, P2O5.
B. CO2, SO3, Na2O, NO2.
C. SO2, P2O5, CO2, SO3.
D. H2O, CO, NO, Al2O3.
A: NO là oxit trung tính
B: Na2O là oxit bazo
D: CO và NO là oxit trung tính, Al2O3 là oxit lưỡng tính
Đáp án: C
Câu 31: Dãy chất gồm các oxit bazơ:
A. CuO, NO, MgO, CaO.
B. CuO, CaO, MgO, Na2O.
C. CaO, CO2, K2O, Na2O.
D. K2O, FeO, P2O5, Mn2O7.
A. NO là oxit trung tính
C. CO2 là oxit axit
D. P2O5 là oxit axit
Đáp án: B
Câu 32: Oxit khi tác dụng với nước tạo ra dung dịch axit sunfuric là:
A. CO2.
B. SO3.
C. SO2.
D. K2O.
SO3 + H2O → H2SO4
Đáp án: B
Câu 33: Chất nào sau đây khi phản ứng với nước tạo thành dung dịch mang tính axit?
A. CaO
B. Ba
C. SO3
D. Na2O
Oxit axit khi tác dụng với H2O sẽ tạo thành dung dịch có tính axit
A. CaO + H2O → Ca(OH)2 ⇒ dung dịch có tính bazơ
B. Ba + H2O → Ba(OH)2 ⇒ dung dịch có tính bazơ
C. SO3 + H2O → H2SO4 ⇒ dung dịch có tính axit
D. Na2O + H2O → 2NaOH ⇒ dung dịch bazơ
Đáp án: C
Câu 34: Dãy oxit nào sau đây vừa tác dụng với nước, vừa tác dụng với dung dịch bazơ
A. CaO, CuO
B. CO, Na2O.
C. CO2, SO2
D. P2O5, MgO
Chất vừa tác dụng được với nước, vừa tác dụng được với dung dịch bazơ là oxit axit
⇒ CO2; SO2 thỏa mãn
Đáp án: C
Câu 35: Hòa tan hoàn toàn 2,8 gam hỗn hợp chất rắn gồm Fe2O3, MgO, CuO, ZnO thì cần dùng vừa đủ 200 ml dung dịch HCl 0,5M. Sau khi phản ứng xảy ra hoàn toàn thu được dung dịch hỗn hợp X gồm các muối. Cô cạn dung dịch X thu được m gam muối khan. Giá trị của m là
A. 6,81.
B. 5,55.
C. 6,12.
D. 5,81.
nHCl = CM. VHCl = 0,5. 0,2 = 0,1 (mol)
Đặt công thức chung của các oxi là M2On
→ 2,8 + 0,1.36,5 = mmuối + 0,05.18
→ mmuối = 5,55 (g)
Đáp án: B
Câu 36: Hòa tan hoàn toàn 12,1 gam hỗn hợp bột CuO và ZnO cần 100 ml dung dịch HCl 3M. Thành phần phần trăm theo khối lượng hai oxit trên lần lượt là:
A. 33,06% và 66,94%
B. 66,94% và 33,06%
C. 33,47% và 66,53%
D. 66,53% và 33,47%
gọi x, y lần lượt là số mol của CuO và ZnO
ta có mhh = mCuO + mFeO = 80x + 81y = 12,1 (I)
nHCl = VHCl . CM HCl = 0,1 . 3 = 0,3 mol
nHCl = nHCl (1) + nHCl(2) = 2x + 2y = 0,3 (II)
Giải hệ (I) và (II) ta có x = 0,05 và y = 0,1
⇒ mCuO = 0,05 . 80 = 4g
⇒ %CuO = 33,06%
⇒ %ZnO = 66,94%
Đáp án: A
Câu 37: Hòa tan hoàn toàn 2,81 gam hỗn hợp gồm Fe2O3, MgO, ZnO trong 500 ml H2SO4 0,1 M (vừa đủ). Sau phản ứng, hỗn hợp muối sunfat khan thu được khi cô cạn dung dịch có khối lượng là
A. 6,81 g
B. 4,81 g
C. 3,81 g
D. 5,81 g
Cần nhớ phản ứng cho oxit bazơ tác dụng với H2SO4 thì nH2SO4 = nH2O
- Số mol H2SO4 = 0,5. 0,1 = 0,05 mol -> Số mol H2O = 0,05 mol
- Áp dụng định luật bảo toàn khối lượng ta có:
Moxit + maxit sunfuric = mmuối sunfat + mnước
-> mmuối sunfat = (moxit + maxit sunfuric) – mnước
= (2,81 + 0,05.98) + (0,05.18) = 6,81 gam
Câu 38: Hòa tan hoàn toàn một oxit kim loại có hóa trị II bằng dung dịch H2SO4 có nồng độ 14,00% vừa đủ thì thu được một dung dịch muối có nồng độ 16,22%. Oxit kim loại hóa trị II trên là
A. FeO.
B. CuO.
C. MgO.
D. ZnO.
Đáp án: C
Câu 39: Hoà tan 2,4 g một oxit kim loại hoá trị II cần dùng 30g dd HCl 7,3%. Công thức của oxit kim loại là:
A. CaO.
B. CuO.
C. FeO.
D. ZnO.
Đặt công thức của oxit KL là RO
RO + 2HCl → RCl2 + H2O
Ta có mHCl = (30 .7,3) : 100 = 2,19 g
⇒ nHCl = 2,19 : 36,5 = 0,06 mol
Từ pt ⇒ nRO = nHCl/2 = 0,03
⇒ 2,4 : (R+16) = 0,03
⇒ 64 = R
⇒ R là Cu
⇒ CT oxit là CuO
Đáp án: B
Câu 40: Trong các oxit sau, oxit nào tác dụng được với nước?
A. CaO ;
B. CuO ;
C. Fe2O3 ;
D. ZnO.
CaO + H2O → Ca(OH)2
Đáp án: A
Câu 41: Cho các oxit: SO2, Na2O, CaO, CuO. Oxit không tác dụng được với nước là
A. SO2
B. Na2O
C. CuO
D. CaO
CuO không tác dụng được với nước
Đáp án: C
Câu 42: Oxit được chia thành mấy loại?
A. 1 loại
B. 2 loại
C. 3 loại
D. 4 loại
Oxit được chia làm 4 loại
+ oxit bazơ
+ oxit axit
+ oxit lưỡng tính
+ oxit trung tính
Đáp án: D
Câu 43: Oxit là:
A. Hỗn hợp của nguyên tố oxi với một nguyên tố hoá học khác.
B. Hợp chất của nguyên tố phi kim với một nguyên tố hoá học khác.
C. Hợp chất của oxi với một nguyên tố hoá học khác.
D. Hợp chất của nguyên tố kim loại với một nguyên tố hoá học khác.
Đáp án C
Câu 44: Oxit axit là:
A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
C. Những oxit không tác dụng với dung dịch bazơ và dung dịch axit.
D. Những oxit chỉ tác dụng được với muối.
Đáp án B
Câu 45: Oxit Bazơ là:
A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
C. Những oxit không tác dụng với dung dịch bazơ và dung dịch axit.
D. Những oxit chỉ tác dụng được với muối.
Đáp án A
Câu 46: Oxit lưỡng tính là:
A. Những oxit tác dụng với dung dịch axit tạo thành muối và nước.
B. Những oxit tác dụng với dung dịch bazơ và tác dụng với dung dịch axit tạo thành muối và nước.
C. Những oxit tác dụng với dung dịch bazơ tạo thành muối và nước.
D. Những oxit chỉ tác dụng được với muối.
Đáp án B
Câu 47: Oxit được chia làm mấy loại?
A. 4
B. 3
C. 2
D. 1
Oxit được chia thành 4 loại là oxit axit, oxit bazo, oxit trung tính và oxit lưỡng tính
Đáp án: A
Câu 48: oxit nào sau đây là oxit bazơ:
A. Na2O
B. CO2
C. CO
D. Al2O3
CO là oxit trung tính
CO2 là oxit axit
Al2O3 là oxit lưỡng tính
Na2O là oxit bazo
Đáp án: A
Câu 49: Oxit nào sau đây là oxit axit?
A. BaO
B. CaO
C. CO
D. CO2
BaO và CaO là oxit bazo
CO là oxit trung tính
CO2 là oxit axit
Đáp án: D
Câu 50: Chất tác dụng với nước tạo ra dung dịch axit là
A. K2O.
B. CuO.
C. P2O5.
D. CaO.
Chất tác dụng với nước tạo ra dung dịch axit là oxit axit
Đáp án: C
Câu 51: Chất tác dụng với nước tạo ra dung dịch axit là:
A. CaO
B. BaO
C. Na2O
D. SO3
Oxit tác dụng được với nước tạo ra dd axit là oxit axit
Đáp án: D
Câu 52: Một oxit của photpho có thành phần phần trăm của P bằng 43,66%. Biết phân tử khối của oxit bằng 142 đvC. Công thức hoá học của oxit là:
A. P2O3.
B. P2O5.
C. PO2.
D. P2O4.
Gọi x là hóa trị của P
⇒ Công thức oxit của P với O là P2Ox
Vậy công thức của oxit là P2O5
Đáp án: B
Câu 53: Một oxit được tạo bởi 2 nguyên tố là sắt và oxi, trong đó tỉ lệ khối lượng giữa sắt và oxi là 7/3. Công thức hoá học của oxit sắt là:
A. FeO.
B. Fe2O3.
C. Fe3O4.
D. FeO2.
Tỉ lệ khối lượng giữa Fe và O là 7/3
⇒ Đặt khối lượng của Fe là 7 thì khối lượng của O là 3
Gọi công thức của oxit là: FexOy (x,y € N*)
Áp dụng công thức ta có:
Vậy công thức của oxit là Fe2O3
Đáp án: B
Câu 54: Khử hoàn toàn 0,58 tấn quặng sắt chứa 90 % là Fe3O4 bằng khí hiđro. Khối lượng sắt thu được là:
A. 0,378 tấn.
B. 0,156 tấn.
C. 0,126 tấn.
D. 0,467 tấn.
⇒ khối lượng Fe3O4 có trong quặng là 0,552 (tấn)
Fe3O4 + 4H2 → 3Fe + 4H2O
232 g → 3.56 g
0,522 g → ? g
⇒ mFe = (0.522 . 3 . 56) : 232 = 0,378 tấn
Đáp án: A
Câu 55: Thể tích khí hiđro (đktc) cần dùng để khử hoàn toàn hỗn hợp gồm 20 g CuO và 111,5g PbO là:
A. 11,2 lít.
B. 16,8 lít.
C. 5,6 lít.
D. 8,4 lít.
nCuO = 0,25 mol; nPbO = 0,5mol
CuO + H2 → Cu + H2O (1)
PbO + H2 → Pb + H2O (2)
Theo phương trình (1) ta có nH2 (1) = nCuO = 0,25 mol
Theo phương trình (2) ta có nH2 (2) = nPbO = 0,5 mol
⇒ nH2 phản ứng = nH2 (1) + nH2 (2) = 0,25 + 0,5 = 0,75 mol
⇒ VH2 = 0,75 . 22,4 = 16,8 lít
Đáp án: B
Câu 56: Khử 44,8g hỗn hợp A gồm các oxit CuO, FeO, Fe3O4, Fe2O3 bằng V(lít) khí CO ở nhiệt độ cao, thu được 40 gam chất rắn X. Giá trị của V là:
A. 0,672 lít
B. 6,72 lít
C. 2,24 lít
D. 22,4 lít
Phản ứng khử oxit của CO có thể hiểu là: CO + [O]oxit -> CO2
Trước là 44,8 g oxit sau thu được 40g chất rắn. Vậy lượng chất rắn sau phản ứng bị giảm.
rắn giảm = mO (trong oxit) = 44,8 – 40 = 4,8g
Mà nCO = nCO2 = n[O] trong oxit
⇒ VCO = 0,3.22,4 = 6,72 lít
Đáp án: B
Câu 57: Khử hoàn hoàn 24 gam hỗn hợp Fe2O3 và CuO bằng khí H2, sau phản ứng thu được 17,6 gam hỗn hợp 2 kim loại. Tổng thể tích khí H2 đã dùng là:
A. 4,48 lít
B. 6,72 lít
C. 8,96 lít
D. 11,2 lít
Đáp án: C
Trắc nghiệm Bài 2:Một số oxit quan trọng
Bài 1: Để nhận biết hai chất rắn màu trắng CaO và P2O5 ta dùng:
A. nước và quỳ tím
B. dung dịch NaCl
C. dung dịch KOH
D. quỳ tím khô
Lời giải
Để nhận biết hai chất rắn màu trắng CaO và P2O5 ta dùng: nước và quỳ tím
- Cho 2 chất rắn vào nước => 2 chất rắn tan hết, tạo thành dung dịch
CaO + H2O → Ca(OH)2
P2O5 + 3H2O → 2H3PO4
- Cho quỳ tím vào 2 dung dịch thu được
+ dung dịch làm quỳ chuyển xanh là Ca(OH)2 => chất rắn ban đầu là CaO
+ dung dịch làm quỳ chuyển đỏ là H3PO4 => chất rắn ban đầu là P2O5
Đáp án: A
Bài 2: BaO tác dụng được với các chất nào sau đây?
A. H2O, NO, KOH
B. NaOH, SO3, HCl
C. P2O5, CuO, CO
D. H2O, H2CO3, CO2
Lời giải
BaO tác dụng được với: H2O, H2CO3, CO2.
BaO + H2O → Ba(OH)2
BaO + H2CO3 → BaCO3 + H2O
BaO + CO2 → BaCO3
Loại A vì BaO không phản ứng với KOH
Loại B vì BaO không phản ứng với NaOH
Loại C vì BaO không phản ứng với CO.
Đáp án: D
Bài 3: Lưu huỳnh trioxit (SO3) tác dụng được với:
A. Nước, sản phẩm là bazơ
B. Axit, sản phẩm là bazơ
C. Nước, sản phẩm là axit
D. Bazơ, sản phẩm là axit
Lời giải
SO3 là oxit axit
=> tác dụng với nước cho sản phẩm là axit và tác dụng với bazo cho sản phẩm là muối
Đáp án: C
Bài 4: Một loại đá vôi chứa 80% CaCO3. Nung 1 tấn đá vôi loại này có thể thu được bao nhiêu kg vôi sống (CaO), nếu hiệu suất là 85%?
A. 308,8 kg
B. 388,8 kg
C. 380,8 kg
D. 448,0 kg
Lời giải
1 tấn đá vôi chứa 80% CaCO3 => mCaCO3 = 0,8 tấn = 800 kg
CaCO3 → CaO + CO2
100 kg 56 kg
800 kg → 448 kg
Vì hiệu suất là 85% => mCaOthực tế = 448.85% = 380,8 kg
Đáp án: C
Bài 5: Từ 10 kg đá vôi ( không lẫn tạp chất) điều chế được bao nhiêu kg vôi sống, biết rằng hiệu suất toàn bộ quá trình là 75%?
Lời giải
CaCO3 → CaO + CO2↑
Theo phương trình 100(g) → 56 (g)
Hay 100 kg → 56 (kg)
Theo đề bài 10 kg → x (kg)
=> x = 10.56/100 = 5,6 (kg)
Vì H= 75% => lượng CaO thực tế thu được là: mCaO = 5,6. 75% : 100% = 4,2 (kg)
Đáp án: C
Bài 6: Khi cho CaO vào nước thu được
A. dung dịch CaO.
B. dung dịch Ca(OH)2.
C. chất không tan Ca(OH)2.
D. cả B và C.
Lời giải
Khi cho CaO vào nước xảy ra phản ứng: CaO + H2O → Ca(OH)2
Vì Ca(OH)2 là chất ít tan trong nước, phần tan tạo thành dung dịch bazơ và còn 1 phần không tan lắng xuống
Đáp án: D
Bài 7: Ứng dụng nào sau đây không phải của canxi oxit?
A. Công nghiệp sản suất cao su
B. Sản xuất thủy tinh.
C. Công nghiệp xây dựng, khử chua cho đất.
D. Sát trùng diệt nấm, khử độc môi trường.
Lời giải
CaO được dùng trong công nghiệp sản xuất thủy tinh; khử chua đất trồng trọt; xử lí nước thải của các nhà máy.
=> Ứng dụng không phải của canxi oxit là: công nghiệp luyện kim
Đáp án: A
Bài 8: Hóa chất nào sau đây dùng để khử chua đất trong công nghiệp?
A. CaCO3
B. MgCO3
C. NaCl
D. CaO
Lời giải
Đất chua là đất có môi trường axit => dùng hóa chất có tính bazơ để trung hòa bớt độ chua của đất
CaO + H2O → Ca(OH)2 (môi trường bazơ)
Ca(OH)2 trung hòa lượng H+ trong đất làm đất bớt chua
Đáp án: D
Bài 9: Canxi oxit có thể tác dụng được với những chất nào sau đây?
A. H2O, CO2, HCl, H2SO4
B. CO2, HCl, NaOH, H2O
C. Mg, H2O, NaCl, NaOH
D. CO2, HCl, NaCl, H2O
Lời giải
Canxi oxit có thể tác dụng được với : H2O, CO2, HCl, H2SO4.
Đáp án: A
Bài 10: Các oxit tác dụng được với nước là
A. PbO2, K2O, SO3
B. BaO, K2O, SO2
C. Al2O3, NO, SO2
D. CaO, FeO, NO2
Lời giải
Các oxit tác dụng được với nước là BaO, K2O, SO2.
BaO + H2O → Ba(OH)2
K2O + H2O → 2KOH
SO2 + H2O ⇆ H2SO3
Đáp án: B
Bài 11: Hòa tan 0,56 gam CaO vào 800 ml nước thu được dung dịch nước vôi trong có nồng độ mol là
A. 0,15M
B. 0,0125M
C. 0,015M
D. 0,0025M
Lời giải
nCaO = 0,01 mol
CaO + H2O → Ca(OH)2
0,01 → 0,01
Đáp án: B
Bài 12: Để nhận biết hai khí SO2 và O2 ta dùng
A. quỳ tím ẩm
B. dung dịch Ca(OH)2
C. dung dịch Ba(OH)2
D. cả A, B, C đều đúng
Lời giải
Để nhận biết hai khí SO2 và O2 ta có thể dùng:
- Qùy tím ẩm: SO2 làm quỳ chuyển đỏ, O2 không đổi màu
- Dung dịch Ca(OH)2 hoặc Ba(OH)2: SO2 làm dung dịch xuất hiện vẩn đục, O2 không hiện tượng
Đáp án: D
Bài 13: Khí X là một khí có mùi hắc, khi dẫn khí X vào dung dịch nước vôi trong thì xuất hiện vẩn đục. Hỏi khí X là khí nào?
A. CO2
B. SO2
C. H2
D. H2S
Lời giải
X là một khí có mùi hắc, khi dẫn khí X vào dung dịch nước vôi trong thì xuất hiện vẩn đục → X là SO2 vì
SO2 + Ca(OH)2 → CaSO3 + H2O
Đáp án: B
Bài 14: Cho 8 gam lưu huỳnh trioxit (SO3) tác dụng với H2O, thu được 250 ml dung dịch axit sunfuric (H2SO4). Nồng độ mol của dung dịch axit thu được là
A. 0,1M
B. 0,4M
C. 0,5M
D. 0,6M
Lời giải
SO3 + H2O → H2SO4
0,1 → 0,1 mol
Đáp án: B
Bài 15: Hòa tan hết m gam SO3 vào nước thu được 98 gam dung dịch axit sunfuric có nồng độ 12,5%. Khối lượng m gam SO3 là:
A. 20g
B. 15g
C. 25g
D. 10g
Lời giải
Đáp án: D
Câu 16: Dẫn hỗn hợp khí gồm CO2, CO, SO2 lội qua dung dịch nước vôi trong (dư), khí thoát ra là:
A. CO
B. CO2
C. SO2
D. CO2 và SO2
Dung dịch nước vôi trong là Ca(OH)2 là dung dịch bazơ
=> Oxit axit có thể tác dụng với dung dịch bazơ, đó là CO2 và SO2 và 2 khí này bị hấp thụ trong dd
CO không tác dụng vì CO là oxit trung tính.
=> Khí thoát ra là CO
Đáp án: A
Câu 17: Hòa tan vừa đủ 5,6 gam CaO vào dung dịch HCl 14,6% . Khối lượng dung dịch HCl đã dùng là :
A. 60 gam
B. 40 gam
C. 50 gam
D. 73
Đáp án: C
Câu 18: Cho 9,3 gam Na2O tác dụng hết với 200 ml dung dịch HCl aM sau phản ứng thu được muối m gam muối natriclorua. Giá trị của a và m là:
A. a = 1,5 M và m = 8,775g
B. a = 1,5 M và m = 17,55g
C. a = 2 M và m = 8,775g
D. a = 2 M và m = 8,775g
Đáp án: B
Câu 19: Hòa tan 2,4 gam oxit của một kim loại hóa trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ. Oxit đó là:
A. CuO
B. CaO
C. MgO
D. FeO
Đáp án: A
Câu 20: Hòa tan 8 gam oxit của một kim loại hóa trị II vào 98 gam dung dịch H2SO4 20% thì vừa đủ . Oxit đó là:
A. CuO
B. CaO
C. MgO
D. FeO
Đáp án: C
Câu 21: Để hòa tan hết 5,1 g M2O3 phải dùng 43,8 g dung dịch HCl 25%. Phân tử khối của M2O3 là:
A. 160
B. 102
C. 103
D. 106
Đáp án: C
Câu 22: Nung nóng 13,1 gam một hỗn hợp gồm Mg, Ca và Al trong không khí đến khi phản ứng hoàn toàn thu được 20,3 gam hỗn hợp gồm MgO, CaO, Al2O3. Hòa tan 20,3 gam hỗn hợp oxit trên cần dùng V lít dung dịch HCl 0,4M. Giá trị của V là
A. 2
B. 2,5
C. 2,25
D. 1,25
Từ các phương trình, ta nhận thấy:
nHCl = 4x + 4y + 4z = 4.(x + y + z) = 4.nO2
Áp dụng định luật bảo toàn khối lượng cho PT (1), (2), (3), ta có:
⇒ nO2 = 0,225(mol) ⇒ nO2 = 0,225(mol)
=> nHCl = 4.0,225 = 0,9 mol => VHCl = 2,25 (lít)
Đáp án: C
Câu 23: Có 2 chất bột trắng CaO và Al2O3 thuốc thử để phân biệt được 2 chất bột là
A. dung dịch HCl.
B. NaCl.
C. H2O.
D. giấy quỳ tím.
CaO tan trong nước tạo dung dịch vẩn đục, còn Al2O3 thì không tan trong nước
CaO + H2O → Ca(OH)2
Đáp án: C
Câu 24: Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây?
A. CaSO3 và HCl;
B. CaSO4 và HCl;
C. CaSO3 và NaOH
D. CaSO3 và NaCl.
Lưu huỳnh đioxit có công thức: SO2
CaSO3 + HCl → CaCl2 + SO2↑ + H2O
Đáp án: A
Câu 25: Cặp chất nào sau đây có thể dùng để điều chế SO2 trong phòng thí nghiệm?
A. Al và H2SO4 loãng.
B. NaOH và dung dịch HCl.
C. Na2SO4 và dung dịch HCl.
D. Na2SO3 và dung dịch HCl
Na2SO3 + 2HCl → 2NaCl + SO2↑ + H2O
Đáp án: D
Câu 26: Lưu huỳnh đioxit được tạo thành từ cặp chất nào sau đây?
A. Na2SO3 và H2O
B. Na2SO3 và NaOH
C. Na2SO4 và HCl
D. Na2SO3 và H2SO4
Công thức hóa học của lưu huỳnh đioxit là SO2
A, B, C đều không xảy ra phản ứng hóa học
D. Na2SO3 + 2H2SO4 → Na2SO4 + SO2↑ + H2O
Đáp án: D
Câu 27: Chất nào sau đây được dùng để sản xuất vôi sống
A. CaCO3
B. NaCl
C. K2CO3
D. Na2SO4.
CaCO3 được dùng để sản xuất vôi sống
Đáp án: A
Câu 28: Sản phẩm của phản ứng phân hủy canxicacbonat bởi nhiệt là :
A. CaO và CO
B. CaO và CO2
C. CaO và SO2
D. CaO và P2O5
Đáp án: B
Câu 29: Oxit vừa tan trong nước vừa hút ẩm là:
A. SO2
B. CaO
C. Fe2O3
D. Al2O3
CaO vừa tan trong nước vừa dùng để hút ẩm
Đáp án: B
Câu 30: Khí X là nguyên nhân gây hiệu ứng nhà kính, đồng thời khí X cũng một nguyên nhân gây mưa axit. Vậy công thức hóa học của X là:
A. CO2
B. N2.
C. O2.
D. SO2.
CO2 là nguyên nhân chính gây nên hiệu ứng nhà kính
Đáp án: A
Câu 31: Chất khí nào sau đây là nguyên nhân gây ra hiệu ứng nhà kính ?
A. CO2
B. O2
C. N2
D. H2
Các thành phần khí gây hiệu ứng nhà kính chủ yếu bao gồm hơi nước, khí dioxit các bon (CO2), ô-xit Nitơ (N2O), khí mê-tan (CH4) và ô zôn (O3). Vai trò gây nên hiệu ứng nhà kính của các chất khí được xếp theo thứ tự sau: CO2 => CFC => CH4 => O3 =>NO2. Sự gia tăng nhiệt độ trái đất do hiệu ứng nhà kính có tác động mạnh mẽ tới nhiều mặt của môi trường trái đất.
Đáp án: A
Câu 32: Chất nào sau đây không được dùng để làm khô khí CO2?
A. H2SO4 đặc.
B. P2O5 khan.
C. NaOH rắn.
D. CuSO4 khan.
NaOH rắn không làm khô được khí CO2 vì có phản ứng với CO2
2NaOH + CO2 → Na2CO3 +H2O
Đáp án: C
Câu 33: Có thể dùng CaO để làm khô khí nào trong các khí dưới đây:
A. CO2
B. SO2
C. CO
D. SO3
CaO không tác dụng với CO nên có thể dùng để làm khô khí CO
Đáp án: C
Câu 34: Canxi oxit là một
A. axit
B. bazơ
C. oxit
D. muối
Canxi oxit có công thức là CaO, là hợp chất được tạo bởi nguyên tố Canxi (Ca) và Oxi (O) nên canxi oxit là một oxit.
Đáp án: C
Câu 35: SO2 là
A. oxit trung tính
B. oxit axit
C. oxit lưỡng tính
D. oxit bazơ
SO2 được tạo bởi nguyên tố lưu huỳnh (S) là một phi kim và Oxi (O) nên SO2 là một oxit axit.
Đáp án: B
Trắc nghiệm Bài 3: Tính chất hóa học của axit
Bài 1: Axit H2SO4 loãng không tác dụng với kim loại nào sau đây:
A. Al
B. Fe
C. Mg
D. Ag
Lời giải
Kim loại đứng sau H trong dãy điện hóa học của kim loại không tác dụng được với H2SO4 loãng.
Ag đứng sau H => Không phản ứng
Đáp án: D
Bài 2: Kim loại nào sau đây không tác dụng được với dung dịch axit H2SO4 loãng?
A. Fe
B. Al
C. Cu
D. Na
Lời giải
Fe, Al, Na tác dụng với dung dịch axit H2SO4 loãng
Cu không tác dụng với dd axit H2SO4 loãng
Đáp án: C
Bài 3: Dãy gồm các oxit tác dụng được với nước tạo thành dung dịch axit là:
A. CO, CO2, SO2
B. P2O5, NO, SO2
C. P2O5, SO2, CO2
D. NO, SO2, CO
Lời giải
A sai do CO không tác dụng với nước
B sai do NO không tác dụng với nước
C đúng
D sai do NO và CO không tác dụng với nước
Đáp án: C
Bài 4: Chất nào sau đây tác dụng với axit HCl tạo kết tủa trắng?
A. Ba(OH)2
B. Ca(NO3)2
C. AgNO3
D. MgSO4
Lời giải
Chất kết tủa có chứa gốc Cl là AgCl và PbCl2
Chất tạo kết tủa trắng với HCl là AgNO3
PTHH: AgNO3 + HCl → AgCl↓trắng + HNO3
Đáp án: C
Bài 5: Nhóm chất tác dụng với dung dịch H2SO4 loãng sinh ra chất kết tủa màu trắng:
A. ZnO, BaCl2
B. CuO, BaCl2
C. BaCl2, Ba(NO3)2
D. Ba(OH)2, ZnO
Lời giải
A ZnSO4 tan không có kết tủa
B CuSO4 cũng tan
D ZnSO4 tan
C kết tủa BaSO4 màu trắng
Đáp án: C
Bài 6: Tính chất hóa học nào không phải của axit?
A. Tác dụng với kim loại.
B. Tác dụng với muối.
C. Tác dụng với oxit axit.
D. Tác dụng với oxit bazơ.
Lời giải
Tính chất hóa học không phải của axit là: Tác dụng với oxit axit.
Axit không phản ứng với oxit axit
Đáp án: C
Bài 7: Chất nào sau đây tác dụng với Fe ở nhiệt độ thường tạo ra khí hiđro là
A. O2
B. HCl
C. CO2
D. H2O
Lời giải
Axit tác dụng với kim loại tạo muối và giải phóng khí hiđro
Fe + 2HCl → FeCl2 + H2
Đáp án: B
Bài 8: Hãy cho biết muối nào có thể điều chế bằng phản ứng của kim loại với dung dịch Axit H2SO4 loãng ?
A. ZnSO4
B. Na2SO3
C. CuSO4
D. MgSO3
Lời giải
A. Thỏa mãn: Zn + H2SO4 → ZnSO4 + H2↑
B,D loại vì không phải muối sunfat
C. Loại vì Cu không phản ứng với dd H2SO4
Đáp án: A
Bài 9: Hiện tượng quan sát được khi cho mẩu magie vào ống nghiệm chứa axit HCl dư là:
A. Mẩu Mg tan dần, không có bọt khí thoát ra
B. Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu
C. Mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được có màu xanh lam
D. Không xảy ra hiện tượng gì
Lời giải
Khi cho mẩu magie vào ống nghiệm chứa axit HCl dư mẩu Mg tan dần, có bọt khí thoát ra, dung dịch thu được không màu : Mg + 2HCl → MgCl2 + H2
Dung dịch MgCl2 thu được không có màu
Đáp án: B
Bài 10: Các kim loại nào sau đây tác dụng được với dung dịch H2SO4 loãng?
A. Mg, Zn, Ag, Cu
B. Mg, Zn, Fe, Cu
C. Zn, Fe, Al, Mg
D. Al, Cu, Fe, Ag
Lời giải
Các kim loại tác dụng được với dung dịch H2SO4 loãng là: Zn, Fe, Al, Mg.
Axit không tác dụng với Cu, Ag và Au.
Đáp án: C
Bài 11: Dãy các chất có thể tác dụng với dung dịch HCl là:
A. Na, FeO, CuO
B. FeO, CuO, CO2
C. Fe, FeO, CO2
D. Na, FeO, CO2
Lời giải
Dãy các chất có thể tác dụng với dung dịch HCl là Na, FeO, CuO
B, C, D sai do có CO2 không tác dụng với HCl
Đáp án: A
Bài 12: Dung dịch A tác dụng với CuO tạo ra dung dịch có màu xanh lam. A là
A. NaOH
B. Na2CO3
C. H2SO4
D. Ca(OH)2
Lời giải
CuO là oxit bazơ => tan trong dung dịch axit H2SO4 tạo muối CuSO4 có màu xanh lam
CuO + H2SO4 → CuSO4 + H2O
Đáp án: C
Bài 13: Cặp chất tác dụng với nhau tạo thành sản phẩm có chất khí:
A. Bari oxit và axit sunfuric loãng
B. Bari hiđroxit và axit sunfuric loãng
C. Bari cacbonat và axit sunfuric loãng
D. Bari clorua và axit sunfuric loãng
Lời giải
PTHH: BaCO3 + H2SO4 → BaSO4↓ + H2O + CO2↑
Đáp án: C
Bài 14: Nhóm oxit vừa tác dụng với nước, vừa tác dụng với dung dịch HCl là
A. Na2O, SO3, CO2
B. K2O, P2O5, CaO
C. BaO, Al2O3, Na2O
D. CaO, BaO, K2O
Lời giải
Loại A vì SO3, CO2 không phản ứng với dung dịch HCl
Loại B vì P2O5 không phản ứng với dung dịch HCl
Loại C vì Al2O3 không tan trong nước
Đáp án: D
Bài 15: Axit HCl tác dụng được với oxit nào trong các oxit sau: Na2O; BaO; CuO; MgO; SO2; P2O5
A. Na2O; BaO; CuO; P2O5
B. BaO; CuO; MgO; SO2
C. Na2O; BaO; CuO; MgO
D. Na2O; BaO; MgO ;P2O5
Lời giải
Na2O; BaO; CuO; MgO là các oxit bazo nên pư với axit=> muối và nước
Đáp án: C
Câu 16: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là
A. 0,2M
B. 0,3M
C. 0,4M
D. 0,5M
nCO2 = 0,075 mol
Vì KOH dư nên phản ứng tạo ra muối trung hòa
Đáp án: B
Câu 17: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là:
A. 0,896 lít
B. 0,448 lít
C. 8,960 lít
D. 4,480
Đáp án: A
Câu 18: Cho 11,2 lít CO2 vào 500 ml dung dịch NaOH 25% (D = 1,3 g/ml). Nồng độ mol/lit của dung dịch muối tạo thành là
A. 1M
B. 2M
C. 2,5M
D. 1,5M
Đáp án: A
Câu 19: Dẫn 448 ml CO2 (đktc) sục vào bình chứa 100 ml dung dịch KOH 0,25M. Khối lượng hai muối tạo thành là
A. 0,85 gam và 1,5 gam.
B. 0,69 gam và 1,7 gam.
C. 0,85 gam và 1,7 gam.
D. 0,69 gam và 1,5 gam
Đáp án: D
Câu 20: Dẫn 22,4 lít khí CO2 ( đktc) vào 200g dung dịch NaOH 20%. Sau phản ứng tạo ra sản phẩm nào trong số các sản phẩm sau:
A. Muối natricacbonat và nước.
B. Muối natri hidrocacbonat.
C. Muối natricacbonat.
D. Muối natrihiđrocacbonat và natricacbonat.
mchất tan NaOH = (mdd . C%):100% = 200 . 20%:100% = 40g
Đáp án: B
Câu 21: Phải đốt bao nhiêu gam cacbon để khi cho khí CO2 tạo ra trong phản ứng trên tác dụng với 3,4 lít dung dịch NaOH 0,5M ta được 2 muối với muối hiđrocacbonat có nồng độ mol bằng 1,4 lần nồng độ mol của muối trung hoà.
A. 12,0 gam.
B. 10,8 gam.
C. 14,4 gam.
D. 18,0 gam.
Vì thể tích dung dịch không thay đổi nên tỉ lệ về nồng độ cũng chính là tỉ lệ về số mol.
Đáp án: C
Câu 22: Cho 4,48 lít CO2 (đktc) đi qua 190,48ml dung dịch NaOH 2% có khối lượng riêng là 1,05g/ml. Khối lượng muối tạo thành là
A. 16,8 gam.
B. 8,4 gam.
C. 12,6 gam.
D. 29,4 gam.
Đáp án: B
Câu 23: Dẫn 3,36 lít khí CO2 (đktc) vào 40g dung dịch NaOH 20%. Sản phẩm thu được sau khi cô cạn dung dịch và khối lượng tương ứng là:
A. 12,6 gam NaHCO3; 2,0 gam NaOH
B. 5,3 gam Na2CO3; 8,4 gam NaHCO3
C. 10,6 gam Na2CO3; 4,2 gam NaHCO3
D. 10,6 gam Na2CO3; 2,0 gam NaOH
Đáp án: B
Câu 24: Thổi 2,464 lít khí CO2 vào một dung dịch NaOH thì được 9,46 gam hỗn hợp 2 muối Na2CO3 và NaHCO3. Nếu muốn chỉ thu được muối NaHCO3 thì cần thêm bao nhiêu lít khí cacbonic nữa?
A. 0,336 lít.
B. 0,112 lít.
C. 0,448 lít.
D. 0,224 lít.
Đáp án: D
Câu 25: Dẫn từ từ 3,136 lít khí CO2 (đktc) vào một dung dịch có hòa tan 12,8 gam NaOH sản phẩm thu được là muối Na2CO3. Khối lượng muối Na2CO3 thu được là:
A. 14,84 gam
B. 18, 96 gam
C. 16,96 gam
D. 16,44 gam
nCO2 =0,14 mol
nNaOH =0,32 mol
→ pư (1) có dư NaOH → nNa2CO3 = nCO2 =0,14 mol
→ mNa2CO3 = 14,84 g
Đáp án: A
Câu 26: Dẫn 1,12 lít khí SO2 (đktc) đi qua 700 ml dung dịch Ca(OH)2 0,1M. Khối lượng của muối thu được sau phản ứng là
A. 8 gam.
B. 12 gam.
C. 6 gam.
D. 9 gam.
Đáp án: C
Câu 27: Cho 5,6 gam CaO vào nước tạo thành dung dịch A. Hấp thụ hoàn toàn 2,8 lít khí SO2 (đktc) vào dung dịch A thu được m gam kết tủa. Giá trị của m là
A. 9 gam.
B. 3 gam.
C. 7 gam.
D. 10 gam
Đáp án: A
Câu 28: Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ba(OH)2 dư. Khối lượng chất kết tủa thu được là :
A. 19,7 g
B. 19,5 g
C. 19,3 g
D. 19 g
nCO2 = V : 22,4 = 2,24 : 22,4 = 0,1 mol
Vì Ba(OH)2 dư do đó chỉ xảy ra phản ứng tạo kết tủa
PTHH:
Đáp án: A
Câu 29: Hoà tan 2,8 gam CaO vào nước ta được dung dịch A. Nếu cho khí CO2 sục qua dung dịch A và sau khi kết thúc thí nghiệm thấy có 1 gam kết tủa thì có bao nhiêu lít CO2 đã tham gia phản ứng. Các thể tích khí đo ở đktc.
A. 0,224 lít.
B. 3,360 lít.
C. 2,016 lít hoặc 0,224 lít.
D. 2,24 lít hoặc 3,36 lít
Đáp án: C
Câu 30: Khử 16 gam Fe2O3 bằng CO dư , sản phẩm khí thu được cho đi vào dung dịch Ca(OH)2 dư thu được a gam kết tủa. Giá trị của a là :
A. 10 g
B. 20 g
C. 30 g
D. 40 g
Đáp án: C
Trắc nghiệm Bài 4: Một số axit quan trọng
Bài 1: Kim loại nào sau đây không tác dụng được với dung dịch axit HCl?
A. Al
B. Fe
C. Na
D. Cu
Lời giải
Al, Fe, Na đều tác dụng với dung dịch HCl
Cu không tác dụng với dung dịch HCl
Đáp án: D
Bài 2: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
A. Cu, Zn, Na
B. Au, Pt, Cu
C. Ag, Ba, Fe
D. Mg, Fe, Zn
Lời giải
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là Mg, Fe, Zn.
H2SO4 không phản ứng với Cu, Ag, Pt.
Đáp án: D
Bài 3: Dung dịch H2SO4 loãng phản ứng được với :
A. Au
B. Fe
C. Ag
D. Cu
Lời giải
Au, Ag, Cu là kim loại đứng sau H trong dãy điện hóa học nên không phản ứng được với dd H2SO4 loãng.
Đáp án: B
Bài 4: Để nhận biết dung dịch H2SO4, người ta thường dùng
A. dung dịch NaOH
B. dung dịch KCl
C. dung dịch BaCl2
D. dung dịch CuSO4
Lời giải
Để nhận biết dung dịch H2SO4, người ta thường dùng dung dịch BaCl2 vì tạo kết tủa trắng BaSO4
Đáp án: C
Bài 5: Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
A. Xuất hiện kết tủa hồng.
B. Xuất hiện kết tủa trắng.
C. Xuất hiện kết tủa xanh lam.
D. Xuất hiện kết tủa nâu đỏ.
Lời giải
Hiện tượng: xuất hiện kết tủa trắng
H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Đáp án: B
Bài 6: Các dung dịch đều làm quỳ tím chuyển đỏ là
A. NaCl, HCl
B. HCl, H2SO4
C. NaOH, KOH
D. NaCl, NaOH
Lời giải
Các dung dịch đều làm quỳ tím chuyển đỏ là HCl, H2SO4.
Đáp án: B
Bài 7: Chất dùng để phân biệt các dung dịch không màu: HCl, H2SO4 loãng, BaCl2 là:
A. dd NaOH
B. dd KOH
C. Qùy tím
D. dd NaCl
Lời giải
Chất dùng để phân biệt các dung dịch không màu: HCl, H2SO4 loãng, BaCl2 là qùy tím
Vì
Đáp án: C
Bài 8: Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách:
A. rót từng giọt nước vào axit.
B. rót từng giọt axit vào nước.
C. cho cả nước và axit vào cùng một lúc.
D. cả 3 cách trên đều được.
Lời giải
Để an toàn khi pha loãng H2SO4 đặc cần thực hiện theo cách: rót từng giọt axit vào nước.
Đáp án: B
Bài 9: Khi pha loãng axit sunfuric người ta phải
A. đổ từ từ axit vào nước
B. đổ từ từ nước vào axit
C. đổ nhanh axit vào nước
D. đổ nhanh nước vào axit
Lời giải
H2SO4 tan vô hạn trong nước và tỏa rất nhiều nhiệt. Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy, muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh và không được làm ngược lại
Đáp án: A
Bài 10: Khi pha loãng axit sunfuric từ axit đặc người ta phải:
A. đổ từ từ axit đặc vào nước
B. đổ từ từ nước vào axit đặc
C. đổ nhanh axit đặc vào nước
D. đổ nhanh nước vào axit đặc
Lời giải
Khi pha loãng axit sunfuric từ axit đặc người ta phải đổ từ từ axit đặc vào nước
Đáp án: A
Bài 11: Để nhận biết axit sunfuric và muối sunfat người ta thường dùng
A. BaCl2
B. Ba3(PO4)2
C. BaCO3
D. BaSO4
Lời giải
Để nhận biết axit sunfuric và muối sunfat, ta dùng dung dịch muối BaCl2, Ba(NO3)2 hoặc Ba(OH)2 vì tạo kết tủa trắng
Đáp án: A
Bài 12: Nhỏ từ từ dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy xuất hiện
A. Xuất hiện kết tủa màu trắng
B. Xuất hiện kết tủa màu xanh lam
C. Có bọt khí thoát ra khỏi dung dịch
D. Chất kết tủa màu đỏ
Lời giải
Nhỏ từ từ dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy xuất hiện kết tủa màu trắng
Do BaCl2 + Na2SO4 → BaSO4(↓ trắng) + 2NaCl
Đáp án: A
Bài 13: Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Kim loại R là
A. Fe
B. Zn
C. Mg
D. Al
Lời giải
nH2 = 0,45 mol
Gọi hóa trị của kim loại R là a (a = 1, 2, 3, 4)
2R + 2aHCl → 2RCla + aH2
← 0,45
Áp dụng công thức: m = M.n
|
a |
1 |
2 |
3 |
4 |
|
R |
28 (loại) |
56 (Fe) |
84 (loại) |
112 (loại) |
Vậy kim loại cần tìm là sắt (Fe)
Đáp án: A
Bài 14: Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit H2SO4, thì thu được 2,24 lít H2 (đktc). Kim loại A là
A. Zn
B. Fe
C. Mg
D. Al
Lời giải
Gọi kim loại A có hóa trị n (n = 1, 2, 3, 4)
2A + nH2SO4 → A2(SO4)n + nH2
← 0,1 mol
Áp dụng công thức:
|
n |
1 |
2 |
3 |
4 |
|
A |
32,5 (loại) |
65 (Zn) |
97,5 (loại) |
130 (loại) |
Kim loại A là Zn
Đáp án: A
Bài 15: Hóa chất có thể dùng để nhận bết 2 axit HCl và H2SO4 ?
A. NaOH
B. Ba(OH)2
C. Fe
D. CaO
Lời giải
Hóa chất có thể dùng để nhận bết 2 axit HCl và H2SO4: Ba(OH)2
Đáp án: B
Câu 16: Dãy các chất tác dụng được với dung dịch H2SO4 loãng tạo thành sản phẩm có chất khí là
A. Na2SO3, CaCO3, Zn.
B. Al, MgO, KOH.
C. BaO, Fe, CaCO3.
D. Zn, Fe2O3, Na2SO3.
Viết phản ứng ở từng đáp án
A.
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Zn + H2SO4 → ZnSO4 + H2
B.
2Al + 3H2SO4 → Al2(SO4)3 + 3H2↑
H2SO4 + MgO → H2O + MgSO4
H2SO4 + 2KOH → 2H2O + K2SO4
→ Loại vì có 2 phản ứng với MgO và KOH không sinh ra khí
C.
BaO + H2SO4 → H2O + BaSO4
Fe + H2SO4 → H2 + FeSO4
CaCO3 + H2SO4 → H2O + CO2 + CaSO4
→ Loại vì có 2 phản ứng với BaO không sinh ra khí
D.
H2SO4 + Zn → H2 + ZnSO4
Fe2O3 + 3H2SO4 → Fe2(SO4)3 + 3H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
→ Loại vì có phản ứng với Fe2O3 không sinh ra khí
Đáp án: A
Câu 17: Chất tác dụng với dung dịch HCl tạo thành chất khí nhẹ hơn không khí là:
A. Mg
B. CaCO3
C. Cu
D. Na2SO3.
A. Mg + 2HCl → MgCl2 + H2↑
B. CaCO3 + 2HCl → CaCl2 + CO2 ↑+ H2O
C. Cu + HCl không phản ứng
D. Na2S + 2HCl → CuCl2 + H2S↑
Trong 3 khí H2, CO2, H2S chỉ có khí H2 nhẹ hơn không khí
Đáp án: A
Câu 18: Cho một khối lượng mạt sắt dư vào 500 ml dd HCl, sau phản ứng thu được 3,36 lít khí (đktc). Nồng độ mol của dung dịch HCl đã dùng là
A. 0,5M.
B. 0,6M.
C. 0,15M.
D. 0,3M.
Đáp án: B
Câu 19: Cho a gam sắt vào dung dịch HCl dư. Sau phản ứng thu được 6,72 lít khí hidro ở đktc.Giá trị của a là
A. 5,6 gam.
B. 11,2 gam.
C. 16,8 gam.
D. 22,4 gam.
Đáp án: C
Câu 20: Hòa tan hoàn toàn 5,6 gam Fe cần dùng V(ml) dung dịch HCl 2M. Giá trị của V cần tìm là:
A. 0,1.
B. 100.
C. 50.
D. 300.
nFe = 5,6: 56 = 0,1 (mol)
PTHH: Fe + 2HCl → FeCl2 + H2↑
Theo PTHH: nHCl = 2nFe = 2. 0,1 = 0,2 (mol)
⇒ VHCl = n: CM = 0,2: 2 = 0,1 (lít) = 100 (ml)
Đáp án: B
Câu 21: Cho 16,25 gam kẽm vào 300 gam dung dịch HCl lấy dư, phản ứng hoàn toàn thu được dung dịch A và khí H2. Khối lượng dung dịch A là
A. 316,25 gam.
B. 300,00 gam.
C. 312,35 gam.
D. 315,75 gam.
Vì phản ứng sinh ra khí H2
⇒ mdd sau phản ứng = mdd trước phản ứng – mH2
Ta có:
mdd trước phản ứng = mZn + mdd HCl = 16,25 + 300 = 316,25 gam
⇒ mdd sau phản ứng = 316,25 – 0,25.2 = 315,75 gam
Đáp án: D
Câu 22: Cho 4,8 gam kim loại magie tác dụng vừa đủ với dung dịch axit clohidric. Thể tích khí Hiđro thu được ở đktc là:
A. 44,8 lít
B. 4,48 lít
C. 2,24 lít
D. 22,4 lít
Đáp án: B
Câu 23: Cho 10,5 gam hỗn hợp hai kim loại Zn và Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là
A. 63% và 37%.
B. 61,9% và 38,1%.
C. 61,5% và 38,5%.
D. 65% và 35%.
Chỉ có Zn phản ứng với H2SO4, Cu không phản ứng.
nH2 = 0,1 mol
Đáp án: B
Câu 24: Hỗn hợp X gồm Fe và Al (với tỉ lệ mol 1 : 1). Hòa tan hoàn toàn m gam X bằng dung dịch HCl dư, sau phản ứng thu được 5,6 lít H2 (đktc). Giá trị của m là:
A. 10,2 gam.
B. 8,3 gam.
C. 2,7 gam.
D. 16,6 gam.
Đáp án: B
Câu 25: Cho 1,25 lít dung dịch KOH 1M tác dụng vừa đủ với x lít dung dịch HCl 0,5M. Giá trị của x là
A. 1,25
B. 2,0
C. 2,5
D. 1,5
Đáp án: C
Câu 26: Để trung hòa hoàn toàn 100ml dung dịch NaOH 1M cần vừa đủ V ml dung dịch H2SO4 2M. Giá trị của V là:
A. 25ml.
B. 50ml.
C. 100ml.
D. 200ml.
nNaOH = 0,1.1 = 0,1 (mol)
PTPƯ:
2NaOH + H2SO4 → Na2SO4 + H2O
0,1 → 0,05 (mol)
⇒ VH2SO4 = nH2SO4 : CM = 0,05 : 2 = 0,025 (lít) = 25 (ml)
Đáp án: A
Câu 27: Cho 44,78 gam hỗn hợp A gồm KOH và Ba(OH)2 vào 400 gam dung dịch HCl vừa đủ, phản ứng hoàn toàn thu được dung dịch X. Cô cạn dung dịch X thu được 56,065 gam hỗn hợp muối. Nồng độ phần trăm của BaCl2 trong dung dịch X là
A. 8,42%.
B. 5,34%.
C. 9,36%.
D. 14,01%.
mHCl = 400.7,3% = 29,2 gam
Gọi số mol KOH và Ba(OH)2 lần lượt là x và y mol
Vì sau phản ứng không sinh ra chất khí hay chất kết tủa nên
Đáp án: A
Câu 28: Hòa tan hoàn toàn một hiđroxit của kim loại R bằng dung dịch HCl 14,6% (vừa đủ), sau phản ứng thu được dung dịch chứa muối clorua có nồng độ 17,03%. Công thức hiđroxit của kim loại R là
A. Mg(OH)2.
B. Cu(OH)2.
C. Zn(OH)2.
D. Fe(OH)3.\
| n | 1 | 2 | 3 | 4 |
| R | 12 (loại) | 24 (Mg) | 36 (loại) | 48 (loại) |
→ công thức hiđroxit là Mg(OH)2
Đáp án: A
Câu 29: Hòa tan 2,4 gam oxit của một kim loại hóa trị II vào 21,9 gam dung dịch HCl 10% thì vừa đủ . Oxit đó là:
A. CuO
B. CaO
C. MgO
D. FeO
Đáp án: A
Câu 30: Hòa tan 1,68 gam oxit của 1 kim loại hóa trị II vào 21,9 gam dung dịch HCl 10% thì phản ứng xảy ra vừa đủ. Công thức của oxit là:
A. CuO
B. CaO
C. MgO
D. FeO
Đáp án: B
Câu 31: Hòa tan hoàn toàn 23,2 gam hỗn hợp A gồm (FeO, CuO) cần dùng vừa đủ 200 ml dung dịch H2SO4 1,5M thu được dung dịch X. Phần trăm khối lượng của mỗi chất trong hỗn hợp A là
A. 32,23% và 67,77%.
B. 31,03% và 68,97%.
C. 56,25% và 43,75%.
D. 45,55 và 54,45%.
Đáp án: B
Câu 32: Hòa tan vừa hết 20 gam hỗn hợp CuO và Fe2O3 trong 200 ml dung dịch HCl 3,5M . Khối lượng mỗi oxit trong hỗn hợp là:
A. 4 g và 16 g
B. 10 g và 10 g
C. 8 g và 12 g
D. 14 g và 6 g.
Đáp án: A
Câu 33: Hòa tan 10 gam hỗn hợp chất rắn gồm Fe, FeO và Cu vào dung dịch HCl loãng dư. Kết thúc phản ứng thấy có 2,24 lít khí H2 (đktc) thoát ra và thu được dung dịch B và 0,8 gam chất rắn C. Cô cạn dung dịch B thu được m gam muối. Gía trị của m là:
A. 19,00 gam
B. 19,05 gam
C. 20 gam
D. 20,05 gam
Đáp án: B
Câu 34: Lấy 200 ml dung dịch BaCl2 0,6M tác dụng với 400 ml dung dịch H2SO4 0,5M thu được m gam kết tủa. Giá trị của m là
A. 46,60
B. 34,95
C. 23,30
D. 27,96
Đáp án: D
Câu 35: Khi cho axit tác dụng với bazơ thu được:
A. Muối và khí hiđro.
B. Muối và nước.
C. Dung dịch bazơ.
D. Muối.
Axit + bazơ → muối và nước
Đáp án: B
Câu 36: Phản ứng giữa dung dịch HCl và NaOH là phản ứng
A. Hóa hợp
B. Trung hòa
C. Thế
D. Phân hủy
HCl + NaOH → NaCl + H2O
Phản ứng giữa axit và bazơ được gọi là phản ứng trung hòa.
Đáp án: B
Câu 37: Phản ứng giữa natri hiđroxit và axit sunfuric loãng được gọi là phản ứng
A. hiđrat hóa.
B. oxi hóa – khử.
C. trung hòa.
D. thế.
Phản ứng giữa dd axit và dd bazo được gọi là phản ứng trung hòa.
Đáp án: C
Câu 38: Thêm vài giọt kali hiđroxit vào dung dịch đồng (II) clorua. Sản phẩm thu được là:
A. Cu(OH)2 và KCl.
B. Cu(OH)2 và NaCl.
C. CuOH và KCl.
D. CuOH và NaCl.
2KOH + CuCl2 → Cu(OH)2↓ + 2KCl
Đáp án: A
Câu 39: Để trung hòa 10 ml dung dịch hỗn hợp axit gồm HCl và H2SO4 cần dùng 40ml dung dịch NaOH 0,5M. Mặt khác lấy 100 ml dung dịch hỗn hợp axit trên đem trung hòa bằng một lượng NaOH vừa đủ rồi cô cạn thì thu được 13,2 gam muối khan. Nồng độ mol của mỗi axit trong dung dịch ban đầu lần lượt là
A. 0,8M và 0,6M.
B. 1M và 0,5M.
C. 0,6M và 0,7M.
D. 0,2M và 0,9M.
Gọi nồng độ mol ban đầu của HCl và H2SO4 lần lượt là x và y (M)
Lần 1: 10 ml dd hỗn hợp axit + NaOH: 0,02 (mol)
HCl + NaOH → NaCl + H2O (1)
0,01x → 0,01x (mol)
H2SO4 + 2NaOH → Na2SO4 + 2H2O (2)
0,01y → 0,02y (mol)
Ta có: ∑nNaOH = 0,01x + 0,02y = 0,02 (*)
Lần 2: 100 ml dd hỗn hợp axit + NaOH vừa đủ → 13,2 g muối
⇒ mmuối = mNaCl + mNa2SO4
⇒ 0,1x. 58,5 + 0,1y. 142 = 13,2 (**)
Từ (*) và (**) ⇒ x = 0,8 và y = 0,6
Vậy nồng độ ban đầu của HCl = 0,8M và H2SO4 = 0,6M
Đáp án: A
Trắc nghiệm Bài 5: Luyện tập: Tính chất hóa học của oxit và axit
Bài 1: Cho 1,68 lít CO2 (đktc) sục vào bình đựng 250 ml dung dịch KOH dư. Biết thể tích dung dịch trước và sau phản ứng không thay đổi Nồng độ mol/lit của muối thu được sau phản ứng là
A. 0,2M B. 0,3M
C. 0,4M D. 0,5M
nCO2 = 0,075 mol
Vì KOH dư nên phản ứng tạo ra muối trung hòa
CO2 + 2KOH → K2CO3 + H2O
0,075 mol → 0,075 mol
Vì thể tích dung dịch trước và sau không thay đổi => Vdd = 250 ml = 0,25
lít
Đáp án cần chọn là: B
Bài 2: Dùng 400ml dung dịch Ba(OH)2 0,1M hấp thụ hoàn toàn V lít khí SO2 (đktc). Sau phản ứng thu được muối BaSO3 không tan. Giá trị bằng số của V là:
|
A. 0,896 lít |
B. 0,448 lít |
|
C. 8,960 lít |
D. 4,480 lít |
nBa(OH)2 = 0,04 mol
SO2 + Ba(OH)2 → BaSO3 + H2O
Tỉ lệ 1 1
Phản ứng ?mol 0,04 mol
Từ phương trình => nSO2= n Ba(OH)2 = 0,04 mol
=> VSO2 = nCO2 . 22,4 = 0,04 . 22,4 = 0,896 lít
Đáp án: A
Bài 3: Cho 11,2 lít CO2 vào 500 ml dung dịch NaOH 25% (D = 1,3 g/ml). Nồng độ mol/lit của dung dịch muối tạo thành là
A. 1M B. 2M
C. 2,5M D. 1,5M
nCO2 = 0,5 mol
+) Áp dụng công thức: mdd = D.V = 1,3.500 = 650 gam
=> nNaOH = 4,0625 mol
Xét tỉ lệ:
=> NaOH dư, CO2 hết, phản ứng thu được muối Na2CO3
CO2 + 2NaOH → Na2CO3 + H2O
0,5 mol → 0,5 mol
Đáp án: A
Câu 4: Khi pha loãng axit sunfuric người ta phải
A. đổ từ từ axit vào nước
B. đổ từ từ nước vào axit
C. đổ nhanh axit vào nước
D. đổ nhanh nước vào axit
H2SO4 tan vô hạn trong nước và tỏa rất nhiều nhiệt. Nếu ta rót nước vào H2SO4, nước sôi đột ngột và kéo theo những giọt axit bắn ra xung quanh gây nguy hiểm. Vì vậy, muốn pha loãng axit H2SO4 đặc, người ta phải rót từ từ axit vào nước và khuấy nhẹ bằng đũa thủy tinh và không được làm ngược lại
Đáp án: A
Câu 5: Khi pha loãng axit sunfuric từ axit đặc người ta phải:
A. đổ từ từ axit đặc vào nước
B. đổ từ từ nước vào axit đặc
C. đổ nhanh axit đặc vào nước
D. đổ nhanh nước vào axit đặc
Khi pha loãng axit sunfuric từ axit đặc người ta phải đổ từ từ axit đặc vào nước
Đáp án: A
Câu 6: Kim loại nào sau đây không tác dụng được với dung dịch axit HCl?
A. Al
B. Fe
C. Na
D. Cu
Al, Fe, Na đều tác dụng với dung dịch HCl
Cu không tác dụng với dung dịch HCl
Đáp án: D
Câu 7: Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là
A. Cu, Zn, Na.
B. Au, Pt, Cu.
C. Ag, Ba, Fe.
D. Mg, Fe, Zn.
Dãy kim loại phản ứng được với dung dịch H2SO4 loãng là Mg, Fe, Zn.
H2SO4 không phản ứng với Cu, Ag, Pt.
Đáp án: D
Câu 8: Dung dịch H2SO4 loãng phản ứng được với :
A. Au.
B. Fe.
C. Ag.
D. Cu.
Au, Ag, Cu là kim loại đứng sau H trong dãy điện hóa học nên không phản ứng được với dd H2SO4 loãng.
Đáp án: B
Câu 9: Để nhận biết dung dịch H2SO4, người ta thường dùng
A. dung dịch NaOH.
B. dung dịch KCl.
C. dung dịch BaCl2.
D. dung dịch CuSO4.
Để nhận biết dung dịch H2SO4, người ta thường dùng dung dịch BaCl2 vì tạo kết tủa trắng BaSO4
Đáp án: C
Câu 10: Hiện tượng khi thêm vài giọt dung dịch H2SO4 vào dung dịch BaCl2 là:
A. Xuất hiện kết tủa hồng.
B. Xuất hiện kết tủa trắng.
C. Xuất hiện kết tủa xanh lam.
D. Xuất hiện kết tủa nâu đỏ.
Hiện tượng: xuất hiện kết tủa trắng
H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Đáp án: B
Câu 11: Để nhận biết axit sunfuric và muối sunfat người ta thường dùng
A. BaCl2
B. Ba3(PO4)2
C. BaCO3
D. BaSO4
Để nhận biết axit sunfuric và muối sunfat, ta dùng dung dịch muối BaCl2, Ba(NO3)2 hoặc Ba(OH)2 vì tạo kết tủa trắng
Đáp án: A
Câu 12: Nhỏ từ từ dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy xuất hiện
A. Xuất hiện kết tủa màu trắng
B. Xuất hiện kết tủa màu xanh lam
C. Có bọt khí thoát ra khỏi dung dịch
D. Chất kết tủa màu đỏ
Nhỏ từ từ dung dịch BaCl2 vào dung dịch Na2SO4 ta thấy xuất hiện kết tủa màu trắng
Do BaCl2 + Na2SO4 → BaSO4(↓ trắng) + 2NaCl
Đáp án: A
Câu 13: Hoà tan hết 25,2 gam kim loại R trong dung dịch axit HCl, sau phản ứng thu được 10,08 lít H2 (đktc). Kim loại R là
A. Fe
B. Zn
C. Mg
D. Al
| a | 1 | 2 | 3 | 4 |
| R | 28 (loại) | 56 (Fe) | 84 (loại) | 112 (loại) |
Vậy kim loại cần tìm là sắt (Fe)
Đáp án: A
Câu 14: Hoà tan hoàn toàn 6,5 gam một kim loại A chưa rõ hoá trị vào dung dịch axit H2SO4, thì thu được 2,24 lít H2 (đktc). Kim loại A là
A. Zn
B. Fe
C. Mg
D. Al
| a | 1 | 2 | 3 | 4 |
| A | 32,5 (loại) | 65 (Zn) | 97,5 (loại) | 130 (loại) |
Kim loại A là Zn
Đáp án: A
Câu 15: Hóa chất có thể dùng để nhận bết 2 axit HCl và H2SO4 ?
A. NaOH
B. Ba(OH)2
C. Fe
D. CaO
Hóa chất có thể dùng để nhận bết 2 axit HCl và H2SO4: Ba(OH)2
Đáp án: B
Câu 16: Cho hỗn hợp X gồm Al và Ag phản ứng với dung dịch axit H2SO4 thu được 5,6 lít H2 (đktc). Sau phản ứng còn 3 gam một chất rắn không tan. Thành phần phần trăm theo khối lượng của Ag trong hỗn hợp X ban đầu là
A. 30%.
B. 50%.
C. 40%.
D. 60%.
Đáp án: C
Câu 17: Để hoà tan vừa hết 4,48 gam Fe phải dùng bao nhiêu ml dung dịch hỗn hợp HCl 0,5M và H2SO4 0,75M?
A. 100 ml.
B. 80 ml.
C. 90 ml.
D. 120 ml.
nFe = 0,08 mol
Gọi thể tích dung dịch hỗn hợp axit cần dùng là V (lít)
⇒ nHCl = 0,5V mol; nH2SO4 = 0,75V mol
Fe + 2HCl → FeCl2 + H2
0,25V ← 0,5V
Fe + H2SO4 → FeSO4 + H2
0,75V ← 0,75V
⇒ nFe = 0,25V + 0,75V = 0,08 ⇒ V = 0,08 lít = 80 ml
Đáp án: B
Câu 18: Hòa tan 50,54 gam hỗn hợp X gồm (Fe, Al) trong dung dịch H2SO4 loãng dư thu được V lít khí H2 (đktc) và dung dịch A, cô cạn dung dịch A thu được 178,22 gam hỗn hợp muối. Giá trị của V là
A. 30,240.
B. 29,568.
C. 29,792.
D. 27,328.
Đáp án: C
Câu 19: Cho 10,5 gam hỗn hợp hai kim loại Zn, Cu vào dung dịch H2SO4 loãng dư, người ta thu được 2,24 lít khí (đktc). Thành phần phần trăm theo khối lượng mỗi kim loại trong hỗn hợp ban đầu là:
A. 61,9% và 38,1%
B. 63% và 37%
C. 61,5% và 38,5%
D. 65% và 35%
Đáp án: A
Câu 20: Hòa tan hoàn toàn hỗn hợp (Fe, Mg) bằng dung dịch HCl 20% (vừa đủ) thu được dung dịch A. Trong dung dịch A nồng độ của MgCl2 = 11,787%. Tính C% của FeCl2 trong dung dịch A
A. 22,22%.
B. 14,45%.
C. 24,13%.
D. 15,76%.
Đáp án: D
Câu 21: Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 13,6 g
B. 1,36 g
C. 20,4 g
D. 27,2 g
Đáp án: A
Câu 22: Hoà tan 12,1 g hỗn hợp bột kim loại Zn và Fe cần 400ml dung dịch HCl 1M. Khối lượng hỗn hợp muối thu được sau phản ứng là:
A. 26,3 g
B. 40,5 g
C. 19,2 g
D. 22,8 g
Đáp án: A
Câu 23: Cho 69,75 gam hỗn hợp A gồm CaCO3 và Na2CO3 tác dụng vừa đủ với 337,5 gam dung dịch HCl 14,6% thu được dung dịch X và V lit CO2 (đktc). Giá trị của V là
A. 15,12.
B. 8,40.
C. 6,72.
D. 8,96.
Gọi số mol của CaCO3 và Na2CO3 lần lượt là x và y mol
Đáp án: A
Câu 24: Cho 2,44 gam hỗn hợp muối Na2CO3 và K2CO3 tác dụng vừa đủ với dung dịch H2SO4 0,5M, sau phản ứng thu được 0,448 lít CO2 ở đktc. Thể tích dung dịch H2SO4 0,5 M cần dùng là:
A. 100 ml
B. 40ml
C. 30 ml
D. 25 ml
Đặt x,y lần lượt là số mol của Na2CO3 và (x,y>0)
Na2CO3 + H2SO4 → Na2SO4 + CO2 + H2O (1)
x mol x mol x mol x mol
K2CO3 + H2SO4 → K2SO4 + CO2 + H2O (2)
y mol y mol y mol y mol
Từ phương trình ta dễ thấy muối cacbonat tác dụng với H2SO4 thì
Đáp án: A
Câu 25: Cho 50,9 gam hỗn hợp rắn A gồm BaCl2 và BaCO3 tác dụng vừa đủ với dung dịch H2SO4 thu được V lít CO2 (đktc), 58,25 gam kết tủa và dung dịch X. Giá trị của V là
A. 3,36.
B. 4,48.
C. 2,24.
D. 1,12.
Đáp án: C
Câu 26: Cho 21 gam MgCO3 tác dụng với một lượng vừa đủ dung dịch HCl 2M. Thể tích dung dịch HCl đã dùng là:
A. 2,5 lít
B. 0,25 lít
C. 3,5 lít
D. 1,5 lít
Đáp án: B
Câu 27: Hoà tan 2,84 gam hỗn hợp 2 muối CaCO3 và MgCO3 bằng dung dịch HCl dư thu được 0,672 lít khí CO2 (đktc). Thành phần % số mol mỗi muối trong hỗn hợp lần lượt là:
A. 50% và 50%
B. 33% và 67%
C. 75% và 25%
D. 67% và 33%
Gọi x là thành phần % số mol của CaCO3 trong hỗn hợp thì (1 - x) là thành phần % số mol của MgCO3.
Ta có
Đáp án: D
Câu 28: Cho các dãy chất dưới đây, dãy chất nào tác dụng được với dung dịch axit sunfuric loãng?
A. CuO, Cu, K2O, CO.
B. SO2, CuO, Fe, CO2.
C. KOH, CuO, Fe, BaCl2.
D. CuO, CO2, MgO, K2O.
A. Loại Cu và CO không phản ứng
B. Loại CO2 không phản ứng
C. Thỏa mãn
D. Loại CO2 không phản ứng
Đáp án: C
Câu 29: Dãy gồm các kim loại tác dụng được với dung dịch H2SO4 loãng là:
A. Fe, Cu, Mg.
B. Zn, Fe, Cu.
C. Zn, Fe, Al.
D. Fe, Zn, Ag
Các kim loại đứng trước H2 mới phản ứng được với H2SO4 loãng
A, B loại vì Cu đứng sau H2
D loại vì Ag đứng sau H2
Đáp án: C
Câu 30: Dung dịch HCl không tác dụng với chất nào sau đây?
A. CuO.
B. Ag.
C. NaOH.
D. AgNO3.
Ag là kim loại đứng sau H trong dãy điện hóa nên không tác dụng được với HCl
Đáp án: B
Câu 31: Nhóm chất tác dụng với nước và với dung dịch HCl là:
A. Na2O, SO3, CO2 .
B. K2O, P2O5, CaO.
C. BaO, SO3, P2O5.
D. CaO, BaO, Na2O.
Dễ thấy các đáp án đều là các oxit, oxit phản ứng với nước và dung dịch HCl thì oxit đó là oxit bazo
A loại vì SO3 và CO2 là oxit axit
B loại vì có P2O5 là oxit axit
C loại vì có SO3 và P2O5 là oxit axit
Đáp án: D
Câu 32: Trong công nghiệp, sản xuất axitsunfuric qua mấy công đoạn
A. 1
B. 2
C. 3
D. 4
Sản xuất axit sunfuric gồm 3 giai đoạn:
Giai đoạn 1: Đốt lưu huỳnh cháy trong không khí
Giai đoạn 2: sản xuất SO3 bằng cách oxi hóa SO2
Giai đoạn 3: Cho SO3 tác dụng với nước để điều chế H2SO4
SO3 + H2O → H2SO4
Đáp án: C
Câu 33: Công thức hóa học của axit sunfuric là:
A. HCl.
B. H2SO3.
C. H2SO4.
D. HClO.
CTHH của axit sunfuric là: H2SO4
Đáp án: C
Câu 34: Axit clohiđric có công thức hóa học là:
A. H2SO4
B. HCl
C. H3PO4
D. H2CO3
Axit clohiđric có công thức hóa học là: HCl
Đáp án: B
Câu 35: Dung dịch axit loãng H2SO4 khi phản ứng với chất nào dưới đây mà khí H2 không giải phóng ra (không được sinh ra)?
A. Fe
B. Cu.
C. Mg.
D. Al
Cu là kim loại đứng sau H trong dãy điện hóa nên không phản ứng được với dd H2SO4 loãng, do vậy không sinh ra được khí H2
Đáp án: B
Câu 36: Dãy các chất không tác dụng được với dung dịch H2SO4 loãng là:
A. Zn, ZnO, Zn(OH)2.
B. Cu, CuO, Cu(OH)2.
C. Na2O, NaOH, Na2CO3.
D. MgO, MgCO3, Mg(OH)2.
Oxit bazo, bazo và một số muối tác dụng được với dung dịch H2SO4 loãng
=> Đáp án: B vì có Cu đứng sau H2 không tác dụng được với H2SO4
Đáp án: B
Câu 37: Khi cho kim loại Fe tác dụng với axit H2SO4 đặc, nóng, dư không tạo thành sản phẩm nào trong các sản phẩm sau đây?
A. FeSO4
B. H2O
C. SO2
D. Fe2(SO4)
Đáp án: A
Câu 38: Sự khác biệt trong tính chất hóa học của H2SO4 đặc so với H2SO4 loãng là
A. tác dụng được với oxit bazơ
B. tác dụng được với bazơ
C. tác dụng được với kim loại
D. khả năng hút nước mạnh (tính háo nước)
Axit sunfuric đặc có những tính chất hóa học riêng so với H2SO4 loãng
+ tác dụng với hầu hết kim loại (trừ Au và Pt)
+ tính háo nước
Đáp án: D
Câu 39: Để phân biệt 2 dung dịch HCl và H2SO4 loãng. Ta dùng kim loại
A. Mg
B. Ba
C. Cu
D. Zn
H2SO4 tác dụng với Ba xuất hiện khí và kết tủa trắng còn HCl chỉ xuất hiện khí
PTHH: Ba + H2SO4 → BaSO4↓ + H2↑
Ba + 2HCl → BaCl2 + H2↑
Đáp án: B
Câu 40: Thuốc thử dùng để nhận biết dung dịch HCl và dung dịch H2SO4 là:
A. K2SO4
B. Ba(OH)2
C. NaCl
D. NaNO3
HCl phản ứng với Ba(OH)2 không có hiện tượng còn H2SO4 xuất hiện kết tủa trắng
Ba(OH)2 + H2SO4 → BaSO4↓ + 2H2O
Ba(OH)2 + 2HCl → BaCl2 + 2H2O
Đáp án: B
Câu 41: Hiện tượng khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường là:
A. Không xảy ra hiện tượng gì
B. Đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra
C. Đường tan trong axit tạo dung dịch trong suốt, không có bọt khí thoát ra
D. Đường tan trong axit tạo dung dịch trong suốt, có bọt khí thoát ra.
Khi cho vài giọt axit H2SO4 đặc vào cốc nghiệm chứa 1 ít đường thì đường bị hóa đen, cột chất rắn dâng cao, có khói trắng thoát ra
Đáp án: B
Câu 42: Khả năng tan của H2SO4 trong nước là
A. rất ít
B. ít
C. bình thường
D. nhiều
Axit sunfuric là chất lỏng sánh, không màu, nặng gấp đôi nước, không bay hơi, dễ tan trong nước, tỏa rất nhiều nhiệt.
Đáp án: D
Trắc nghiệm Bài 7: Tính chất hóa học của bazơ
Bài 1: Có 4 lọ không nhãn, mỗi lọ đựng một dung dịch không màu sau: NaCl, Ba(OH)2, NaOH, Na2SO4. Chỉ cần dùng thêm 1 hóa chất nào sau đây để nhận biết các dung dịch trên?
A. quỳ tím
B. dung dịch BaCl2
C. dung dịch KCl
D. dung dịch KOH
Lời giải
Lấy mỗi chất 1 ít cho ra các ống nghiệm khác nhau và đánh số thứ tự tương ứng.
Cho quỳ tím vào mẫu thử từng chất và quan sát, thấy:
- Những dung dịch làm quỳ tím đổi màu là: NaOH và Ba(OH)2, (nhóm 1).
- Những dung dịch không làm quỳ tím đổi màu là: NaCl, Na2SO4 (nhóm 2).
Để nhận ra từng chất trong mỗi nhóm, ta lấy một chất ở nhóm (1), lần lượt cho vào mỗi chất ở nhóm (2), nếu có kết tủa xuất hiện thì chất lấy ở nhóm (1) là Ba(OH)2 và chất ở nhóm (2) là Na2SO4. Từ đó nhận ra chất còn lại ở mỗi nhóm.
Phương trình phản ứng: Ba(OH)2 + Na2SO4 → BaSO4 + NaOH
Đáp án: A
Bài 2: Cho 18,8 gam kali oxit K2O tác dụng với nước, thu được 0,5 lít dung dịch bazơ. Thể tích dung dịch H2SO4 20% có khối lượng riêng 1,14 g/ml cần dùng để trung hòa dung dịch bazơ nói trên là
A. 85,96 ml
B. 171,92 ml
C. 128,95 ml
D. 214,91 ml
Lời giải
= 0,2 mol
K2O + H2O → 2KOH
0,2 mol → 0,4 mol
2KOH + H2SO4 → K2SO4 + H2O
0,4 → 0,2 mol
Áp dụng công thức: m = D.V =>
Đáp án: A
Bài 3: Trung hòa 200 ml dung dịch H2SO4 1M bằng dung dịch NaOH 20%. Khối lượng dung dịch NaOH cần dùng là:
A. 100 g
B. 80 g
C. 90 g
D. 150 g
Lời giải
nH2SO4 = VH2SO4 . CM H2SO4 = 0,2 . 1 = 0,2mol
PTHH: 2NaOH + H2SO4 → Na2SO4 + H2O
2 mol 1 mol
? mol 0,2mol
m NaOH= n NaOH.MNaOH = 0,4 . (23 + 16 + 1) = 16g
C% = mNaOH : m dd NaOH
=> mddNaOH = mNaOH : C% = 16 : 20% = 80g
Đáp án: B
Bài 4: Hòa tan 6,2 gam Na2O vào nước dư thu được dung dịch X. Cho X vào 200 gam dung dịch CuSO4 16% thu được a gam kết tủa. Giá trị của a là
A. 4,9 gam
B. 7,4 gam
C. 9,8 gam
D. 11,8 gam
Lời giải
Na2O + H2O → 2NaOH
0,1 mol → 0,2 mol
2NaOH + CuSO4 → Na2SO4 + Cu(OH)2
Xét tỉ lệ:
=> CuSO4 dư, NaOH phản ứng hết
=> phản ứng tính theo NaOH
Đáp án: C
Bài 5: Trung hòa 300 ml dung dịch H2SO4 1,5M bằng dung dịch NaOH 40%
A. 90 gam
B. 100 gam
C. 180 gam
D. 117 gam
Lời giải
2NaOH + H2SO4 → Na2SO4 + H2O
0,9 mol ← 0,45 mol
=> mNaOH = 0,9.40 = 36 gam => mdd NaOH =
Đáp án: A
Bài 6: Từ những chất có sẵn là Na2O, CaO, MgO, CuO, Fe2O3, K2O và H2O, có thể điều chế được bao nhiêu dung dịch bazơ?
A. 1
B. 2
C. 3
D. 4
Lời giải
Các oxit bazơ tan trong nước tạo thành dung dịch bazơ
Na2O + H2O → 2NaOH
CaO + H2O → Ca(OH)2
K2O + H2O → 2KOH
Đáp án: C
Bài 7: Cần bao nhiêu lít dung dịch NaOH 0,5M để trung hoà 400 ml hỗn hợp dung dịch axit gồm H2SO4 0,5M và HCl 1M?
A. 1,5 lít
B. 0,5 lít
C. 1,6 lít
D. 1,0 lít
Lời giải
Phương trình phản ứng:
H2SO4 + 2NaOH → Na2SO4 + 2H2O
0,2 → 0,4 (mol)
HCl + NaOH → NaCl + H2O
0,4 → 0,4 (mol)
=> ∑nNaOH = 0,4 + 0,4 = 0,8 mol
Đáp án: C
Bài 8: Để trung hòa 112 gam dung dịch KOH 25% thì cần dùng bao nhiêu gam dung dịch axit sunfuric 4,9%:
A. 400 g
B. 500 g
C. 420 g
D. 570 g
Lời giải
mKOH = mddKOH . C% = 112 . 25% = 28g
=> nKOH = mKOH : MKOH = 28 : 56 = 0,5 mol
2KOH + H2SO4 → K2SO4 + H2O
2 mol 1 mol
0,5 mol ?mol
mH2SO4 = n H2SO4.MH2SO4 = 0,25 . (2 + 32 + 64) = 24,5g
C% = mH2SO4 : m dd H2SO4
=> mddH2SO4 = mH2SO4 : C% = 24,5 : 4,9% = 500g
Đáp án: B
Bài 9: Để nhận biết các dung dịch sau: H2SO4, NaOH, HCl, người ta dùng
A. quỳ tím và dung dịch BaCl2.
B. quỳ tím và dung dịch KOH.
C. phenolphtalein.
D. phenolphtalein và dung dịch NaCl.
Lời giải
Dùng quỳ tím:
+ NaOH làm quỳ chuyển màu xanh
+ H2SO4, HCl làm quỳ chuyển màu đỏ
Dùng BaCl2 nhận 2 dung dịch axit:
+ Có kết tủa trắng là H2SO4
H2SO4 + BaCl2 → BaSO4 +2HCl
+ Không có hiện tượng gì là HCl
Đáp án: A
Bài 10: Có 3 lọ mất nhãn đựng các hóa chất sau : HCl , H2SO4 , NaOH. Hãy chọn thuốc thử nào sau đây để nhận biết dung dịch trong mỗi lọ ?
A. Dùng quì tím
B. Dùng dung dịch BaCl2
C. Dùng quì tím và dung dịch BaCl2
D. Dùng quì tím và dung dịch phenol phtalein
Lời giải
Cho quỳ tím lần lượt vào các dung dịch trên:
+ Quỳ tím chuyển sang màu xanh: NaOH
+ Quỳ tím chuyển sang màu đỏ (II): HCl, H2SO4
- Cho dung dịch BaCl2 vào 2 lọ ở dãy (II)
+ Dung dịch xuất hiện kết tủa trắng là H2SO4, còn lại không có hiện tượng là HCl.
BaCl2 + H2SO4 → BaSO4↓+ HCl
Đáp án: C
Bài 11: Phản ứng hoá học nào sau đây tạo ra oxit bazơ ?
A. Cho dd Ca(OH)2 dư phản ứng với SO2
B. Cho dd NaOH phản ứng với dd H2SO4
C. Cho Cu(OH)2 phản ứng với HCl
D. Nung nóng Cu(OH)2
Lời giải
Cho dd Ca(OH)2 phản ứng với SO2
Ca(OH)2 + SO2 → CaSO3 + H2O
=> không tạo ra oxit bazơ
Cho dd NaOH phản ứng với dd H2SO4
2NaOH + H2SO4 → Na2SO4 + H2O
=> không tạo ra oxit bazơ
Cho Cu(OH)2 phản ứng với HCl
Cu(OH)2 + 2HCl → CuCl2 + 2H2O
=> không tạo ra oxit bazơ
Nung nóng Cu(OH)2
Cu(OH)2CuO + H2O
=> tạo ra oxit bazơ là CuO
Đáp án: D
Bài 12: Nhỏ một giọt quỳ tím vào dung dịch KOH, dung dịch có màu xanh, nhỏ từ từ dung dịch HCl cho tới dư vào dung dịch có màu xanh trên thì:
A. Màu xanh vẫn không thay đổi
B. Màu xanh nhạt dần rồi mất hẳn
C. Màu xanh nhạt dần, mất hẳn rồi chuyển sang màu đỏ
D. Màu xanh đậm thêm dần
Lời giải
Nhỏ dung dịch HCl vào dung dịch KOH có phản ứng sau:
HCl + KOH → KCl + H2O
KCl là muối không làm đổi màu quỳ tím nên đến khi HCl phản ứng vừa đủ với KOH thì màu xanh của dung dịch nhạt dần và mất hẳn. Tiếp tục nhỏ dung dịch HCl tới dư thì trong dung dịch lúc này chứa HCl và KCl, HCl là axit làm quỳ chuyển đỏ => dung dịch chuyển sang màu đỏ
Đáp án: C
Bài 13: Cho vài giọt dd Phenolphtalein không màu vào dung dịch NaOH. Hiện tượng xảy ra là:
A. dd không màu
B. dd màu xanh
C. kết tủa trắng
D. dd màu hồng
Lời giải
Dung dịch bazo làm phenolphtalein chuyển màu hồng
Đáp án: D
Bài 14: Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh
B. Làm quỳ tím hoá đỏ
C. Phản ứng được với magie giải phóng khí hiđro
D. Không làm đổi màu quỳ tím
Lời giải
PTHH: Ba(OH)2 + 2HCl → BaCl2 + H2O
Xét tỉ lệ:
=> Ba(OH)2 dư, HCl phản ứng hết
=> Dung dịch sau phản ứng thu được gồm BaCl2 và Ba(OH)2 dư
Vì BaCl2 là muối, không làm đổi màu quỳ, còn Ba(OH)2 là bazơ làm quỳ hóa xanh
=> dung dịch thu được sau phản ứng làm quỳ hóa xanh
Đáp án: A
Bài 15: Nhiệt phân hoàn toàn 19,6 gam Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là:
A. 6,4 gam
B. 9,6 gam
C. 12,8 gam
D. 16 gam
Lời giải
Cu(OH)2 CuO + H2O
Tỉ lệ 1 1
Pứ 0,2 ? mol
Từ pt =>
CuO + H2 Cu + H2O
Tỉ lệ 1 1
Pứ 0,2 ? mol
Từ pt => nCu = nCuO= 0,2 mol
=> mCu = nCu . MCu = 0,2 . 64 = 12,8 gam
Đáp án: C
Câu 16: Cho 200ml dung dịch Ba(OH)2 0,4M vào 250ml dung dịch H2SO4 0,3M. Khối lượng kết tủa thu được là:
A. 17,645 gam
A. 16,475 gam
C. 17,475 gam
D. 18,645 gam
Đáp án: C
Câu 17: Trộn 400 gam dung dịch KOH 5,6% với 300 gam dung dịch CuSO4 16%. Khối lượng kết tủa thu được là:
A. 9,8 gam
A. 14,7 gam
C. 19,6 gam
D. 29,4 gam
Đáp án: C
Câu 18: Cho 200g dung dịch KOH 5,6% vào dung dịch CuCl2 dư, sau phản ứng thu được lượng chất kết tủa là:
A. 19,6 g
A. 9,8 g
C. 4,9 g
D. 17,4
Đáp án: B
Câu 19: Cho 200 ml dung dịch CuCl2 0,15M với dung dịch NaOH vừa đủ, sau phản ứng lọc kết tủa, nung đến khối lượng không đổi thu được m gam chất rắn. Giá trị của m là:
A. 1,2 gam
A. 2,4 gam
C. 4 gam
D. 8 gam
nCuCl2 =0,2.0,15 =0,03 mol → nCu(OH)2 = 0,03 mol
→ nCuO =0,03 mol→ m=2,4 g
Đáp án: B
Câu 20: Nhiệt phân hoàn toàn x gam Fe(OH)3 đến khối lượng không đổi thu được 24 gam chất rắn. Giá trị bằng số của x là:
A. 16,05 gam
A. 32,10 gam
C. 48,15 gam
D. 72,25
Đáp án: B
Câu 21: Nhiệt phân hoàn toàn 19,6g Cu(OH)2 thu được một chất rắn màu đen, dùng khí H2 dư khử chất rắn màu đen đó thu được một chất rắn màu đỏ có khối lượng là:
A. 6,4 g
A. 9,6 g
C. 12, 8 g
D. 16
Đáp án: C
Câu 22: Cho dung dịch chứa 0,9 mol NaOH vào dung dịch có chứa a mol H3PO4. Sau phản ứng chỉ thu được muối Na3PO4 và H2O. Giá trị của a là :
A. 0,3 mol
A. 0,4 mol
C. 0,6 mol
D. 0,9 mol
Đáp án: A
Câu 23: Hòa tan hết 4,6 gam Na vào H2O được dung dịch X. Thể tích dung dịch HCl 1M cần để phản ứng hết với dung dịch X là:
A. 100 ml
A. 200 ml
C. 300 ml
D. 400 ml
Đáp án: B
Câu 24: Trung hoà hoàn toàn 200 ml dung dịch KOH 0,5M bằng 200 gam dung dịch HCl a%. Nồng độ phần trăm của dung dịch (a%) là:
A. 1,825%
A. 3,650%
C. 18,25%
D. 36,50%
Đáp án: A
Câu 25: Khi cho 500ml dung dịch NaOH 1M tác dụng vừa đủ với dung dịch H2SO4 2M tạo thành muối trung hòa. Thể tích dung dịch H2SO4 2M là:
A. 250 ml
A. 400 ml
C. 500 ml
D. 125 ml
Đáp án: D
Câu 26: Cho 200 gam dung dịch KOH 8,4% hoà tan 14,2 gam P2O5. Sản phẩm thu được sau phản ứng chứa các chất tan là
A. K3PO4 và K2HPO4
A. KH2PO4 và K2HPO4
C. K3PO4 và KOH
D. K3PO4 và H3PO4
Vậy xảy ra phản ứng (2) và (3) tạo ra hai muối là KH2PO4 và K2HPO4
Đáp án: B
Câu 27: Sục 2,24 lít khí CO2 vào dung dịch chứa 0,2 mol NaOH. Dung dịch thu được sau phản ứng chứa:
A. NaHCO3
A. Na2CO3
C. Na2CO3 và NaOH
D. NaHCO3 và NaOH
Đáp án: B
Câu 28: Cho dung dịch chứa 0,9 mol NaOH vào dung dịch có chứa a mol H3PO4. Sau phản ứng chỉ thu được muối Na3PO4 và H2O. Giá trị của a là:
A. 0,3 mol
A. 0,4 mol
C. 0,6 mol
D. 0,9 mol
Do phản ứng chỉ thu được muối Na3PO4 do đó ta có phản ứng
Đáp án: A
Câu 29: Cho các chất dưới đây, dãy chất nào toàn là dung dịch kiềm?
A. KOH, Mg(OH)2, Ba(OH)2, NaOH.
A. KOH, Ca(OH)2, Ba(OH)2, NaOH.
C. KOH, Mg(OH)2, Ba(OH)2, Fe(OH)2.
D. Cu(OH)2, Mg(OH)2, Ba(OH)2, NaOH.
A. Loại Mg(OH)2 là bazơ không tan
A. Thỏa mãn
C. Loại Fe(OH)2 là bazơ không tan.
D. Loại Cu(OH)2, Mg(OH)2 là bazơ không tan
Đáp án: B
Câu 30: Dung dịch nào sau đây làm quỳ tím chuyển sang màu xanh?
A. HCl.
A. Ca(OH)2
C. MgCl2.
D. H2SO4
Ca(OH)2 là dd bazơ => làm quỳ tím chuyển sang màu xanh
Đáp án: B
Câu 31: Dung dịch nào sau đây làm quỳ tím chuyển sang màu xanh?
A. HCl
A. KOH
C. NaCl
D. H2SO4
HCl và H2SO4 làm quỳ tím chuyển màu đỏ
KOH làm quỳ tím đổi màu xanh
NaCl không làm quỳ đổi màu
Đáp án: B
Câu 32: Nhiệt phân sắt (III) hiđroxit thu được sản phẩm là:
A. Fe2O3.
A. Fe.
C. Fe2O3 và H2O.
D. Fe và H2O.
Đáp án: C
Câu 33: Hiện tượng khi nhúng quỳ tím vào dung dịch NaOH là:
A. Quỳ chuyển đỏ.
A. Quỳ chuyển xanh.
C. Quỳ chuyển đen.
D. Quỳ không chuyển màu.
Dung dịch NaOH làm quỳ tím chuyển sang màu xanh
Đáp án: B
Câu 34: Cho giấy quỳ tím vào cốc đựng dung dịch Ca(OH)2 thì quỳ tím:
A. Chuyển sang màu đỏ
A. Chuyển sang màu xanh
C. Chuyển sang màu vàng
D. Quỳ không chuyển màu
Cho giấy quỳ tím vào cốc đựng dung dịch Ca(OH)2 thì quỳ tím chuyển sang màu xanh
Đáp án: B
Câu 35: Bazơ nào bị nhiệt phân hủy ?
A. Ba(OH)2.
A. Ca(OH)2.
C. NaOH.
D. Cu(OH)2.
Đáp án: D
Câu 36: Bazơ tan và không tan có tính chất hoá học chung là:
A. Làm quỳ tím hoá xanh
A. Tác dụng với oxit axit tạo thành muối và nước
C. Tác dụng với axit tạo thành muối và nước
D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước
Bazo không tan không làm đổi màu quì tím, không tác dụng với oxit axit => A và B sai
Bazo tan không bị nhiệt phân => D sai
Đáp án: C
Câu 37: Cho các bazơ sau: Fe(OH)3, Al(OH)3, Cu(OH)2, Zn(OH)2. Khi nung nóng các bazơ trên tạo ra dãy oxit bazơ tương ứng là:
A. FeO, Al2O3, CuO, ZnO
A. Fe2O3, Al2O3,CuO, ZnO
C. Fe3O4, Al2O3, CuO, ZnO
D. Fe2O3, Al2O3,Cu2O, ZnO
Các bazo không tan bị nhiệt phân ra các oxit tương ứng
Đáp án: B
Câu 38: Trong các bazo sau: NaOH,Ca(OH)2, Mg(OH)2, Fe(OH)2,Fe(OH)3 các bazo bị phân hủy bởi nhiệt là?
A. Ca(OH)2, Mg(OH)2, Fe(OH)2
A. NaOH,Ca(OH)2, Mg(OH)2
C. Mg(OH)2, Fe(OH)2, Fe(OH)3
D. Ca(OH)2, Mg(OH)2,Fe(OH)3
Mg(OH)2, Fe(OH)2, Fe(OH)3 là các bazo không tan nên dễ bị phân hủy bởi nhiệt.
Đáp án: C
Câu 39: Hòa tan 80 g NaOH vào nước thu được dung dịch có nồng độ 1M. Thể tích dung dịch NaOH là:
A. 1 lít
A. 2 lít
C. 1,5 lít
D. 3 lít
nNaOH = mNaOH : MNaOH = 80 : (23 + 16 + 1) = 2 mol
VNaOH = nNaOH : CM NaOH = 2 : 1 = 2 lít
Đáp án: B
Câu 40: Hòa tan 30 g NaOH vào 170 g nước thì thu được dung dịch NaOH có nồng độ là:
A. 18%
A. 16 %
C. 15 %
D. 17 %
Đáp án: C
Trắc nghiệm Bài 8: Một số bazơ quan trọng
Bài 1: Để nhận biết dd KOH và dd Ba(OH)2 ta dùng thuốc thử là:
A. Phenolphtalein
B. Quỳ tím
C. dd H2SO4
D. dd HCl
Lời giải
KOH và Ba(OH)2 đều làm đổi màu phenolphtalein và quì tím
KOH và Ba(OH)2 tác dụng với HCl không có hiện tượng
KOH tác dụng với H2SO4 không có hiện tượng; Ba(OH)2 tác dụng với H2SO4 xuất hiện kết tủa trắng
KOH + HCl → KCl + H2O
Ba(OH)2 + 2HCl → BaCl2 + H2O
2KOH + H2SO4 → K2SO4 + H2O
Ba(OH)2 + H2SO4→ BaSO4↓ + H2O
Đáp án: C
Bài 2: NaOH có tính chất vật lý nào sau đây ?
A. Natri hiđroxit là chất rắn không màu, ít tan trong nước.
B. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
C. Natri hiđroxit là chất rắn không màu, hút ẩm mạnh và không tỏa nhiệt.
D. Natri hiđroxit là chất rắn không màu, không tan trong nước, không tỏa nhiệt.
Lời giải
NaOH có tính chất vật lí là: NaOH là chất rắn không màu, hút ẩm mạnh, tan nhiều trong nước và tỏa nhiệt.
Đáp án: B
Bài 3: Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là:
A. Ca(OH)2, Na2CO3
B. Ca(OH)2, NaCl
C. Ca(OH)2, NaNO3
D. NaOH, KNO3
Lời giải
Cặp chất không thể tồn tại trong một dung dịch (tác dụng được với nhau) là: Ca(OH)2, Na2CO3 vì xảy ra phản ứng:
Ca(OH)2 + Na2CO3 → CaCO3 ↓ + 2NaOH
Đáp án: A
Bài 4: Để điều chế dung dịch KOH, người ta cho:
A. K2CO3 tác dụng với dung dịch Ca(OH)2
B. K2SO4 tác dụng với dung dịch NaOH
C. K2SO3 tác dụng với dung dịch CaCl2
D. K2CO3 tác dụng với dung dịch NaNO3
Lời giải
Để điều chế KOH ta cho muối của kali tác dụng với bazo nhưng sau phản ứng phải có kết tủa tạo thành
K2CO3 + Ca(OH)2 → 2KOH + CaCO3↓
Đáp án: A
Bài 5: Nếu rót 200 ml dung dịch NaOH 1M vào ống nghiệm đựng 100 ml dung dịch H2SO4 1M thì dung dịch tạo thành sau phản ứng sẽ:
A. Làm quỳ tím chuyển đỏ
B. Làm quỳ tím chuyển xanh
C. Làm dung dịch phenolphtalein không màu chuyển đỏ.
D. Không làm thay đổi màu quỳ tím.
Lời giải
Phương trình hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
Xét tỉ lệ:
=> NaOH và H2SO4 phản ứng vừa đủ với nhau
=> dung dịch thu được có môi trường trung tính => không làm thay đổi màu quỳ tím.
Đáp án: D
Bài 6: Thuốc thử để nhận biết dung dịch Ca(OH)2 là:
A. Na2CO3
B. KCl
C. NaOH
D. NaNO3
Lời giải
Thuốc thử để nhận biết dung dịch Ca(OH)2 là Na2CO3 vì Na2CO3 tạo kết tủa trắng với Ca(OH)2
Na2CO3 + Ca(OH)2 → CacO3 ↓ + 2NaOH
Đáp án: A
Bài 7: Có 2 dung dịch không màu là Ca(OH)2 và NaOH. Để phân biệt 2 dung dịch này bằng phương pháp hoá học dùng
A. HCl
B. CO2
C. phenolphtalein
D. nhiệt phân
Lời giải
Cho 2 dung dịch qua CO2, dd nào xuất hiện kết tủa trắng là Ca(OH)2, còn lại không có hiện tượng là NaOH
CO2 + Ca(OH)2→ CaCO3↓ + H2O
CO2 + NaOH → NaOH + H2O (xảy ra phản ứng nhưng không quan sát được hiện tượng, vì không có gì đặc trưng của phản ứng)
Đáp án: B
Bài 8: Dung dịch có độ bazơ mạnh nhất trong các dung dịch có giá trị pH sau:
A. pH = 8
B. pH = 12
C. pH = 10
D. pH = 14
Lời giải
pH > 7: dung dịch có tính bazơ, pH càng lớn độ bazơ càng lớn
=> pH = 14 có độ bazơ mạnh nhất
Đáp án: D
Bài 9: Nhóm các dung dịch có pH > 7 là:
A. HCl, NaOH
B. H2SO4, HNO3
C. NaOH, Ca(OH)2
D. BaCl2, NaNO3
Lời giải
Nhóm các dung dịch có pH > 7 là các dung dịch bazơ: NaOH, Ca(OH)2
Đáp án: C
Bài 10: Để phân biệt hai dung dịch NaOH và Ba(OH)2 đựng trong hai lọ mất nhãn ta dùng thuốc thử:
A. Quỳ tím
B. HCl
C. NaCl
D. H2SO4
Lời giải
Để phân biệt NaOH và Ba(OH)2 ta dùng dung dịch H2SO4
NaOH không có hiện tượng gì còn Ba(OH)2 tạo kết tủa màu trắng
Ba(OH)2 + H2SO4 → BaSO4 + 2H2O
Đáp án: D
Bài 11: Cho 100ml dung dịch Ba(OH)2 0,1M vào 100ml dung dịch HCl 0,1M. Dung dịch thu được sau phản ứng:
A. Làm quỳ tím hoá xanh
B. Làm quỳ tím hoá đỏ
C. Phản ứng được với magiê giải phóng khí hidrô
D. Không làm đổi màu quỳ tím
Lời giải
nBa(OH)2 = VBa(OH)2 . CMBa(OH)2 = 0,1 . 0,1 = 0,01 mol
nHCl= VHCl. CM HCl = 0,1 . 0,1 = 0,01 mol
PTHH: Ba(OH)2 + 2HCl → BaCl2 + H2O
1 2
0,01 0,01
Từ phương trình ta có tỉ lệ
=> Ba(OH)2 dư => dd có môi trường bazo
=> dd sau phản ứng làm quỳ hóa xanh
Đáp án: A
Bài 12: Dung dịch NaOH và dung dịch KOH không có tính chất nào sau đây?
A. Làm đổi màu quỳ tím và phenophtalein
B. Bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước
C. Tác dụng với oxit axit tạo thành muối và nước
D. Tác dụng với axit tạo thành muối và nước
Lời giải
Dung dịch NaOH và dung dịch KOH không có tính chất : bị nhiệt phân hủy khi đun nóng tạo thành oxit bazơ và nước.
Vì NaOH và KOH đều là bazơ tan.
Đáp án: B
Bài 13: Dung dịch KOH không có tính chất hoá học nào sau đây?
A. Làm quỳ tím hoá xanh
B. Tác dụng với oxit axit tạo thành muối và nước
C. Tác dụng với axit tạo thành muối và nước
D. Bị nhiệt phân huỷ tạo ra oxit bazơ và nước
Lời giải
KOH là bazo tan do đó không bị nhiệt phân
Đáp án: D
Bài 14: Cặp oxit phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ là:
A. K2O, Fe2O3
B. Al2O3, CuO
C. Na2O, K2O
D. ZnO, MgO.
Lời giải
Cặp oxit phản ứng với nước ở nhiệt độ thường tạo thành dung dịch bazơ là: Na2O, K2O.
Đáp án : C
Bài 15: Dãy các bazơ bị phân hủy ở nhiệt độ cao:
A. Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3
B. Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2
C. Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2
D. Zn(OH)2, Ca(OH)2, KOH, NaOH
Lời giải
Dãy các bazơ bị phân hủy ở nhiệt độ cao là: Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2
Đáp án: C
Câu 16: Bazơ nào sau đây không bị phân hủy bởi nhiệt?
A. Mg(OH)2.
B. Cu(OH)2.
C. NaOH.
D. Fe(OH)2.
NaOH là bazơ tan nên không bị nhiệt phân hủy
Các bazo không tan còn lại bị nhiệt phân tạo thành oxit bazo và nước
Đáp án: C
Câu 17: Dung dịch NaOH phản ứng với tất cả các chất trong dãy:
A. Fe(OH)3, BaCl2, CuO, HNO3
B. H2SO4, SO2, CO2, FeCl2
C. HNO3, HCl, CuSO4, KNO3
D. Al, MgO, H3PO4, BaCl2
Dung dịch NaOH phản ứng với : H2SO4, SO2, CO2, FeCl2
Phương trình hóa học:
2NaOH + H2SO4 → Na2SO4 + 2H2O
2NaOH + SO2 → Na2SO3 + H2O
2NaOH + CO2 → Na2CO3 + H2O
2NaOH + FeCl2 → Fe(OH)2 + 2NaCl
Loại A vì CuO không phản ứng
Loại C vì KNO3 không phản ứng
Loại D vì MgO không phản ứng
Đáp án: B
Câu 18: Dung dịch KOH phản ứng với dãy oxit:
A. CO2; SO2; P2O5; Fe2O3
B. Fe2O3; SO2; SO3
C. P2O5; CO2; Al2O3; SO3
D. P2O5; CO2; CuO
Oxit axit và oxit lưỡng tính phản ứng được với dd bazo
CuO, Fe2O3 là oxit bazo
Đáp án: C
Câu 19: Dung dịch NaOH không tác dụng với dung dịch nào sau đây:
A. HCl
B. CuSO4
C. AlCl3
D. H2O
NaOH tác dụng với HCl, CuSO4 và AlCl3
NaOH không tác dụng với H2O
Đáp án: D
Câu 20: Dung dịch Ca(OH)2 phản ứng với tất cả các chất trong dãy chất nào sau đây?
A. NaCl, HCl, Na2CO3, KOH
B. H2SO4, NaCl, KNO3, CO2
C. KNO3, HCl, KOH, H2SO4
D. HCl, CO2, Na2CO3, H2SO4
Dung dịch Ca(OH)2 phản ứng được với : HCl, CO2, Na2CO3, H2SO4
Phương trình phản ứng:
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + CO2 → CaCO3↓ + H2O
Ca(OH)2 + Na2CO3 → CaCO3↓ + 2NaOH
Ca(OH)2 + H2SO4 → CaSO4 + 2H2O
Đáp án: D
Câu 21: Dung dịch KOH tác dụng với nhóm chất nào sau đây đều tạo thành muối và nước ?
A. Ca(OH)2,CO2, CuCl2
B. P2O5; H2SO4, SO3
C. CO2; Na2CO3, HNO3
D. Na2O; Fe(OH)3, FeCl3
Bazo tác dụng với oxit axit và axit tạo muối và nước
Bazo tác dụng với muối tạo thành muối mới và bazo mới
Đáp án: B
Câu 22: Trong nước thải của nhà máy có một số chất có công thức: H2SO3, HCl, KCl, NaNO3, MgSO4. Người ta cho nước thải trên chảy vào bể chứa dung dịch nước vôi trong. Số chất có trong nước thải tác dụng với nước vôi trong là:
A. 5
B. 4
C. 3
D. 2
Chất có trong nước thải tác dụng với nước vôi trong là H2SO3, HCl, MgSO4
Đáp án: C
Câu 23: Sau khi làm thí nghiệm, có những khí thải độc hại: HCl, H2S, CO2, SO2. Dùng chất nào sau đây để loại bỏ chúng là tốt nhất?
A. Muối NaCl
B. Nước vôi trong
C. Dung dịch HCl
D. Dung dịch NaNO3
Dùng dung dịch nước vôi trong (Ca(OH)2) để loại bỏ các khí trên vì đều xảy ra phản ứng
Ca(OH)2 + 2HCl → CaCl2 + 2H2O
Ca(OH)2 + H2S → CaS + 2H2O
Ca(OH)2 + CO2 → CaCO3 + H2O
Ca(OH)2 + SO2 → CaSO3 + H2O
Đáp án: B
Câu 24: Cho từ từ đến dư khí CO2(đktc) vào 200 ml dung dịch nước vôi trong Ca(OH)2 2M. Hiện tượng quan sát được là:
A. Xuất hiện kết tủa trắng sau đó kết tủa tan dần dần đến hết, dung dịch thu được trong suốt.
B. Xuất hiện kết tủa trắng sau đó kết tủa không tan, dung dịch thu được vẩn đục.
C. Xuất hiện kết tủa trắng tách ra khỏi dung dịch nằm ở đáy ống nghiệm.
D. Dung dịch thu được trong suốt.
Vì cho từ từ CO2 vào dd Ca(OH)2 sẽ xảy ra phản ứng:
CO2+ Ca(OH)2→ CaCO3↓( trắng) + H2O
Tiếp tục sục CO2 đến dư:
CO2+ H2O + CaCO3↓ → Ca(HCO3)2 (dung dịch trong suốt)
Đáp án: A
Câu 25: Có ba lọ không nhãn, mỗi lọ đựng một dung dịch các chất sau: NaOH, Ba(OH)2, NaCl. Thuốc thử để nhận biết cả ba chất là:
A. Quỳ tím và dung dịch HCl
B. Phenolphtalein và dung dịch BaCl2
C. Quỳ tím và dung dịch K2CO3
D. Quỳ tím và dung dịch NaCl
- Dùng quỳ tím: Dung dịch NaOH và Ba(OH)2 làm quỳ chuyển xanh, NaCl không làm đổi màu quỳ => nhận biết được NaCl
- Dùng dung dịch K2CO3 : dung dịch NaOH không hiện tượng, dung dịch Ba(OH)2 tạo kết tủa trắng
Ba(OH)2 + K2CO3 → BaCO3 + 2KOH
Đáp án: C
Câu 26: Thành phần phần trăm của Na và Ca trong hợp chất NaOH và Ca(OH)2 lần lượt là:
A. 50% và 54%
B. 52% và 56%
C. 54,1% và 57,5%
D. 57,5% và 54,1%
Công thức tính phần trăm khối lượng của nguyên tố trong hợp chất:
với n là số nguyên tử R có trong 1 phân tử hợp chất đó
Ta có:
Đáp án: D
Câu 27: NaOH rắn có khả năng hút nước rất mạnh nên có thể dùng làm khô một số chất. NaOH dùng để làm khô khí ẩm nào sau đây?
A. H2S.
B. H2.
C. CO2.
D. SO2.
NaOH dùng để làm khô chất không có khả năng phản ứng với nó => H2 không phản ứng được với NaOH
Đáp án: B
Câu 28: Cho 0,224 lít khí CO2 (đktc) hấp thụ hoàn toàn bởi 2 lít dung dịch Ca(OH)2 , chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là:
A. 0,5M
B. 0,005M
C. 0,1M
D. 0,05M
Đáp án: B
Câu 29: Dẫn 1,68 lít khí CO2 (đktc) vào x g dung dịch KOH 5,6%. Để thu được muối KHCO3 duy nhất thì x có giá trị là:
A. 75 g
B. 150 g
C. 225 g
D. 300 g
nCO2 = 0,075 mol
Để phản ứng chỉ thu được muối KHCO3 duy nhất thì chỉ có phản ứng dưới đây xảy ra
Đáp án: A
Câu 30: Cho 2,24 lít khí CO2 ( đktc) hấp thụ hoàn toàn bởi 200 ml dung dịch Ca(OH)2 , chỉ thu được muối CaCO3. Nồng độ mol của dung dịch Ca(OH)2 cần dùng là:
A. 0,5M
B. 0,25M
C. 0,1M
D. 0,05M
nCO2 = VCO2 : 22,4 = 2,24 : 22,4 = 0,1 mol
Theo bài ra ta có sau phản ứng chỉ thu được muối CaCO3 do đó ta có phản ứng
Đáp án: A
Câu 31: Trung hòa 200 gam dung dịch NaOH 10% bằng dung dịch HCl 3,65%. Khối lượng dung dịch HCl cần dùng là
A. 200 gam
B. 300 gam
C. 400 gam
D. 500 gam
Đáp án: D
Câu 32: Dẫn từ từ 1,568 lít khí CO2 (đktc) vào một dung dịch có hòa tan 6,4 gam NaOH.
A. 5,88 gam.
B. 7,42 gam.
C. 8,48 gam.
D. 6,36 gam.
Khối lượng muối thu được: Trước tiên ta phải xem muối nào được tạo thành (NaHCO3 hay Na2CO3).
Đáp án: B
Câu 33: Cho dãy các chất sau: Al, P2O5, Na2O, Fe3O4, ZnO, MgO, CuO, Al2O3, BaO, FeO. Trong các chất trên, số chất tan được trong nước là a; số chất tác dụng được với dung dịch H2SO4 loãng là b ; số chất vừa tan được trong dung dịch HCl, vừa tan được trong dung dịch NaOH là c. Giá trị 15a + 7b +8c bằng
A. 156.
B. 148.
C. 141.
D. 163.
Các chất tan được trong nước là: P2O5, Na2O, BaO → a = 3
Các chất tan được trong dd H2SO4 loãng là: Al, Na2O, Fe3O4, ZnO, MgO, CuO, Al2O3, BaO, FeO → b =9
Các chất vừa tan trong dung dịch HCl, vừa tan được trong dd NaOH là: Al, P2O5, Na2O, ZnO, Al2O3, BaO → c = 6
Vậy giá trị 15a + 7b + 8c = 15.3 + 7.9 + 8.6 = 156 → chọn A
Các phương trình hóa học minh họa
P2O5 + 3H2O → 2H3PO4
Na2O + H2O → 2NaOH
BaO + H2O → Ba(OH)2
2Al + 6HCl → 2AlCl3 + 3H2↑
Na2O + 2HCl → 2NaCl + H2O
ZnO + 2HCl → ZnCl2 + H2O
Al2O3 + 6HCl → 2AlCl3 + 3H2O
BaO + 2HCl → BaCl2 + H2O
FeO + 2HCl → FeCl2 + H2O
2Al + 2NaOH + 2H2O → 2NaAlO2 + 3H2
ZnO + 2NaOH → Na2ZnO2 + H2O
Al2O3 + NaOH → 2NaAlO2 + 3H2O
Đáp án: A
Trắc nghiệm Bài 9:Tính chất hóa học của muối
Bài 1: Phản ứng biểu diễn đúng sự nhiệt phân của muối canxi cacbonat:
A. 2CaCO32CaO + CO + O2
B. 2CaCO3 3CaO + CO2
C. CaCO3 CaO + CO2
D. 2CaCO3 2Ca + CO2 + O2
Lời giải
Phản ứng nhiệt phân CaCO3 là: CaCO3 CaO + CO2
Đáp án: C
Bài 2: Có thể dùng dung dịch HCl để nhận biết các dung dịch không màu sau đây:
A. NaOH, Na2CO3, AgNO3
B. Na2CO3, Na2SO4, KNO3
C. KOH, AgNO3, NaCl
D. NaOH, Na2CO3, NaCl
Lời giải
Dùng dung dịch HCl có thể nhận biết được: NaOH, Na2CO3, AgNO3. Cho dung dịch HCl vào mỗi lọ.
- dung dịch NaOH không hiện tượng
- dung dịch Na2CO3 xuất hiện bọt khí
- dung dịch AgNO3 xuất hiện kết tủa.
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 + H2O
AgNO3 + HCl → AgCl + HNO3
Đáp án: A
Bài 3: Nếu chỉ dùng dung dịch NaOH thì có thể phân biệt được 2 dung dịch muối trong mỗi cặp chất sau:
A. Na2SO4 và Fe2(SO4)3
B. Na2SO4 và K2SO4
C. Na2SO4 và BaCl2
D. Na2CO3 và K3PO4
Lời giải
Khi cho NaOH vào 2 dd chỉ Fe2(SO4)3 xuất hiện kết tủa nâu đỏ, Na2SO4 không có hiện tượng
6NaOH + Fe2(SO4)3 → 3Na2SO4 + 2Fe(OH)3↓
Đáp án: A
Bài 4: Cặp chất nào sau đây không thể tồn tại trong một dung dịch?
A. NaOH, MgSO4
B. KCl, Na2SO4
C. CaCl2, NaNO3
D. ZnSO4, H2SO4
Lời giải
Cặp chất không thể cùng tồn tại trong một dung dịch là cặp chất xảy ra phản ứng với nhau
=> cặp NaOH và MgSO4 không thể cùng tồn tại trong một dung dịch vì xảy ra phản ứng:
2NaOH + MgSO4 → Mg(OH)2 + Na2SO4
Đáp án: A
Bài 5: Các cặp chất nào cùng tồn tại trong một dung dịch?
1. CuSO4và HCl
2. H2SO4 và Na2SO3
3. KOH và NaCl
4. MgSO4và BaCl2
A. (1; 2) B. (3; 4)
C. (2; 4) D. (1; 3)
Lời giải
Các cặp chất cùng tồn tại trong một dung dịch là cặp chất không phản ứng với nhau
=> cặp 1. CuSO4 và HCl và cặp 3. KOH và NaCl
Đáp án: D
Bài 6: Cho dung dịch axit sunfuric loãng tác dụng với muối natrisunfit (Na2SO3). Chất khí nào sinh ra ?
A. Khí hiđro
B. Khí oxi
C. Khí lưu huỳnh đioxit
D. Khí hiđro sunfua
Lời giải
H2SO4 + Na2SO3 → Na2SO4 + SO2 ↑ + H2O
=> chất khí sinh ra là SO2: lưu huỳnh đioxit
Đáp án: C
Bài 7: Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng xanh
B. Có khí thoát ra
C. Có kết tủa đỏ nâu
D. Kết tủa màu trắng
Lời giải
Cho dung dịch NaOH vào ống nghiệm đựng dung dịch FeCl3, xảy ra phản ứng:
3NaOH + FeCl3 → Fe(OH)3 ↓ + 3NaCl
Fe(OH)3 kết tủa màu đỏ nâu
Đáp án: C
Bài 8: Nhỏ dd natri hidroxit vào ống nghiệm chứa dd đồng(II) clorua. Xuất hiện:
A. Kết tủa nâu đỏ
B. Kết tủa trắng
C. Kết tủa xanh
D. Kết tủa nâu vàng
Lời giải
Hiện tượng: xuất hiện kết tủa xanh của Cu(OH)2
PTHH: 2NaOH + CuCl2 → 2NaCl + Cu(OH)2↓
Đáp án: C
Bài 9: Cho dung dịch KOH vào ống nghiệm đựng dung dịch FeCl3, hiện tượng quan sát được là:
A. Có kết tủa trắng
B. Có khí thoát ra
C. Có kết tủa nâu đỏ
D. Kết tủa màu xanh
Lời giải
3KOH + FeCl3 → Fe(OH)3↓+ 3KCl
Fe(OH)3 kết tủa màu nâu đỏ
Đáp án: C
Bài 10: Dãy muối tác dụng với dung dịch axit sunfuric loãng là:
A. Na2CO3, Na2SO3, NaCl
B. CaCO3, Na2SO3, BaCl2
C. CaCO3, BaCl2, MgCl2
D. BaCl2, Na2CO3, Cu(NO3)2
Lời giải
CaCO3 + H2SO4 → CaSO4 + CO2 + H2O
Na2SO3 + H2SO4 → Na2SO4 + SO2 + H2O
BaCl2 + H2SO4 → BaSO4 + 2HCl
Loại A vì NaCl không phản ứng
Loại C vì MgCl2 phản ứng
Loại D vì Cu(NO3)2 phản ứng
Đáp án: B
Bài 11: Cặp chất nào sau đây cùng tồn tại trong một dung dịch?
A. KCl, NaOH
B. H2SO4, KOH
C. H2SO4, KOH
D. NaCl, AgNO3
Lời giải
2 chất không tác dụng được với nhau sẽ cùng tồn tại được trong một dung dịch
A. thỏa mãn
B. H2SO4 + 2KOH → K2SO4 + 2H2O
C. BaCl2 + H2SO4 → BaSO4↓ +2HCl
D. NaCl + AgNO3→ AgCl↓ + NaNO3
Đáp án: A
Bài 12: Dung dịch chất X có pH > 7 và khi cho tác dụng với dung dịch kali sunfat (K2SO4) tạo ra kết tủa. Chất X là:
A. BaCl2
B. NaOH
C. Ba(OH)2
D. H2SO4
Lời giải
Dung dịch chất X có pH > 7 => X là dung dịch bazơ => loại A và D
Dung dịch X tác dụng với dung dịch K2SO4 tạo kết tủa => X là Ba(OH)2
Ba(OH)2 + K2SO4 → BaSO4 ↓ + 2KOH
Đáp án: C
Bài 13: Dung dịch tác dụng được với các dung dịch Fe(NO3)2, CuCl2 là:
A. dung dịch NaOH
B. dung dịch HCl
C. dung dịch AgNO3
D. dung dịch BaCl2
Lời giải
ung dịch tác dụng được với các dung dịch Fe(NO3)2, CuCl2 là dung dịch NaOH vì tạo kết tủa
Fe(NO3)2 + 2NaOH → Fe(OH)2 ↓ + 2NaNO3
CuCl2 + 2NaOH → Cu(OH)2 ↓ + 2NaCl
Đáp án: A
Bài 14: Cho các chất có công thức: Ba(OH)2, MgSO4, Na2CO3, CaCO3, H2SO4. Số chất tác dụng được với dung dịch K2CO3 là:
A. 2
B. 3
C. 4
D. 5
Lời giải
Chất tác dụng được với dung dịch K2CO3 là: Ba(OH)2, MgSO4, H2SO4
Đáp án: B
Bài 15: Để làm sạch dung dịch đồng (II) nitrat Cu(NO3)2 có lẫn tạp chất bạc nitrat AgNO3. Ta dùng kim loại:
A. Mg
B. Cu
C. Fe
D. Au
Lời giải
Để làm sạch dung dịch đồng (II) nitrat Cu(NO3)2 có lẫn tạp chất bạc nitrat AgNO3 ta dùng Cu vì Cu phản ứng được với AgNO3 tạo ra Cu(NO3)2
Cu + 2AgNO3 → Cu(NO3)2 + 2Ag
Đáp án: B
Câu 16: Dung dịch ZnSO4 bị lẫn tạp chất CuSO4 Kim loại nào sau đây làm sạch dung dịch
A. Zn
B. Fe
C. Al
D. Cu
Ta dùng kim loại sao cho đẩy được Cu ra khỏi muối đồng thời muối mới bắt buộc phải là ZnSO4 để tránh thêm tạp chất khác
⇒ kim loại là Zn
Zn + CuSO4 → ZnSO4 + Cu
Lọc loại bỏ kết tủa thu được ZnSO4 tinh khiết
Đáp án: A
Câu 17: Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng:
A. Quỳ tím
B. Dung dịch Ba(NO3)2
C. Dung dịch AgNO3
D. Dung dịch KOH
Để nhận biết 3 lọ mất nhãn đựng 3 dung dịch CuCl2, FeCl3, MgCl2 ta dùng dung dịch KOH vì tạo các kết tủa có màu khác nhau:
- dung dịch CuCl2 tạo kết tủa xanh: CuCl2 + 2NaOH → Cu(OH)3 ↓xanh + 2NaCl
- dung dịch FeCl3 tạo kết tủa đỏ nâu: FeCl3 + 3NaOH → Fe(OH)3 ↓đỏ nâu + 3NaCl
- dung dịch MgCl2 tạo kết tủa trắng: MgCl2 + 2NaOH → Mg(OH)3 ↓trắng + 3NaCl
Đáp án: D
Câu 18: Để nhận biết 3 dung dịch bị mất nhãn : Na2SO4 , HCl , H2SO4 loãng , người ta dùng :
A. Qùi tím
B. Qùi tím và dd BaCl2
C. Qùi tím và Fe
D. dd BaCl2 và dd AgNO3
Lấy mẫu thử của 3 dung dịch
Dùng quì tím
+ Na2SO4 không làm quì đổi màu
+ HCl và H2SO4 làm quì hóa đỏ
Dùng BaCl2 nhận biết HCl và H2SO4
+ không có hiện tượng là HCl
+ Xuất hiện kết tủa trắng là H2SO4
BaCl2 + H2SO4 → BaSO4+ 2HCl
Đáp án: B
Câu 19: Để phân biệt hai dung dịch Na2CO3 và NaCl ta có thể dùng chất có công thức
A. CaCO3
B. HCl
C. Mg(OH)3
D. CuO
Để phân biệt hai dung dịch Na2CO3 và NaCl ta có thể dùng chất HCl vì
Na2CO3 + 2HCl → 2NaCl + H2O + CO2 còn NaCl không tác dụng nên không có hiện tượng
Đáp án: B
Câu 20: Trong các dung dịch dưới đây có mấy dung dịch có thể sử dụng để nhận biết 2 dung dịch Na2SO4 và Na2CO3? Dung dịch HCl, dung dịch BaCl2, dung dịch NaOH, dung dịch Ba(OH)3,
A. 2
B. 3
C. 4
D. 1
Dung dịch có thể sử dụng để nhận biết 2 dung dịch Na2SO4 và Na2CO3 là : Dung dịch HCl
Đáp án: D
Câu 21: Cho 50 gam CaCO3 vào dung dịch HCl dư thu được bao nhiêu lít khí CO2 ở đktc ?
A. 11,2 lít
B. 1,12 lít
C. 2,24 lít
D. 22,4 lít
Đáp án: A
Câu 22: Khi cho 200 gam dung dịch Na2CO3 10,6% vào dung dịch HCl dư, khối lượng khí sinh ra là
A. 4,6 gam
B. 8 gam
C. 8,8 gam
D. 10
Đáp án: C
Câu 23: Cho 20 gam CaCO3 vào 200 ml dung dịch HCl 3M. Số mol chất còn dư sau phản ứng là:
A. 0,4 mol
B. 0,2 mol
C. 0,3 mol
D. 0,25
Đáp án: B
Câu 24: Dung dịch muối đồng (II) sunfat (CuSO4) có thể phản ứng với dãy chất:
A. CO2, NaOH, H2SO4, Fe
B. H2SO4, AgNO3, Ca(OH)3, Al
C. NaOH, BaCl2, Fe, H2SO4
D. NaOH, BaCl2, Fe, Al
Dung dịch CuSO4 phản ứng được với: NaOH, BaCl2, Fe, Al
CuSO4 + 2NaOH → Cu(OH)3↓ + Na2SO4
CuSO4 + BaCl2 → CuCl2 + BaSO4 ↓
CuSO4 + Fe → FeSO4 + Cu
3CuSO4 + 2Al → Al2(SO4)3 + 3Cu
Đáp án: D
Câu 25: CaCO3 có thể tham gia phản ứng với
A. HCl.
B. NaOH.
C. KNO3.
D. Mg.
CaCO3 có thể phản ứng với HCl
CaCO3 + 2HCl → CaCl2 + H2O + CO2↑
Đáp án: A
Câu 26: Cho a gam Na2CO3 vào dung dịch HCl, sau phản ứng thu được 3,36 lít khí ở đktc. Giá trị của a là
A. 15,9 gam
B. 10,5 gam
C. 34,8 gam
D. 18,2
Đáp án: A
Câu 27: Cho 0,1 mol Ba(OH)3 vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là :
A. 2,24 lít
B. 4,48 lít
C. 22,4 lít
D. 44,8 lít
PTHH: Ba(OH)3 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
Tỉ lê: 1 2
Pứ: 0,1 ? mol
Từ PTHH ta có nNH3 = 2nBa(OH)3 = 0,2 mol
⇒ VNH3 = nNH3 . 22,4 = 0,2 . 22,4 = 44,8 lít
Đáp án: B
Câu 28: Trộn dung dịch có chứa 0,1 mol CuSO4 và một dung dịch chứa 0,3 mol NaOH, lọc kết tủa, rửa sạch rồi đem nung đến khối lượng không đổi thu được m g chất rắn. Giá trị m là:
A. 8 gam
B. 4 gam
C. 6 gam
D. 12 gam
Đáp án: A
Câu 29: Khi phân hủy bằng nhiệt 14,2 gam CaCO3 và MgCO3 ta thu được 3,36 lít CO2 ở đktc. Thành phần phần trăm về khối lượng các chất trong hỗn hợp đầu lần lượt là:
A. 29,58% và 70,42%
B. 70,42% và 29,58%
C. 65% và 35%
D. 35% và 65
Đáp án: B
Câu 30: Cho các muối A, B, C, D là các muối (không theo tự) CaCO3, CaSO4, Pb(NO3)2, NaCl. Biết rằng A không được phép có trong nước ăn vì tính độc hại của nó, B không độc nhưng cũng không được có trong nước ăn vì vị mặn của nó; C không tan trong nước nhưng bị phân hủy ở nhiệt ; D rất ít tan trong nước và khó bị phân hủy ở nhiệt độ cao. A, B, C và D lần lượt là
A. Pb(NO3)2, NaCl, CaCO3, CaSO4.
B. NaCl, CaSO4, CaCO3, Pb(NO3)2.
C. CaSO4, NaCl, Pb(NO3)2, CaCO3.
D. CaCO3, Pb(NO3)2, NaCl, CaSO4.
A là Pb(NO3)2 vì kim loại Pb rất độc
B là NaCl vì NaCl là muối ăn, nên có vị mặn
C là CaCO3. CaCO3 là muối không tan và dễ bị nhiệt phân hủy
D là CaSO4. Muối CaSO4 ít tan trong nước và không bị nhiệt phân hủy.
Đáp án: A
Câu 31: Cho dãy các dung dịch: MgCl2, NaOH, H2SO4, CuSO4, Fe(NO3)3. Khi cho dung dịch trên tác dụng với nhau từng đôi một thì số phản ứng không xảy ra là
A. 6.
B. 4.
C. 5
D.
| MgCl2 | NaOH | H2SO4 | CuSO4 | Fe(NO3)3 | |
| MgCl2 | X | - | - | - | |
| NaOH | X | X | X | ||
| H2SO4 | - | - | |||
| CuSO4 | - |
Dấu X là có phản ứng xảy ra
Dấu – là không có phản ứng xảy ra
→ có 6 cặp chất đổ vào nhau không có phản ứng xảy ra.
Đáp án: A
Câu 32: Dãy A gồm các dung dịch : NaOH, HCl, H2SO4; Dãy B gồm các dung dịch: CuSO4, BaCl2, AgNO3. Cho lần lượt các chất ở dãy A phản ứng đôi một với các chất ở dãy
B. Số phản ứng thu xảy ra thu được kết tủa là:
A. 4
B. 5
C. 6
D. 3
Các cặp chất phản ứng là
| CuSO4 | BaCl2 | AgNO3 | |
| NaOH | X | - | X |
| HCl | - | - | X |
| H2SO4 | - | X | X |
Đáp án: B
Câu 33: Trong các dung dịch sau, chất nào phản ứng được với dung dịch BaCl2 ?
A. AgNO3.
B. NaCl.
C. HNO3.
D. HCl.
Điều kiện để muối phản ứng được với dd axit hay muối khác là: sản phẩm tạo thành có chất kết tủa hoặc bay hơi ; hoặc axit tạo thành yếu hơn axit tham gia phản ứng.
BaCl2 + 2AgNO3 → Ba(NO3)2 + 2AgCl↓
Đáp án: A
Câu 34: Dung dịch nào sau đây không phản ứng với dung dịch BaCl2?
A. Na2SO4
B. H2SO4
C. AgNO3
D. HNO3
Dung dịch không phản ứng với dung dịch BaCl2 là HNO3
Đáp án: D
Câu 35: Cho 1,84g hỗn hợp 2 muối ACO3 và BCO3 tác dụng hết với dung dịch HCl thu được 0,672 lít CO2 ở đktc và dung dịch X. Khối lượng muối trong dung dịch X là:
A. 1,17(g)
B. 3,17(g)
C. 2,17(g)
D. 4,17(g)
nCO2 = VCO2: 22,4 = 0,672 : 22,4 = 0,03 mol
Gọi số mol của ACO3 và BCO3 lần lượt là x và y
Từ pt dễ dàng thấy nH2O (1) + nH2O (2) = nCO2 (1) + nCO2 (2) = x + y = nCO2 = 0,03 mol
nHCl (1) + nHCl (2) = 2nCO2 (1) + 2nCO2 (2) = 2 (x + y) = 2nCO2 = 0,06 mol
Áp dụng định luật bảo toàn khối lượng ta có
mACO3 + mBCO3 + mHCl = mACl2 + mBCl2 + mH2O + mCO2
⇒ mACl2 + mBCl2 = mACO3 + mBCO3 + mHCl – (mH2O + mCO2) = 1,84 + 0,06 . 36,5 – (0,03 . 18 + 0,03 . 44) = 2,17g
Đáp án: A
Câu 36: Cho dãy chuyển hóa sau: 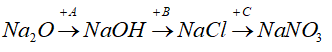
A. H2O, HCl, KNO3
B. H2O, HCl, HNO3
C. H2O, HCl, AgNO3
D. H2O, HCl, Ba(NO3)2
Đáp án: C
Câu 37: Cho sơ đồ sau: 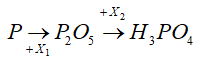
A. O2, H2O
B. O2, H2
C. O2, NaOH
D. O2,
Đáp án: A
Câu 38: Cho PTHH: NaOH + X → Fe(OH)3 + Y. Chất X và Y trong PTHH trên là:
A. FeCl2 và NaCl
B. FeSO4 và NaSO4
C. FeCl3 và NaCl
D. FeCl3 và Na2SO4
Ta có 3NaOH + FeCl3 → Fe(OH)3 + 3NaCl
A sai do FeCl2 + NaOH → Fe(OH)3 + NaCl
B sai do FeSO4 +NaOH → Fe(OH)3 + Na2SO4
D sai do sản phẩm không tạo ra Na2SO4
Đáp án: C
Câu 39: Có dãy chuyển đổi sau: 
Đáp án: C
Câu 40: Có 3 phản ứng hóa học xảy ra theo sơ đồ
Trong sơ đồ trên, A là chất nào trong số 4 chất sau
A. ZnO
B. Zn
C. Zn(OH)3
D. ZnS
C nhiệt phân sinh ra ZnO và H2O ⇒ C là Zn(OH)3
B tác dụng với KOH tạo thành Zn(OH)3 + KCl ⇒ B là ZnCl2
A tác dụng với HCl ⇒ ZnCl2 + H2 ⇒ A là Zn
Đáp án: B
Câu 41:
A. Fe(OH)3 và H2O
B. Fe2O3 và H2O
C. FeO và H2O
D. Phản ứng không xảy ra
Nhiệt phân bazo không tan thu được oxit tương ứng và nước
Đáp án: B
Trắc nghiệm Bài 10: Một số muối quan trọng
Bài 1: Chất nào trong những thuốc thử sau đây có thể phân biệt dung dịch Na2SO4 và dung dịch Na2CO3:
A. dd HCl
B. dd Pb(NO3)2
C. dd BaCl2
D. dd NaOH
Lời giải
Nhỏ HCl vào ống nghiệm chứa Na2SO4 và Na2CO3
+ Na2SO4 không có hiện tượng
+ Na2CO3 có xuất hiện sủi bọt khí
Na2CO3 + HCl → NaCl + CO2↑ + H2O
Đáp án: A
Bài 2: Trộn những cặp chất nào sau đây ta thu được NaCl ?
A. dung dịch Na2CO3 và dung dịch BaCl2
B. dung dịch NaNO3 và CaCl2
C. dung dịch KCl và dung dịch NaNO3
D. dung dịch Na2SO4 và dung dịch KCl
Lời giải
Thu được NaCl bằng cách trộn dung dich Na2CO3 và dung dịch BaCl2 vì xảy ra phản ứng:
Na2CO3 + BaCl2 → BaCO3 ↓ + 2NaCl
Đáp án: A
Bài 3: Hai dung dịch tác dụng với nhau, sản phẩm thu được có NaCl. Hãy cho biết hai cặp dung dịch các chất đã dùng ban đầu là
A. BaCl2 và NaOH
B. MgCl2 và NaOH
C. Na2SO4 và HCl
D. NaNO3 và KCl
Lời giải
Để thu được sản phẩm là NaCl => 2 chất ban đầu tác dụng với nhau, ngoài sản phẩm là NaCl thì chất còn lại là kết tủa hoặc chất khí hoặc H2O
=> 2 chất là MgCl2 và NaOH
PTHH: MgCl2 + 2NaOH → Mg(OH)2 + 2NaCl
Đáp án: B
Bài 4: Điện phân dung dịch NaCl bão hoà, có màng ngăn giữa hai điện cực, sản phẩm thu được là:
A. NaOH, H2, Cl2
B. NaCl, NaClO, H2, Cl2
C. NaCl, NaClO, Cl2
D. NaClO, H2 và Cl2
Lời giải
PT điện phân: 2NaCl + 2H2O 2NaOH + H2 + Cl2
Đáp án: A
Bài 5: Điện phân dung dịch natri clorua (NaCl) bão hoà trong bình điện phân có màng ngăn ta thu được hỗn hợp khí là:
A. H2 và O2
B. H2 và Cl2
C. O2 và Cl2
D. Cl2 và HCl
Lời giải
2H2O + 2NaCl Cl2 + H2 + NaOH
Đáp án: B
Bài 6: Trong tự nhiên muối natri clorua có nhiều trong:
A. Nước biển
B. Nước mưa
C. Nước sông
D. Nước giếng.
Lời giải
Trong tự nhiên muối natri clorua có nhiều trong: nước biển
Đáp án: A
Bài 7: Có những muối sau: CaCO3, CaSO4, Pb(NO3)2, NaCl. Muối nào nói trên:
A. CaCO3
B. CaSO4
C. Pb(NO3)2
D. NaCl
Lời giải
Muối không được phép có trong nước ăn vì tính độc hại của nó là Pb(NO3)2.
Đáp án: C
Bài 8: Nung kali nitrat (KNO3) ở nhiệt độ cao, ta thu được chất khí là:
A. NO
B. N2O
C. N2O5
D. O2
Lời giải
KNO3 bị nhiệt phân: 2KNO32KNO2 + O2
=> chất khí thu được là O2
Đáp án: D
Bài 9: Muối kali nitrat (KNO3):
A. không tan trong trong nước
B. tan rất ít trong nước
C. tan nhiều trong nước
D. không bị phân huỷ ở nhiệt độ cao
Lời giải
Muối kali nitrat (KNO3) là chất rắn, tan nhiều trong nước, khi tan thu nhiệt.
Đáp án: C
Bài 10: Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng:
A. Dung dịch AgNO3
B. Dung dịch HCl
C. Dung dịch BaCl2
D. Dung dịch Pb(NO3)2
Lời giải
Để làm sạch dung dịch NaCl có lẫn Na2SO4 ta dùng dung dịch BaCl2 vì tạo kết tủa với Na2SO4 và chỉ còn lại dung dịch NaCl
Na2SO4 + BaCl2 → BaSO4 + 2NaCl
Đáp án: C
Bài 11: Trường hợp nào tạo ra chất kết tủa khi trộn hai dung dịch sau ?
A. NaCl và AgNO3
B. NaCl và Ba(NO3)2
C. KNO3 và BaCl2
D. CaCl2 và NaNO3
Lời giải
Trường hợp tạo ra chất kết tủa là : NaCl phản ứng với AgNO3
NaCl + AgNO3 → AgCl↓ + NaNO3
Đáp án: A
Bài 12: Cho phương trình phản ứng: Na2CO3 + 2HCl → 2NaCl + X + H2O. X là:
A. CO
B. CO2
C. H2
D. Cl2
Lời giải
PTHH: Na2CO3 + 2HCl → 2NaCl + CO2 ↑ + H2O
=> khí X là CO2
Đáp án: B
Bài 13: Hoà tan 50 gam muối ăn vào 200 gam nước thu được dung dịch có nồng độ là:
A. 15%
B. 20%
C. 18%
D. 25%
Lời giải
Đáp án: B
Bài 14: Để có được dung dịch NaCl 32%, thì khối lượng NaCl cần lấy hoà tan vào 200 gam nước là:
A. 90 gam
B. 94,12 gam
C. 100 gam
D. 141,18 gam
Lời giải
Gọi khối lượng NaCl cần dùng là m (gam)
=> mdungdịch = mNaCl + mH2O = m + 200
Đáp án: B
Bài 15: Súc miệng bằng dung dịch nước muối 0,9% có tác dụng bảo vệ niêm mạc và sát khuẩn. Số gam NaCl cần lấy để pha 300 gam dung dịch nước muối 0,9% là:
A. 5,4g
B. 0,9g
C. 0,27g
D. 2,7g
Lời giải
Đáp án: D
Câu 16: Hoà tan 10,95 gam KNO3 vào 150 gam nước thì được dung dịch bão hoà ở 200C, độ tan của KNO3 ở nhiệt độ này là
A. 6,3 gam
B. 7,0 gam
C. 7,3 gam
D. 7,5 gam
- Độ tan (S) của một chất trong nước là số gam chất đó hòa tan trong 100 gam nước để tạo thành dung dịch bão hòa ở một nhiệt độ xác định.
150 gam nước hòa tan được 10,95 gam KNO3
100 gam nước hòa tan được S gam KNO3
Đáp án: C
Câu 17: Khi làm nguội 1026,4 gam dung dịch bão hòa R2SO4. nH2O (trong đó R là kim loại kiềm và n nguyên, thỏa mãn điều kiện 7 < n < 12) từ 800C xuống 100C thì có 395,4 gam tinh thể R2SO4. nH2O tách ra khỏi dung dịch. Biết độ tan của R2SO4 ở 800C và 100C lần lượt là 28,3 gam và 9 gam. Công thức phân tử của hiđrat nói trên là:
A. Cu
B. Na
C. Al
D. K
Đáp án: B
Câu 18: Cho 500 ml dung dịch NaCl 2M tác dụng với 600 ml dung dịch AgNO3 2M. Khối lượng kết tủa thu được là
A. 143,5 gam
B. 14,35 gam
C. 157,85 gam
D. 15,785 gam
Đáp án: A
Câu 19: Trong phòng thí nghiệm, người ta thường dùng muối KNO3 để điều chế khí oxi bằng phản ứng phân hủy. Để điều chế 1,12 lít khí O2 (đktc) thì khối lượng muối cần dùng là
A. 20,2 gam.
B. 10,1 gam.
C. 5,05 gam.
D. 7,07 gam
Đáp án: B
Câu 20: Có thể phân biệt BaCl2 và NaCl bằng dung dịch:
A. H2SO4.
B. KOH.
C. NaOH.
D. KNO3.
Dùng H2SO4 để phân biệt BaCl2 và NaCl
+ BaCl2 tạo kết tủa trắng, còn NaCl thì không có hiện tượng gì
H2SO4 + BaCl2 → BaSO4↓ trắng + 2HCl
Đáp án: A
Câu 21: Để nhận biết 3 chất rắn NH4NO3 , Ca3 (PO4)2, KCl người ta dùng dung dịch :
A. NaOH
B. Ba(OH)2
C. KOH
D. Na2CO3
Lấy mẫu thử của 3 chất rắn
Nhỏ từ từ dd Ba(OH)2 vào từng mẫu thử
+ Chất rắn tan và xuất hiện khí có mùi khai là NH4NO3
Ba(OH)2 + 2NH4NO3 → Ba(NO3)2 + 2NH3 + 2H2O
+ Chất rắn không tan là Ca3(PO4)2
+ Chất rắn tan không có hiện tượng là KCl(KCl chỉ tan vào nước có trong dd Ba(OH)2 chứ không xảy ra phản ứng hóa học).
Đáp án: B
Trắc nghiệm Bài 11: Phân bón hóa học
Bài 1: Dãy chỉ chứa toàn phân bón hoá học đơn là:
A. KNO3, NH4NO3, (NH2)2CO
B. KCl, NH4H2PO4, Ca(H2PO4)2
C. (NH4)2SO4, KCl, Ca(H2PO4)2
D. (NH4)2SO4, KNO3, NH4Cl
Lời giải
Các phân bón hoá học đơn là: (NH4)2SO4, KCl, Ca(H2PO4)2
Loại A và D vì KNO3 là phân bón kép
Loại B vì NH4H2PO4 là phân bón kép
Đáp án: C
Bài 2: Cho những phân bón có công thức: KNO3, NH4NO3, Ca(H2PO4)2, CO(NH2)2, (NH4)HPO4, KCl, NH4Cl. Số phân bón đơn là:
A. 5 B. 4
C. 3 D. 2
Lời giải
Phân bón đơn là NH4NO3, Ca(H2PO4)2, CO(NH2)2, KCl, NH4Cl
Đáp án: A
Bài 3: Để nhận biết 2 loại phân bón hoá học NH4NO3 và NH4Cl, ta dùng dung dịch:
A. NaOH
B. Ba(OH)2
C. AgNO3
D. BaCl2
Lời giải
Để nhận biết 2 loại phân bón hoá học NH4NO3 và NH4Cl, ta dùng dung dịch AgNO3.
NH4NO3 không hiện tượng, NH4Cl tạo kết tủa trắng
PTHH: NH4Cl + AgNO3 → NH4NO3 + AgCl↓
Đáp án: C
Bài 4: Phân bón nitrophotka (NPK) là hỗn hợp của
A. (NH4)2HPO4, KNO3
B. (NH4)2HPO4, NaNO3
C. (NH4)3PO4, KNO3
D. NH4H2PO4, KNO3
Lời giải
Phân bón nitrophotka (NPK) là hỗn hợp của KNO3 + (NH4)2HPO4
Đáp án: A
Bài 5: Phát biểu nào sau đây sai?
A. Phân ure cung cấp nitơ cho cây trồng.
B. Ure có công thức là (NH2)2CO.
C. Supephotphat có Ca(H2PO4)2.
D. Phân lân cung cấp kali cho cây trồng.
Lời giải
Phát biểu sai là: Phân lân cung cấp kali cho cây trồng.
Vì phân lân cung cấp nguyên tố P cho cây trồng.
Đáp án: D
Bài 6: Trong các hợp chất sau, hợp chất nào có trong tự nhiên dùng làm phân bón hoá học?
A. CaCO3
B. Ca3(PO4)2
C. Ca(OH)2
D. CaCl2
Lời giải
Hợp chất có trong tự nhiên dùng làm phân bón hoá học là Ca3(PO4)2
Đáp án: B
Bài 7: Trong các loại phân bón sau, phân bón hoá học kép là:
A. (NH4)2SO4
B. Ca(H2PO4)2
C. KCl
D. KNO3
Lời giải
Phân bón hoá học kép là phân bón có chứa 2, 3 nguyên tố N, P, K: KNO3
Đáp án: D
Bài 8: Trong các loại phân sau, phân nào là phân bón kép?
A. CO(NH2)2
B. NH4NO3
C. KNO3
D. Ca3(PO4)2
Lời giải
A. CO(NH2)2 chỉ chứa nguyên tố N=> là phân bón đơn
B. NH4NO3 chỉ chứa nguyên tố N => là phân bón đơn
C. KNO3 chứa cả nguyên tố K và N => là phân bón kép
D. Ca3(PO4)2 chỉ chứa nguyên tố P => là phân bón đơn
Đáp án: C
Bài 9: Trong các loại phân bón hoá học sau loại nào là phân đạm ?
A. KCl
B. Ca3(PO4)2
C. K2SO4
D. (NH2)2CO
Lời giải
Phân đạm là : (NH2)2CO (phân urê)
Đáp án: D
Bài 10: Các loại phân bón hóa học đều là những hóa chất có chứa:
A. các nguyên tố dinh dưỡng cần thiết cho cây trồng.
B. nguyên tố nitơ và một số nguyên tố khác.
C. nguyên tố photpho và một số nguyên tố khác.
D. nguyên tố kali và một số nguyên tố khác.
Lời giải
Các loại phân bón hóa học đều là những hóa chất có chứa: các nguyên tố dinh dưỡng cần thiết cho cây trồng.
Đáp án: A
Bài 11: Urê là phân bón rất tốt cho cây, nó cung cấp cho cây hàm lượng nitơ cao. Công thức hóa học của phân urê là:
A. KNO3
B. NH4Cl
C. (NH2)2CO
D. (NH4)2HPO4
Lời giải
Công thức hóa học của phân urê là: (NH2)2CO
Đáp án: C
Bài 12: Để đánh giá chất lượng phân đạm, người ta dựa vào chỉ số
A. % khối lượng NO có trong phân
B. % khối lượng HNO3 có trong phân
C. % khối lượng N có trong phân
D. % khối lượng NH3 có trong phân
Lời giải
Để đánh giá chất lượng phân đạm, người ta dựa vào chỉ số % khối lượng N có trong phân bón.
Ví dụ:
- Ure CO(NH2)2 chứa 46%N.
- Amoni nitrat NH4NO3 chứa 35%N.
- Amoni sunfat (NH4)2SO4 chứa 21%N.
Đáp án: C
Bài 13: Khối lượng của nguyên tố N có trong 200 gam (NH4)2SO4 là
A. 42,42 g
B. 21,21 g
C. 24,56 g
D. 49,12 g
Lời giải
Trong 1 mol (NH4)2SO4 (132 gam) chứa 2 mol N (28 gam)
=> trong 200 gam (NH4)2SO4 chứa = 42,42 gam
Đáp án: A
Bài 14: Phần trăm về khối lượng của nguyên tố N trong (NH2)2CO là :
A. 32,33%
B. 31,81%
C. 46,67%
D. 63,64%
Lời giải
Đáp án: C
Bài 15: Trong các loại phân bón sau, loại phân bón nào có lượng đạm cao nhất ?
A. NH4NO3
B. NH4Cl
C. (NH4)2SO4
D. (NH2)2CO
Lời giải
Để đánh giá chất lượng phân đạm, người ta dựa vào chỉ số % khối lượng N có trong phân bón.
% mN trong NH4NO3 =
% mN trong NH4Cl =
% mN trong (NH4)2SO4 =
% mN trong (NH2)2CO =
Đáp án: D
Câu 16: Trong các hợp chất sau hợp chất có trong tự nhiên dùng làm phân bón hoá học:
A. CaCO3
B. Ca3(PO4)2
C. Ca(OH)2
D. CaCl2
Đáp án: B
Câu 17: Trong các loại phân bón sau, phân bón hoá học kép là:
A. (NH4)2SO4
B. Ca(H2PO4)2
C. NaCl
D. KNO3
Đáp án: D
KNO3 chứa hai nguyên tố dinh dưỡng chính là N và K nên là phân bón hóa học kép.
Câu 18: Trong các loại phân bón hoá học sau loại nào là phân đạm ?
A. KCl
B. Ca3(PO4)2
C. K2SO4
D. (NH2)2CO
Đáp án: D
Phân đạm chứa nguyên tố dinh dưỡng chính là N.
→ (NH2)2CO là phân đạm.
Câu 19: Dãy phân bón hoá học chỉ chứa toàn phân bón hoá học đơn là:
A. KNO3, NH4NO3, (NH2)2CO
B. KCl, NH4H2PO4, Ca(H2PO4)2
C. (NH4)2SO4, KCl, Ca(H2PO4)2
D. (NH4)2SO4, KNO3, NH4Cl
Đáp án: C
Câu 20: Để nhận biết 2 loại phân bón hoá học là: NH4NO3 và NH4Cl. Ta dùng dung dịch:
A. KOH
B. Ca(OH)2
C. AgNO3
D. BaCl2
Đáp án: C
Sử dụng AgNO3
+ Có kết tủa trắng → NH4Cl
NH4Cl + AgNO3 → AgCl (↓ trắng) + NH4NO3
+ Không có hiện tượng gì → NH4NO3
Câu 21: Để nhận biết dung dịch NH4NO3, KCl người ta dùng dung dịch :
A. KOH
B. Ba(OH)2
C. LiOH
D. Na2CO3
Đáp án: B
Sử dụng dung dịch Ba(OH)2
+ Có khí mùi khai thoát ra → NH4NO3
2NH4NO3 + Ba(OH)2 → Ba(NO3)2 + 2NH3 ↑ + 2H2O
+ Không có hiện tượng gì → KCl
Câu 22: Cho 0,2 mol NaOH vào dung dịch NH4NO3 dư thì thể tích thoát ra ở đktc là
A. 2,24 lít
B. 4,48 lít
C. 22,4 lít
D. 44,8 lít
Đáp án: B
Vkhí = nkhí.22,4 = 0,2.22,4 = 4,48 lít.
Câu 23: Khối lượng của nguyên tố N có trong 100 gam (NH4)2SO4 là
A. 42,42 g
B. 21,21 g
C. 24,56 g
D. 49,12 g
Đáp án: B
Câu 24: Phần trăm về khối lượng của nguyên tố N trong (NH2)2CO là:
A. 32,33%
B. 31,81%
C. 46,67%
D. 63,64%
Đáp án: C
Trắc nghiệm Bài 12: Mối quan hệ giữa các loại hợp chất vô cơ
Câu 1: Chất tác dụng với nước tạo ra dung dịch bazơ là:
A. K2O.
B. CuO.
C. CO.
D. SO2.
Đáp án: A
K2O + H2O → 2KOH.
Câu 2: Chất tác dụng với nước tạo ra dung dịch axit là:
A. CaO,
B. BaO,
C. Na2O
D. SO3.
Đáp án: D
SO3 + H2O → H2SO4.c
Câu 3: Dãy oxit tác dụng với nước tạo ra dung dịch kiềm:
A. CuO, CaO, K2O, Na2O.
B. CaO, Na2O, K2O, BaO.
C. Na2O, BaO, CuO, MnO.
D. MgO, Fe2O3, ZnO, PbO.
Đáp án: B.
Câu 4: Dãy oxit tác dụng với dung dịch NaOH:
A. CuO, Fe2O3, SO2, CO2.
B. CaO, CuO, CO, N2O5.
C. CO2, SO2, P2O5, SO3.
D. SO2, MgO, CuO, Ag2O.
Đáp án: C.
Oxit axit (CO2, SO2, P2O5, SO3) tác dụng được với dung dịch NaOH.
Câu 5: Dãy oxit vừa tác dụng với nước, vừa tác dụng với dung dịch axit là:
A. CuO, Fe2O3, SO2, CO2.
B. CaO, CuO, CO, N2O5.
C. CaO, Na2O, K2O, BaO.
D. SO2, MgO, CuO, Ag2O.
Đáp án: C.
Câu 6: Hấp thụ hoàn toàn 11,2 lít khí CO2 (đktc) bằng một dung dịch chứa 20 g NaOH. Muối được tạo thành là:
A. Na2CO3.
B. NaHCO3.
C. Hỗn hợp Na2CO3 và NaHCO3.
D. Na(HCO3)2.
Đáp án: B.
→ Sau phản ứng thu được muối NaHCO3.
Câu 7: Hoà tan 6,2 g natri oxit vào 193,8 g nước thì được dung dịch A. Nồng độ phần trăm của dung dịch A là:
A. 4%.
B. 6%.
C. 4,5%
D. 10%
Đáp án: A
Số mol Na2O = 6,2 : 62 = 0,1 mol
Câu 8: Oxit nào sau đây khi tác dụng với nước tạo ra dung dịch có pH > 7 ?
A. CO2
B. SO2
C. CaO
D. P2O5
Đáp án: C
CaO + H2O → Ca(OH)2
Dung dịch Ca(OH)2 có pH > 7.
Câu 9: Cho 2,24 lít CO2 (đktc) tác dụng với dung dịch Ba(OH)2 dư. Khối lượng chất kết tủa thu được là :
A. 19,7 g
B. 19,5 g
C. 19,3 g
D. 19 g
Đáp án: A
Số mol CO2 = 2,24 : 22,4 = 0,1 mol
→ m↓ = 0,1.197 = 19,7 gam.
Câu 10: Dùng thuốc thử nào sau đây để phân biệt các chất chứa trong các ống nghiệm mất nhãn: HCl, KOH, NaNO3, Na2SO4.
A. Dùng quì tím và dung dịch CuSO4.
B. Dùng dung dịch phenolphtalein và dung dịch BaCl2.
C. Dùng quì tím và dung dịch BaCl2.
D. Dùng dung dịch phenolphtalein và dung dịch H2SO4.
Đáp án: C
- Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl.
+ Quỳ tím chuyển sang màu xanh → KOH.
+ Quỳ tím không chuyển màu → NaNO3 và Na2SO4.
- Phân biệt NaNO3 và Na2SO4: Dùng BaCl2
+ Xuất hiện kết tủa trắng → Na2SO4.
BaCl2 + Na2SO4 → BaSO4↓ + 2NaCl
+ Không hiện tượng → NaNO3.
Câu 11: Hiện tượng gì sẽ xảy ra khi cho dung dịch HCl vào ống nghiệm chứa KHCO3?
A. Có khí thoát ra và có kết tủa
B. Chỉ có kết tủa trắng
C. Có khí thoát ra và dung dịch trong suốt
D. Dung dịch có màu vàng
Đáp án: C
Câu 12: Điều kiện để muối phản ứng với muối là:
A. Hai muối tham gia phản ứng đều phải tan
B. Hai muối đem phản ứng phải có một muối không tan
C. Hai muối tham gia phản ứng đều phải tan, hai muối tạo thành ít nhất phải có một muối không tan
D. Hai muối tạo thành ít nhất phải có một muối không tan
Đáp án: C
Câu 13: Cho 30,4 gam oxit kim loại M vào 294 gam đung dịch H2SO$_{4}4 20% vừa đủ. Công thức hóa học của oxit trên là:
A. Al2O3
B. Fe2O3
C. Cr2O3
D. FeO
Đáp án: C
Câu 14: Cho a gam một bazo vào dung dịch HCl loãng dư, cô cạn dung dịch sau phản ứng thì thu được 3,25 gam muối clorua khan. Mặt khác, cũng đem nung nóng a gam lượng bazo trên đến khối lượng không đổi thì thu được 1,6 gam một oxit kim loại. Công thức phân tử của bazo là:
A. Fe(OH)3
B. Ba(OH)2
C. Zn(OH)2
D. Ni(OH)2
Đáp án: A
Câu 15: Trộn 13,44 gam dung dịch KOH 25% với 32,5 gam dung dịch FeCl3 20%. Sau phả ứng xảy ra hoàn toàn thu được khối lượng kết tủa là bao nhiêu ?
A. 3 gam
B. 3,14 gam
C. 4,14 gam
D. 2,14 gam
Đáp án: D
Câu 16: Hoà tan 50 g CaCO3 vào dung dịch axit clohiđric dư.Thể tích của khí CO2 (đktc) thu được là:
A. 11,2 lít.
B. 22,4 lít.
C. 8,96 lít.
D. 5,6 lít.
Đáp án: A
Câu 17: Phát biểu nào sau đây là đúng?
A. Tất cả các muối cabonat đều tan
B. Tất cả các muối của kim loại K, Na đều tan
C. Tất cả các muối của kim loại Cu, Ag đều tan
D. Tất cả các muối sunfat đều không tan
Đáp án: B
Câu 18: Cho 40 gam Cu và ZnO tác dụng với dung dịch HCl loãng, dư, lọc lấy phần không tan cho tác dụng với H2SO4 đặc, nóng thì thu được 5,6 lít khí (đktc). Thành phần phần trăm khối lượng các chất trong hỗn hợp lần lượt là:
A. 30% và 70%
B. 60% và 40%
C. 70% và 30%
D. 40% và 60%
Đáp án: D
Câu 19: Nếu chỉ dùng dung dịch KOh thì có thể phân biệt được hai chất trong mỗi cặp chất nào sau đây?
A. Dung dịch K2SO4 và dung dịch Fe2(SO4)3
B. Dung dịch K2SO4 và dung dịch K2CO3
C. Dung dịch K2SO4 và dung dịch BaCl2
D. Dung dịch K2SO4 và dung dịch KCl
Đáp án: A
Câu 20: Cho 100ml dung dịch H2SO4 2M tác dụng với 100ml dung dịch Ba(NO3)2 1M. Nồng độ mol của các chất trong dung dịch sau phản ứng lần lượt là:
A. 2M và 1M
B. 1,5M và 0,5M
C. 1M và 2M
D. 1M và 0,5M
Đáp án: D
Trắc nghiệm Bài 13: Luyện tập chương 1: Các loại hợp chất vô cơ
Câu 1: Có 3 lọ mất nhãn đựng riêng biệt 3 dung dịch của 3 chất: HCl, Na2SO4, NaOH . Chỉ dùng một hóa chất nào sau đây để phân biệt chúng ?
A. Dung dịch BaCl2
B. Quỳ tím
C. Dung dịch Ba(OH)2
D. Zn
Đáp án: B
Sử dụng quỳ tím:
+ Quỳ tím chuyển sang màu đỏ → HCl
+ Quỳ tím chuyển sang màu xanh → NaOH
+ Quỳ tím không chuyển màu → Na2SO4.
Câu 2: Khi cho từ từ dung dịch NaOH cho đến dư vào ống nghiệm đựng dung dịch hỗn hợp gồm HCl và một ít phenolphtalein. Hiện tượng quan sát được trong ống nghiệm là:
A. Màu đỏ mất dần.
B. Không có sự thay đổi màu
C. Màu đỏ từ từ xuất hiện.
D. Màu xanh từ từ xuất hiện.
Đáp án: C
Trong dung dịch sau phản ứng có NaOH dư làm cho phenolphtalein chuyển sang màu đỏ.
Câu 3: Cho 0,1mol kim loại kẽm vào dung dịch HCl dư. Khối lượng muối thu được là:
A. 13,6 g
B. 1,36 g
C. 20,4 g
D. 27,2 g
Đáp án: A
→ mmuối = 0,1.(65 + 35,5.2) = 13,6 gam.
Câu 4: Cho 0,2 mol Canxi oxit tác dụng với 500ml dung dịch HCl 1M. Khối lượng muối thu được là:
A. 2,22 g
B. 22,2 g
C. 23,2 g
D. 22,3 g
Đáp án: B
nHCl = 0,5.1 = 0,5 mol
Có 
mmuối = 0,2. (40 + 71) = 22,2 gam.
Câu 5: Dung dịch axit clohiđric tác dụng với sắt tạo thành:
A. Sắt (II) clorua và khí hiđrô.
B. Sắt (III) clorua và khí hiđrô.
C. Sắt (II) Sunfua và khí hiđrô.
D. Sắt (II) clorua và nước.
Đáp án: A
Fe + 2HCl → FeCl2 + H2
Câu 6: Dung dịch muối tác dụng với dung dịch axit clohiđric là:
A. Zn(NO3)2
B. NaNO3.
C. AgNO3.
D. Cu(NO3)2.
Đáp án: C
AgNO3 + HCl → AgCl ↓ + HNO3
Câu 7: Axit sunfuric đặc nóng tác dụng với đồng kim loại sinh ra khí:
A. CO2.
B. SO2.
C. SO3.
D. H2S.
Đáp án: B
Câu 8: Dãy các kim loại đều tác dụng với dung dịch axit clohiđric:
A. Al, Cu, Zn, Fe.
B. Al, Fe, Mg, Ag.
C. Al, Fe, Mg, Cu.
D. Al, Fe, Mg, Zn.
Đáp án: D
Cu và Ag không tác dụng với axit HCl.
Câu 9: Thuốc thử để nhận biết dung dịch Ca(OH)2 là
A. K2CO3
B. KCl
C. KOH
D. KNO3
Đáp án: A.
Ca(OH)2 + K2CO3 → CaCO3 ↓ + 2KOH
Câu 10: Hòa tan 3,1 gam Na2O vào nước được 2 lít dung dịch. Nồng độ mol của dung dịch thu được là:
A. 0,05 M
B. 0,1 M
C. 0,3M
D. 0,4M
Đáp án: A
Số mol Na2O = 3,1 : 62 = 0,05 mol
Câu 11: Nhóm chất tác dụng với dung dịch HCl và với dung dịch H2SO4 loãng là:
A. CuO, BaCl2, ZnO
B. CuO, Zn, ZnO
C. CuO, BaCl2, Zn
D. BaCl2, Zn, ZnO
Đáp án: B
Câu 12: Để làm sạch dung dịch FeCl2 có lẫn tạp chất CuCl2 ta dùng:
A. H2SO4 .
B. HCl.
C . Al.
D. Fe.
Đáp án: D
Câu 13: Nhôm hoạt động hoá học mạnh hơn sắt, vì:
A. Al, Fe đều không phản ứng với HNO3 đặc nguội.
B. Al có phản ứng với dung dịch kiềm.
C. Nhôm đẩy được sắt ra khỏi dung dịch muối sắt.
D. Chỉ có sắt bị nam châm hút.
Đáp án: C
Câu 14: Dãy các bazơ bị phân hủy ở nhiệt độ cao:
A.Ca(OH)2, NaOH, Zn(OH)2, Fe(OH)3
B. Cu(OH)2, NaOH, Ca(OH)2, Mg(OH)2
C.Cu(OH)2, Mg(OH)2, Fe(OH)3, Zn(OH)2
D. Zn(OH)2, Ca(OH)2, KOH, NaOH
Đáp án: C
Câu 15: Dẫn 22,4 lít khí CO2 ( đktc) vào 200g dung dịch NaOH 20%. Sau phản ứng tạo ra sản phẩm nào trong số các sản phẩm sau:
A. Muối natricacbonat và nước.
B. Muối natri hidrocacbonat
C. Muối natricacbonat.
D.Muối natrihiđrocacbonat và natricacbonat
Đáp án: B
Câu 16: Hòa tan 12,2 gam hỗn hợp MgO và Al2O3 vào dung dịch HCl 20% thu được 31,45 gam hỗn hợp muối. Mặt khác, để trung hòa lượng axit dư cần dùng 20ml dung dịch NaOH 2M. Khối lượng dung dịch HCl ban đầu là:
A. 27,01 gam
B. 108,04 gam
C. 135,05 gam
D. 54,02 gam
Đáp án: C
Câu 17: Đốt cháy hoàn toàn một kim loại A có khối lượng 4,05 gam trong bình chứa oxi dư, sau phản ứng thu được 7,56 gam oxit của kim loại A. Hòa tan hoàn toàn lượng oxit trên bằng dung dịch HCl 20%, khối lượng dung dịch axit HCl đã dùng là:
A. 41,06 gam
B. 54 gam
C. 10,15 gam
D. 80,3 gam
Đáp án: D
Câu 18: Dùng hết 5kg than (chứa 90% C và 10% tạp chất không cháy) để đun nấu. Thể tích không khí cần dùng là bao nhiêu?
A. 40 m3
B. 41 m3
C. 42 m3
D. 45 m3
Đáp án: C
Câu 19: Cho phản ứng quang hợp của cây xanh:
6CO2 + 6H2O → C6H12O6 + 6CO2
Biết rắng mỗi hecta cây trồng mỗi ngày hấp thụ khoảng 374 kg CO2 thì thải vào không khí khối lượng oxi bằng bao nhiêu?
A. 272 kg
B. 220 kg
C. 252 kg
D. 300 kg
Đáp án: A
Câu 20: Cho 307 gam Na2CO3 tsc dụng với 365 gam dung dịch HCl nồng độ a%. Sau phản ứng thu được dung dịch muối có nồng độ 9%. a có giá trị là:
A. 10
B. 15
C. 5
D. 20
Đáp án: A
Câu 21: Hòa tan hoàn toàn 10,2 gam một oxit kim loại có hóa trị III cần vừa đủ 331,8 gam dung dịch H2SO4. Dung dịch muối sau phản ứng có nồng độ 10%. Công thức phân tử của oxit trên là:
A. Fe2O3
B. Al2O3
C. Cr2O3
D. Mn2O3
Đáp án: B
Câu 22: Cho Ba(OH)2 dư vào dung dịch chứa FeCl3, CuSO4, AlCl3 thu được kết tủa. Nung kết tủa đến thu được trong không khí đến khi có khối lượng không đổi thu được chất rắn X. Trong chất rắn X gồm:
A. FeO, CuO, Al2O3
B. Fe2O3, CuO, BaSO4
C. Fe3O4, CuO, BaSO4
D. Fe2O3, CuO
Đáp án: B
Câu 23: Thuốc thử để phân biệt dung dịch natrisunfat và dung dịch natri cacbonat là:
A. Axit clohidric
B. Chì (II) nitrat
C. Bạc nitrat
D. Bari clorua
Đáp án: A
Câu 24: Thêm từ từ dung dịch H2SO4 10% vào một dung dịch muối cacbonat của kim loại hóa trị I cho tới khi khí CO2 vừa thoát ra hết thì thu được dung dịch muối sunfat có nồng độ 13,63%. Công thức phân tử của muối cacbonat trên là:
A. K2CO3
B. Na2CO3
C. LiCO3
D. Li2CO3
Đáp án: B
Câu 25: Tìm công thức phân tử của hợp chất chứa 40% Cu, 20% S và 40% O, biết rằng trong phân tử chỉ có 1 nguyên tử lưu huỳnh.
A. CuSO3
B. CuSO4
C. CuSO2
D. Cu2SO4
Đáp án: C